蛴螬提取物对兔光损伤视网膜变性Fas、FasL表达的影响
2019-10-19蒋鹏飞吴大力彭清华1
蒋鹏飞,吴大力,彭 俊,彭清华1,∗
(1.湖南中医药大学,湖南 长沙410208;2.广西中医药大学第一附属医院,广西 南宁530023;3.湖南中医药大学第一附属医院,湖南 长沙410007;4.中医药防治眼耳鼻咽喉疾病湖南省重点实验室,湖南 长沙410208)
随着激光在眼科检查及治疗中的广泛应用,由激光所致的医源性视网膜光损伤也越来越多,许多眼科疾病的发生与视网膜长期光照的积累效应有关[1,2],如老年性黄斑变性等。中药材蛴螬在眼科的应用较早,早在《晋书》中就有此药治疗目疾的记载:“吴中书郎战冲,母王氏失明,婢取蛴螬蒸熟与食,王以为美,冲还知之,抱母恸哭,母目即开。”为观察不同剂量蛴螬提取物对光损伤后视网膜变性组织凋亡的作用,本实验对视网膜光损伤后凋亡因子Fas、Fas L的表达进行了检测。
1 材料
1.1 实验动物
选用30只健康实验性兔,均为雄性,体重1.8~2.3 kg(湖南中医药大学动物实验室提供,合格证号:医动字第20-002号)。
1.2 主要仪器
电子秤(上海天平仪器厂,JY0001);眼科手术显微镜(苏州医疗器械设备厂,YZZOT);PCR仪(德国,Biometra);凝胶成像系统(美国,Bio-Rad[Gel Doc XR+]);微量移液器(德国,eppendorf[1 mL/200μL/10μL]);垂直板电泳槽(北京六一仪器厂,DYCZ-24D);台式高速冷冻离心机(Thermo);水平电转槽(北京六一仪器厂,DYCP-40C);超纯水仪(millipore公司);紫外可见分光光度计(上海spectrum公司,SP-752);恒温摇床(金坛,THZ-82A);水平摇床(北京六一仪器厂,WD-9405B);压片夹(koda);扫描仪(日本Canon,9000F MarkⅡ)。
1.3 主要实验药品和试剂
蛴螬提取物(参照谭涵宇所用制备方法[3]制取);Harris苏木素(湖南中医药大学病理实验室,批号:71020784);PV9000型二抗试剂盒(北京中杉金桥生物技术公司,批号:zb-5301);细胞裂解液(江苏碧云天,批号:P0013);RIPA蛋白裂解液(武汉赛维尔生物科技有限公司,批号:G2002);ECL发光试剂盒(武汉赛维尔生物科技有限公司,批号:G2014);Bradford蛋白浓度测定试剂盒(江苏碧云天,批号:P0006);转移缓冲液(武汉赛维尔生物科技有限公司,G2017);羊抗兔二抗(武汉赛维尔生物科技有限公司,批号:GB23303)。
2 实验方法
2.1 分组方法
通过随机数字表法将30只实验性兔评价分为空白组(A)、模型组(B)、蛴螬低剂量组(C)、蛴螬中剂量组(D)、蛴螬高剂量组(E)。
2.2 造模方法
采用自制光化学损伤装置[3]对实验动物进行光照,总光照时间为36h。A组不施行光损伤造模。
2.3 给药方法
A、B组每日以生理盐水5 mL/kg灌胃;C组按照0.45 g/kg配成5mL蛴螬提取物混悬液;D组按照成人日用量10倍剂量灌胃,将0.9 g/kg蛴螬提取物配成5 mL蛴螬提取物混悬液;E组按照成人日用量20倍剂量灌胃,将1.8g/kg蛴螬提取物配成5 mL蛴螬提取物混悬液,每日灌胃1次,灌胃14天。
2.4 取材方法
灌胃结束后24h取材。将动物处死后,剪开眼球壁,剥离激光斑部位视网膜,脱水、石蜡包埋后切片烘干备用。从每组眼球中选取1只用于HE染色和免疫组化检测,另只眼球用于Western blot检测Fas、FasL蛋白表达。
2.5 指标检测
2.5.1 HE染色观察标本视网膜细胞结构 经脱水、脱蜡、染色、封片等步骤,观察视网膜组织在光学显微镜下的细胞结构。
2.5.2 Fas、FasL免疫组化检测 石蜡切片脱蜡,用PBS冲洗3次,3%H2O2室温孵育10 min,蒸馏水冲洗,滴加Fas、FasL单克隆抗体,室温或37℃孵育1~2 h,PBS冲洗2min×3次,滴加一抗,冲洗后滴加二抗,复染,封片。在高倍率显微镜下随机选择5个视网膜视野测量各个指标阳性积分光密度。
2.5.3 Western blot法检测视网膜Fas、Fas L蛋白表达组织块剪碎、裂解,测定蛋白质含量,加电转移缓冲液,显色后对图像进行灰度分析。
2.6 统计分析方法
采用SPSS23.0统计学软件进行正态性和方差齐性检验,数据以均数±标准差(±s)表示,采用单因素方差分析。P<0.05为差异有统计学意义。
3 结果
3.1 各组实验性兔视网膜组织HE染色结果
A组:实验性兔视网膜结构层次分明;B组:视网膜层次结构模糊,分界不清,出现不规则淡染;C组:视网膜外核层胞核排列较疏松;D组:视网膜外核层增厚,视网膜外核层胞核排列较整齐密集;E组:视网膜外核层胞核排列较整齐,厚度有增加。见图1。
3.2 蛴螬对兔视网膜Fas、FasL表达影响的免疫组化结果
A组视网膜外核层细胞浆中Fas、FasL含量较少。B组视网膜外核层细胞浆中Fas、FasL阳性物质弥漫分布,含量较多,与A组相比,差异有统计学意义(P<0.05)。C、D、E组视网膜外核层细胞浆中Fas、FasL阳性物质有不同程度减少,与模型组相比,差异有统计学意义(P<0.05)。见表1。
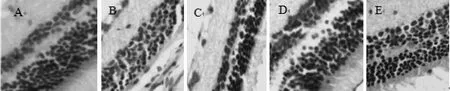
图1 各组实验性兔视网膜组织HE染色结果
表1 组间兔视网膜Fas、FasL表达的比较 (±s)

表1 组间兔视网膜Fas、FasL表达的比较 (±s)
注:与A组比较,*P<0.05;与B组比较,▲P<0.05。
组别 眼数(只) Fas积分光密度(×106)FasL积分光密度(×106)A组 6 2.64±0.27 2.39±0.12 B组 6 5.11±0.36* 6.30±0.11*C组 6 3.98±0.43*▲ 4.23±1.31*▲D组 6 3.68±0.47*▲ 3.96±0.48*▲E组 6 3.88±0.39*▲ 4.01±1.00*▲
3.4 蛴螬对兔视网膜Fas蛋白表达影响的WB结果
与A组相比,B、C、D、E组Fas、Fas L蛋白表达均明显升高,差异有统计学意义(P<0.05);与B组相比,C、D、E组Fas、Fas L蛋白表达降低,差异有统计学意义(P<0.05);与C组相比,D组、FasL蛋白表达降低,差异有统计学意义(P<0.05)。见表2。
表2 各组间兔视网膜Fas、FasL蛋白表达的比较 (±s)
注:与A组比较,*P<0.05;与B组比较,▲P<0.05。
组别 眼数(只) Fas FasL A组 6 0.27±0.13 0.21±0.10 B组 6 0.69±0.15* 0.68±0.11*C组 6 0.45±0.07*▲ 0.48±0.09*▲D组 6 0.38±0.14*▲ 0.40±0.22*▲E组 6 0.39±0.09*▲ 0.43±0.12*▲
4 讨论
眼底激光作为高能量的单色光,其对视网膜的灼伤属于眼外伤范畴,多导致视衣气阴受损,气虚血瘀。目珠脉道幽深细微,经络分布周密,气血纵横贯目,若激光灼伤目珠,气阴受损,脉络瘀滞,使神光发越受阻,视功能减退。目得阴血而能视,气脱者目不明,神光赖其真气真血真精之滋养,方能明视万物。益气则神光有所滋养,同时,气旺以促血行;活血化瘀则目珠脉道通畅,气血可以纵横贯目,神光方能有所发越。故治疗常以益气活血化瘀为主,辅以养阴利水。
蛴螬是金龟子科昆虫朝鲜黑金龟子或其他近缘昆虫的干燥幼虫,属虫类药,味咸微温,有毒,有破血、行瘀、散结、通乳之功效,早在《神农本草经》中有记载:“主恶血血瘀痹气,破折血在胁下坚满痛,月闭,目中淫肤、青翳白膜。”从蛴螬中维生素含量测定结果看,B族维生素含量较高,维生素A和维生素E的含量也较丰富。维生素B1和烟酸能促进血液循环,维生素B2能缓解眼睛疲劳、预防白内障,维生素A有增强机体免疫功能的作用,维生素E是抗氧化维生素。蛴螬滴中含有大量天门冬氨酸、丝氨酸、丙氨酸、谷氨酸、甘氨酸等氨基酸与Zn、Fe作用可以缓解组织缺氧缺血,有活血化瘀之效,可针对视网膜光损伤的脉络瘀滞进行治疗。
由于持续的光照,活性脂肪酸代谢和高氧消耗,视网膜光感受器细胞发生慢性氧化应激[4,5],导致细胞内循环和降解减少,诱导视网膜感光细胞的凋亡[6]。感光细胞的大量凋亡是视网膜光损伤后视力下降的主要原因[7,8]。
Fas/Fas L系统介导的受体途径是细胞凋亡的经典途径之一[9]。Fas主要表达于眼和睾丸[10],Fas L是Fas的天然配体,两者结合后,可以激活细胞凋亡途径中的死亡受体凋亡途径,引起细胞凋亡[11,12],如Fas/FasL信号通路可影响白血病细胞的凋亡[13],抗肿瘤效应B细胞通过Fas/FasL系统的凋亡途径可直接杀死肿瘤细胞[14]。所以Fas/Fas L系统一直都是细胞凋亡研究的热点,研究表明[15]Fas/Fas L触发的细胞凋亡导致视网膜感光细胞的死亡。
本实验发现模型组Fas、FasL表达增加,蛴螬中、高剂量治疗组Fas、Fas L表达减少,提示视网膜光损伤可能通过激活细胞凋亡通路,引起光感受器细胞凋亡从而引起视网膜损伤;蛴螬可能通过抑制细胞凋亡通路,对视网膜光损伤起到保护作用。
综上所述,蛴螬通过抑制Fas蛋白、FasL蛋白的相对表达,保护视网膜感光细胞,改善视网膜超微结构,改善了视功能。其疗效与剂量相关,中、高剂量疗效较好。
