MED64平面微电极阵列技术记录小鼠海马脑片自发放电
2019-10-19李华刘丽娜魏华许晴薛奋勤薛冰首都医科大学中心实验室北京100069
李华 刘丽娜 魏华 许晴 薛奋勤 薛冰 首都医科大学中心实验室 (北京 100069)
内容提要: 目的:验证MED64系统记录小鼠海马脑片自发放电方法可行性,以及观察平面微电极阵列技术应用于抑郁,帕金森,癫痫等研究的优势。方法:通过MED64系统对正常以及由低镁高钾加4-AP诱导的小鼠海马脑片进行记录,运用Mobius软件进行数据分析。结果:正常ACSF灌注记录到成年小鼠海马脑片神经元自发放电改用4-AP+低镁高钾ACSF灌注8min左右后小鼠海马脑片呈现癫痫样放电。换回正常ACSF洗脱30min后脑片放电恢复正常,癫痫样放电逐渐消失。结论:MED64平面微电极阵列技术可以记录小鼠海马脑片神经元自发放电,运用该技术成功建立了小鼠海马脑片癫痫模型。
微电极阵列(Multi-Electrode Array)记录系统是包括了离体电生理研究所需的一整套硬件设备耗材和分析软件。自从第一套微电极阵列系统问世后,它主要是通过如何取得更好的胞外记录信号和增加电极的密度数量上这两方面来发展的[1-3]。本校中心试验室的MED64平面微电极阵列是日本Alpha MED Sciences公司研发的多通道离体电生理记录系统。它可通过64个平面微电极对离体组织或细胞进行多通道电生理同步记录。适用于神经、视网膜和心肌细胞电生理特性和离子通道生物学特性研究。由于同时记录脑片多个神经元或可兴奋组织的放电,采集数据多,大大地扩展了研究的视野,有助于对整个神经核团或器官的神经元之间联系和功能的研究[4,5]。并且由于平面微电极阵列技术对于细胞来说是无创性的,这样既保持了对单细胞的准确记录,又能记录对药物刺激响应的较长时间的演变。这些特点使得其具有不可替代的优势。
目前本校已有多个神经生物学、生理学PI组对记录分析活体组织神经元自发性活动有迫切需求,尤其是癫痫病研究领域。这就需要建立一套平面微电极阵列记录离体神经组织自发放电的方法。
1.材料与方法
1.1 一般材料
实验动物:选取清洁级健康成年雄性C57BL/6小鼠,由首都医科大学动物部提供,实验动物许可证号:SCXK(京)2016-0011。实验动物的使用均按照首都医科大学实验动物中心和北京实验动物协会的标准执行。整个实验过程中尽可能地减少对动物的伤害及所用动物的数量。
试剂:4-氨基吡啶(4-Aminopyridine,4-AP)购自Sigma公司,其余试剂均购自国药集团化学试剂有限公司。
1.2 方法
海马脑片的制备:将小鼠断头,迅速剥离出全脑置于冰水混合态的标准人工脑脊液(Artificial Cerebrospinal Fluid,ACSF)中静置1min。ACSF的组成(mmol/L):NaCl 117,KCl 3.6NaH2PO4·2H2O 1.2,MgCl2·6H2O 1.2,CaCl2·2H2O2.5,NaHCO325,D-Glucose 11,pH 7.3~7.4。然后取出鼠脑剥离出海马组织至于修好的琼脂凹槽中,用滤纸吸出多余液体后切掉后端小部组织,而后用502胶将海马组织与琼脂凹槽固定于组织振动切片机(日本Dosaka,DTK1000)浴槽的金属底板上,切取400μm厚的海马脑片(以冠状面切片)。将切好的脑片移至ACSF的孵育槽中,ACSF预先通以95%O2和5%CO2混合气至氧饱和。室温下孵育1h后记录。记录时持续灌流氧饱和的ACSF,流速控制在3~4mL/min。
1.3 MED64平面微电极阵列的预准备
本实验电生理记录所采用的MED64 Probe(MED64平面微电极阵列探针,日本Alpha Med Sciences)是在透明石英玻璃(50mm×50mm×1.1mm,Pyrex7059)中心内嵌一个装配有64个(8×8等距阵列)平面微电极的电路板构成(图1a)[6]。MED64 Probe中心每个平面微电极的面积是50μm×50μm,间距为150μm(P515A型号)(图1b)。实验中根据组织标本大小,面积的不同可以选择其适合的电极规格型号。电极使用前需要用含0.1%的聚氮丙啶(Polyethylenimine,PEI)硫化物的硼酸盐缓冲液包埋处理(12h以上),目的是加强电极表面对脑片组织的黏着亲和性。

图1. MED64平面微电极阵列探针(a.MED64Probe;b.8×8 等距微电极阵列;c.海马脑片在电极阵列上的位置)
1.4 记录海马脑片自发放电
用宽口吸管将孵育好的海马脑片移入MED64 Probe。在倒置显微镜下先用尼龙盖网盖住脑片,然后用镊子夹住尼龙网将脑片拖至电极阵列记录位置后盖上金属压片(SHD-22L,美国Harvard)将其固定。用蠕动泵(BT100-2J,LongPump)持续灌流通入95%O2和5%CO2混合气的ACSF(灌流速度3~4mL/min,室温)。灌流过程中用CCD显微照相机(DP70,日本Olympus)采集海马脑片-MED64电极位置图像(图1c)并且排除系统噪声干扰,将噪声控制在±10μV以下。灌流20min后使用Mobius软件对海马脑片神经元的自发电活动信号进行同步采样,采样率为20kHz[7]。得到正常自发放电数据后改用4-AP+低镁高钾ACSF灌流,以形成癫痫样放电的海马脑片(癫痫样放电达到10次/min以上)。记录10min后换回正常ACSF洗脱直至癫痫样放电消失。
2.结果
2.1 正常小鼠海马脑片自发放电
正常ACSF灌流时,MED64 Probe64个通道中仅有个别通道可以观察到海马脑片少量神经元自发放电(图2a-1)。通过Mobius软件对放电信号通道分析可以提取出不同放电特征的多个神经元(图2a-2)。
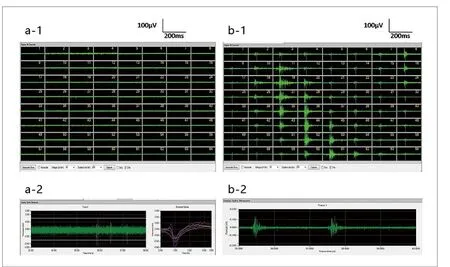
图2. 小鼠海马脑片放电(a-1.MED64记录正常小鼠海马脑片自发放电;a-2.第29通道海马脑片神经元自发放电;b-1. MED64记录4AP+无镁高钾ACSF诱导的海马脑片自发性癫痫样放电;b-2.第27通道海马脑片神经元癫痫样放电)
2.2 小鼠海马脑片癫痫样放电
灌流4-AP+低镁高钾ACSF大约8min左右((500±50)s,n=6)海马脑片神经元开始出现簇状密集的癫痫样放电(图2b-1)。在出现相对大的癫痫样放电事件之前会先观察到一些通道的神经元由静默转为兴奋,先出现一定数量的自发放电,然后出现相对幅度较小间期较长的癫痫样放电。癫痫样放电的区域包括海马(Cornu Ammonis,CA)部分区域和齿状回(Dentate Gyrus,DG)部分区域,神经元放电幅值在20~120μV(图2b-2)。记录10min后换回正常ACSF洗脱,癫痫样放电随之逐渐减弱30min后完全消失。
3.讨论
现在神经科学研究的主要目标就是研究功能性的神经回路在生理和病理情况下的区别,而单个神经元是构成神经回路的基础。神经元的自发电活动是大脑神经回路编码机制和信息处理机制研究的基础,产生这些自发电活动的生理信号是分布在大脑空间的,并且往往按照某些规则分布在大脑的。神经系统疾病的发生发展往往表现为自发电活动等生理信号的异常,在神经系统疾病发生的时候往往不是一个神经元的自发电活动发生了变化,而是很多甚至整个核团的自发电活动和规律发生了变化,比如说抑郁、癫痫、帕金森、阿尔茨海默等疾病。所以同时对自发电活动的空间分布的多通道记录是很重要的。
目前对于神经元电活动的研究方法主要有细胞内和细胞外玻璃电极记录,微电极阵列技术,光遗传学等。细胞内和细胞外玻璃电极记录是目前最常用的,但只能记录单细胞的放电,不适于研究多个神经元的电活动,而且它对于细胞来是有创的,只能用于短时间记录[8]。光遗传学主要应用对电压或钙敏感的染料来观察细胞的活动,只能看很浅层的神经元(由于入射光只能穿透很浅的一层组织),还有性噪比的问题,这些都限制了它的应用[9]。另外还有比如功能性核磁共振、脑电图、脑皮层电图,但这些方法空间分辨率不够,看不到单个神经元电活动的变化。要揭示神经系统处理信息的复杂机制,必须获得足够数目的神经细胞的电活动信息。近些年随着电子技术和微机械加工技术的快速发展,微电极阵列技术也随之得到了巨大提升。目前该技术可以同时检测几十甚至上百个通道的电信号,实现了对神经网络的高空间分辨率检测[10]。因此,MED64平面微电极阵列系统对研究神经组织网络特性有着很大的技术优势。
微电极阵列技术近年来多用于培养神经元及神经组织的电生理记录[11]。急性脑片的记录也多为记录兴奋性突触后场电位(Field Excitatory Postsynaptic Potential,fEPSP)[4]。急性脑片自发放电记录少有报道。本实验使用平面微电极阵列技术记录到成年小鼠海马脑片神经元自发放电并且成功建立4-AP+低镁高钾ACSF诱导的急性小鼠海马脑片癫痫模型。通过实验完善优化了MED64系统记录离体脑片自发放电的方法,拓展了该设备功能。为记录分析活体组织神经元自发性放电活动的研究提供相应的技术保障。为学校研究癫痫、帕金森、抑郁、阿尔茨海默病等重大脑疾病提供科学研究平台。
