新版《医疗器械分类目录》使用时应注意的问题和建议
2019-10-19母瑞红余新华中国食品药品检定研究院国家药品监督管理局医疗器械标准管理中心北京102629
母瑞红 余新华 中国食品药品检定研究院(国家药品监督管理局医疗器械标准管理中心) (北京 102629)
内容提要: 通过对新医疗器械分类目录简要介绍和典型案例分析,提出使用新分类目录进行医疗器械产品管理类别判定时应注意的问题及建议,以期为医疗器械分类目录使用者提供参考。
医疗器械是与人健康有直接关系的特殊商品,由于其定义广泛,涉及光、电、磁、材料、医学等多学科领域及交叉科学,种类繁多复杂,有如核磁、X射线、放疗、电子体温计等诊断治疗类的有源器械;心血管支架、医用敷料、一次性输液器、压舌板等无源类医疗器械和荧光免疫分析仪、生化分析仪等临床检验器械。在我国,医疗器械的监督管理是根据医疗器械的风险程度采取相应的管控措施,施行分级分类管理制度[1-4]。因此,医疗器械科学合理的分类是监管资源配置和科学监管的重要基础,在我国,医疗器械监督管理分类采用医疗器械分类规则指导下的分类目录制[5]。
为落实国务院深化审评审批制度改革,满足新形势下监管科学的需要,原国家食品药品监督管理总局于2017年8月31日发布新《医疗器械分类目录》(以下简称“新分类目录”)[6],新分类目录在结构框架、内容设置等方面进行了调整和丰富,以期为医疗器械的科学监管提供更有力的技术支撑。本文对新分类目录进行简述,并结合工作实践提出使用其进行分类界定时应注意的问题和建议,供使用者参考。
1.新分类目录简述
新分类目录由子目录说明、子目录和编制说明三部分组成,子目录说明包括范围、框架结构、其他说明三项内容。新分类目录共有22个子目录,包括了一级产品类别206个,二级产品类别1157个,品名举例6609个。22个子目录编码和名称分别为01有源手术器械,02无源手术器械,03神经和心血管手术器械,04骨科手术器械,05放射治疗器械,06医用成像器械,07医用诊察和监护器械,08呼吸、麻醉和急救器械,09物理治疗器械,10输血、透析和体外循环器械,11医疗器械消毒灭菌器械,12有源植入器械,13无源植入器械,14注输、护理和防护器械,15患者承载器械,16眼科器械,17口腔科器械,18妇产科、生殖和避孕器械,19医用康复器械,20中医器械,21医用软件,22临床检验器械。其中数字序号为子目录编码。
每个子目录由序号(即一级产品类别编码)、一级产品类别、二级产品类别、产品描述、预期用途、品名举例、管理类别组成。
2.使用新分类目录时应注意的问题及建议
为了使用者更好地理解新分类目录,使之成为工作手册,借鉴工作经验,以典型案例解析对新分类目录中关键内容进行解读。
2.1 范围
2.1.1 新分类目录的适用范围
新分类目录不包括按医疗器械管理EBER检测试剂盒、乙型肝炎表面抗原(HBsAg)抗体试剂、CD27抗体试剂等的体外体诊断试剂产品和牙种植体取出专用工具包、眼科手术镊器械包、脊柱手术工具包等组合包类医疗器械产品。
2.1.2 子目录范围
每个子目录说明中都给定其所归属的医疗器械种类,故在使用新分类目录时首先要确认产品是否在规定的范围内以避免误判。如子目录16眼科器械主要涵盖眼科器械类医疗器械,包括眼科诊察、手术、治疗、防护所使用的各类眼科器械及相关辅助器械;不包括眼科康复训练类器械(19医用康复器械)。即眼科康复训练类器械属于医用康复子目录而不是眼科器械子目录。
2.2 产品描述和预期用途
新分类目录中的产品描述和预期用途是用于判定产品的管理类别,不代表相关产品注册内容的完整表述。
2.3 分类编码确定原则
为产品上市后科学监管提供支持,在相关医疗器械监管法规中明确要求医疗器械注册证须明确子目录分类编码、生产许可证需要分类编码标示至一级产品类别等。因监管的需要,确定医疗器械产品分类编码时应根据产品描述和预期用途以及子目录的范围,遵循医疗器械产品归属子目录的优先原则。
第一,临床专科优先原则:如妇科红外治疗仪为妇科专用的物理治疗设备,该产品的子目录编码应为18而非09。
第二,多功能产品依次按照主要功能、高风险功能、新功能优先顺序;如动静脉采血针是具有穿刺功能并主要用于动静脉血取样,子目录编码为22,而不是14。
第三,医疗器械管理的附件类产品,优先归属整机所在子目录或者产品类别。如放射治疗用的体部热塑板子目录编码为05。
2.4 使用新分类目录进行管理类别确认
2.4.1 管理类别确认采用综合判定原则
在确认医疗器械产品管理类别时应当根据产品的实际情况,结合新《分类目录》中产品描述、预期用途和品名举例进行综合判定,不能仅从部分内容来判定。如表1典型产品举例表中列举的产品。确定超声耦合剂类产品管理类别的关键是预期用途的超声探头与患者的接触途径,而不是产品描述和品名举例。然而施夹器类产品判定管理类别的关键因素则为产品描述中的在体内滞留时间、是否含有血管闭合夹,产品是否无菌提供等内容。
2.4.2 品名举例
实际拟注册/备案产品名称可使用新《分类目录》的品名举例,或根据《医疗器械通用名称命名规则》[7]拟定产品名称。
如由陶瓷材料制成的手术刀,其产品名称可选用品名举例中的产品名称手术刀,也可拟定为符合《医疗器械通用名称命名规则》要求的陶瓷手术刀。
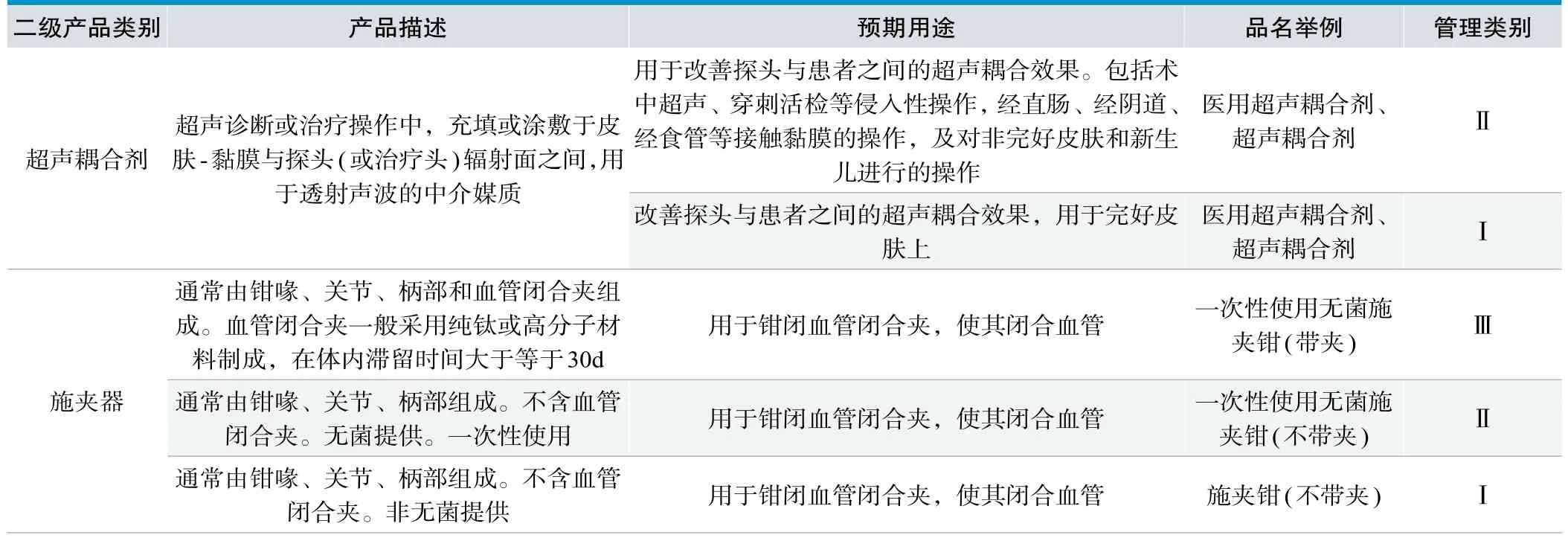
表1. 典型产品举例
