小反刍兽疫病毒间接化学发光抗体检测方法的建立与优化
2019-10-17任雪建李秀梅杨晓帆李亚静杨志耿玉静吕园园
任雪建 李秀梅 杨晓帆 李亚静 杨志 耿玉静 吕园园


摘要:构建了原核表达质粒pET-28a-N,经原核表达纯化获得小反刍兽疫病毒N蛋白。将纯化的小反刍兽疫病毒N蛋白与对应的酶标二抗配对,通过对各个反应条件的优化建立了间接化学发光抗体检测方法。通过对血清样本的检测,对该方法的敏感性、特异性、重复性、符合率进行了评价。试验结果显示:N蛋白最适包被浓度为0.5 μg/mL,最适包被条件为4℃ 24 h;酶标二抗最适工作浓度为1∶2000。特异性试验证明,该方法与羊常见病毒的抗体阳性血清没有交叉反应。通过检测大量小反刍兽疫病毒抗体阴、阳型血清,确定了科学的判定标准。
关键词:原核表达;最适条件;临界值
中图分类号:S854.4+3文献标识码:A文章编号:2095-9737(2019)10-0001-05
小反刍兽疫(Peste des Petits Ruminants,PPR)是由小反刍兽疫病毒(Peste des Petits Ruminants Virus,PPRV)引起的一种反刍动物的烈性病毒性疾病。小反刍兽疫病毒具有高度传染性,绵羊和山羊为主要感染动物,偶尔感染野生小反刍动物,例如岩羊、野山羊等[1]。世界动物卫生组织(OIE)将其列为必须报告的动物疫病,我国将其列为一类动物疫病。在《2018年国家动物疫病强制免疫计划》规定对全国所有羊进行小反刍兽疫免疫。本试验利用原核表达的小反刍兽疫N蛋白作为包被抗原与其酶标二抗配对,构建了间接化学发光抗体检测方法。
1 材料与方法
1.1 材料
1.1.1 主要试剂
pET-28a原核表达载体、BL21感受态细胞由本公司实验室保存;法国ID-VET《小反刍兽疫抗体检测试剂盒》购于上海拜力生物科技有限公司;小反刍兽疫活疫苗(Clone9株)购于新疆天康畜牧生物技术股份有限公司。
1.1.2 血清样本
小反刍兽疫阳性血清、小反刍兽疫阴性血清购于中国兽医微生物菌种保藏管理中心。500份已知来源的临床羊血清由洛阳莱普生信息科技有限公司提供,并经法国ID-VET小反刍兽疫病毒阻断ELISA抗体检测试剂盒检验证明。
1.2 方法
1.2.1 小反刍兽疫N蛋白的表达
小反刍兽疫病毒是单股负链RNA病毒,编码8种已知蛋白,其中6种为结构蛋白,分别为核衣壳蛋白(N)、磷蛋白(P)、基质蛋白(M)、大蛋白(L)、血凝素蛋白(H)和融合蛋白(F)。大多数血清学检测技术是针对小反刍兽疫病毒的核衣壳蛋白和血凝素蛋白而建立的[2]。大多数的单链RNA病毒,包括小反刍兽疫病毒在内,N蛋白高度保守,免疫原性也较高。由于接近病毒基因组的3'末端,N蛋白的含量比其他结构蛋白都要高。虽然针对N蛋白的抗体不能保护动物免受该病侵害,但由于抗原性较好而且含量丰富,N蛋白仍然是小反刍兽疫诊断工具最易接受的目标[3]。
从gene bank上查找小反刍兽疫N蛋白的基因序列号为AJ563705.1,并设计引物。上游引物序列为:5'-AATAGGATCCGCG CACGTGAACGACATGCTGA -3',下游引物序列为:5'-CGGAAGCTTAATGTCGTAGAACTTGAGCGTGTG-3'。使用RNA提取试剂盒从小反刍兽疫疫苗中提取病毒核酸。并通过反转录PCR获得cDNA,使用上述一对引物扩增出小反刍兽疫N蛋白主要抗原表位区基因。将扩增出来的目的基因、pET-28a空载体分别经双酶切之后与pET-28a载体连接。将重组质粒转化BL21大肠杆菌感受态细胞。经过条件筛选,确定合适的IPTG诱导浓度,培养温度。经表达纯化获得的小反刍兽疫N蛋白可作为试剂盒生产中的包被抗原使用。
1.2.2 包被缓冲液的选择
分别选取25mM PBS(pH值7.4)、碳酸盐缓冲液(pH值9.6)、50mM Tris-HCl(pH值8.0)作为包被缓冲液,包被浓度均为1 μg/mL。每孔100 μL,2~8℃放置24 h。用PBST洗板2次,每孔加入1.5% BSA,2~8℃封闭24 h。阳性对照血清1/20稀释之后加入到化学发光反应板中,每孔加入100 μL,最后一行作为无血清对照。37℃反应1 h,PBST洗涤5次,吸水纸上拍干之后,每孔加入100 μL工作浓度的羊抗猪酶标二抗。37℃反应1 h,PBST洗涤5次,吸水纸上拍干之后,每孔加入化学发光底物A液50 μL、化学发光底物B液50 μL。室温、避光反应5 min,使用化学发光免疫分析仪读数。
1.2.3 包被条件的摸索
分别选取37℃ 3 h、4℃ 16 h、4℃ 24 h、三种包被条件进行摸索。以1 μg/mL的蛋白浓度进行包被,每孔加入100 μL。使用1.5% BSA封闭,阳性对照血清1/20稀释之后加入化学发光反应板进行反应。选择化学发光值高,并且變异系数最小的条件进行包被。
1.2.4 封闭缓冲液的选择
分别选取 1.5% BSA、1%酪蛋白、10%马血清、3%明胶作为封闭液。封闭条件为2~8℃24 h。在化学发光反应板上测定阳性对照血清、阴性对照血清,计算二者化学发光值的比值(P/N),根据比值大小确定最适封闭液。
1.2.5 血清稀释倍数和抗原包被浓度的确定
使用棋盘滴定法来筛选最佳条件。使用包被缓冲液在化学发光包被板上按照浓度梯度进行包被。选取阳性对照血清、阴性对照血清进行梯度稀释,进行测定。实验布局如表1所示。根据最终读取的化学发光值计算阳性对照血清、阴性对照血清二者的比值(P/N),比值最大时为最适抗原包被浓度与血清稀释倍数。
1.2.6 酶标二抗最适浓度的筛选
使用不同浓度的酶标二抗,对同一份强阳性血清进行测定。由于高浓度的酶标二抗处于过量状态,多余的二抗并不会结合到抗原-抗体复合物上。在酶标二抗过量的浓度区间内化学发光值下降缓慢,随着酶标二抗浓度的逐渐下降,化学发光值会呈现明显下降趨势。化学发光值明显下降的拐点处所对应的酶标二抗浓度即是最适工作浓度。
1.2.7 临界值的确定
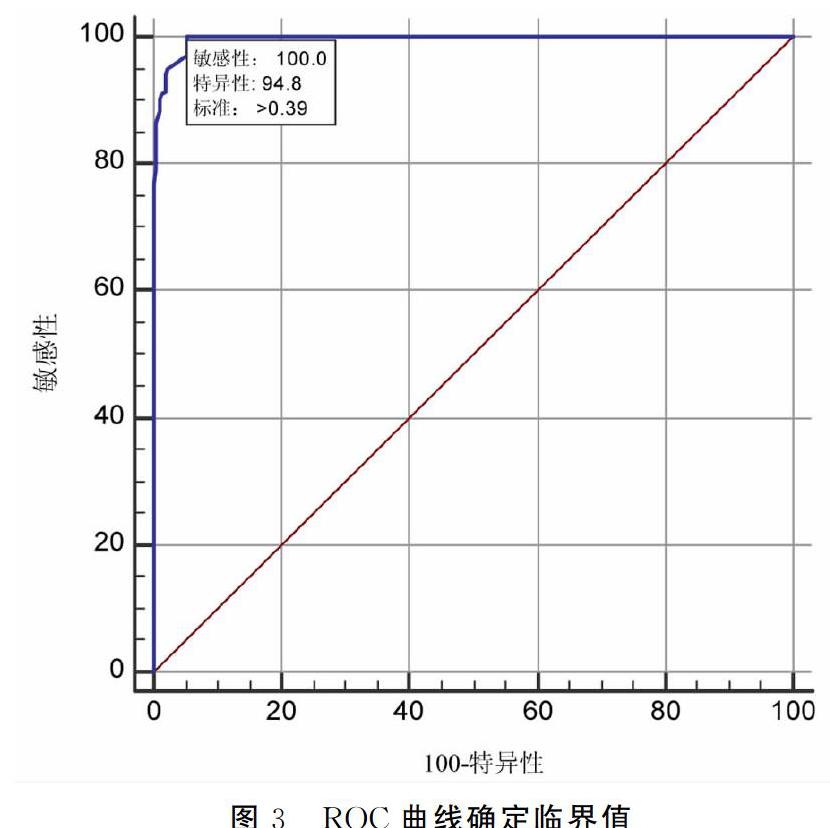
收集临床血清样本400份使用青岛立见小反刍兽疫病毒阻断ELISA抗体检测试剂盒进行测定,其中阳性219份,阴性181份。使用建立好的实验体系,测定400份临床血清样本,实验结果按照S/P=样本OD值/阳性对照OD进行计算。使用SPSS软件对所有血清的S/P值与已知结果进行统计分析,并绘制ROC曲线,取Youden指数最大时对应的S/P值作为临界值。
1.2.8 交叉实验
使用建立的实验体系,测定羊口蹄疫O型病毒阳性血清、山羊痘病毒阳性血清、绵羊痘病毒阳性血清,同时设小反刍兽疫病毒阳性血清作为对照。根据实验结果观察化学发光方法的交叉反应性。
2 结果与分析
2.1 重组蛋白表达及验证
2.1.1 pET-28a-N重组质粒的构建及验证
将扩增的PCR产物进行琼脂糖凝胶电泳,如图1所示,在紫外灯下进行观察,目的条带位置与已知的1578bp符合。
使用胶回收试剂盒将目的片段回收。将目的片段与pET-28a空载体进行双酶切,酶切之后将产物回收进行连接。连接产物转化BL21感受态细胞,固体培养基筛选得到单菌落,挑取单菌落使用液体培养基继续培养,提取之后进行双酶切,酶切产物进行琼脂糖凝胶电泳验证,在1578bp附近有目的条带出现。同时将构建好的质粒进行测序,比对结果显示没有碱基错配。
2.1.2 pET-28a-N重组蛋白的表达及纯化
将重组质粒pET-28a-N转化BL21感受态细胞,进行培养诱导表达,分别取诱导前菌液,诱导后菌液超声波破碎的菌体沉淀和上清进行SDS-PAGE电泳分析,结果如图2所示。诱导后产物中有重组蛋白表达,分子量约为60kDa。大量诱导表达产物经Ni-NTA树脂亲和层析纯化后进行SDS-PAGE电泳分析,得到分子量在80kDa左右的高纯度蛋白,如图2所示。
2.1.3 重组蛋白反应性验证
纯化之后目的蛋白进行SDS-PAGE电泳,转膜结束之后使用小反刍兽疫标准阳性血清进行孵育,然后加入鼠抗羊酶标二抗进行显色。结果显示:目的蛋白能够与阳性血清结合,在80kDa位置出现条带,而空白对照泳道在该位置无条带产生。结果如图3所示。
M:蛋白Maker;1:空载体诱导表达产物;2:诱导表达产物;3:诱导表达产物上清;4:纯化之后目的蛋白
M:蛋白Maker;1:目的蛋白与阳性血清反应结果;2:空白对照
2.2 包被缓冲液的选择
分别使用三种包被缓冲液进行包被,实验结果如表2所示。其中CB包被时抗原吸附效率最高,并且P/N值最大,所以确定使用CB作为抗原包被缓冲液。
2.3 包被条件的确定
分别按照37℃ 3 h、4℃ 16 h、4℃ 24 h、三种包被条件进行。选取一份弱阳性样本S1进行实验,根据发光值计算变异系数,变异系数最小的条件为最适条件。对实验结果进行统计。发光值结果如表3所示,3种包被条件下发光值高度无明显差异,但是4℃ 24 h条件下发光值变异系数最小,更有利于实验结果的准确性。
2.4 封闭缓冲液的选择
使用三种封闭缓冲液在2~8℃条件下封闭24 h。使用阳性对照血清、阴性对照血清进行测定,比较P/N值。结果显示,10%马血清作为封闭液时,阴性血清的本底值最低,且阳性样本与阴性样本的区分程度最大。
2.5 抗原包被浓度及血清稀释倍数的选择
使用棋盘滴定法确定最佳的抗原包被浓度和血清稀释度,实验布局如表1所示。将已经确定为阴性和阳性的血清梯度稀释,分别加100 μL稀释后的血清样本到包被板,震荡混匀,37°C孵育30 min;洗板5次,拍干。加入100 μL 酶结合物,震荡混匀,37°C孵育30 min;洗板5次,拍干。加入50 μL发光底物液A和50 μL发光底物液B,震荡混匀,室温避光5 min,使用化学发光仪读值,记录结果。结果显示,其中血清1∶40稀释时阳性血清信号值高度处于100000~150000之间,阴性血清发光值大于10000能够保证整个实验体系的样本值均处于化学发光仪精密性范围之内,在血清1∶40的条件里,抗原0.5 μg/mL包被时抗原用量最少,阴阳区分明显。所以,选择抗原0.5 μg/mL包被,血清1∶40稀释作为最适条件。结果见表5。
2.6 酶标二抗最适工作浓度筛选
用优化后的抗原包被浓度和血清稀释度,将酶标二抗做梯度稀释。加100 μL血清样本到包被板,震荡混匀,37°C孵育30 min;洗板5次,拍干。加入100 μL 酶结合物,震荡混匀,37°C孵育30 min;洗板5次,拍干。加入50 μL发光底物液液A和50 μL发光底物液B,震荡混匀,室温避光5 min,使用化学发光仪读值,记录结果,结果见表6。其中酶标二抗浓度为1∶2000时,阳性血清发光值在150000左右,阴性血清发光值大于10000,整个实验体系信号值高度处于化学发光仪精密性良好区间,且酶标二抗1∶2000时,阴阳样本区分较大。
2.7 临界值确定
用法国ID-VET抗体检测试剂盒标定血清500份,阳性样本289份,阴性样本211份。使用建立的化学发光抗体检测方法进行测定。用ROC曲线来确定临界值,敏感性代表阳性检出率,特异性代表因阴性检出率;当相关标准>0.39时,Youden指数最大为0.9479,所以确定S/P=0.4为临界值,当S/P≥0.4时,判定为阳性;S/P<0.4时,判定为阴性。ROC曲线如图3所示,阳性符合率为100%,阴性符合率为94.8%。
2.8 交叉反应
使用已确定条件进行实验,测定羊口蹄疫O型病毒陽性血清、山羊痘病毒阳性血清、绵羊痘病毒阳性血清,同时设小反刍兽疫病毒阳性血清作为对照。检测结果如表7所示,说明本方法与上述羊常见病抗体无交叉反应。
3 讨论
小反刍兽疫作为一种危害十分严重的接触性传染病,对经济影响非常大,许多国家通过弱毒疫苗免疫来控制该病。自然感染后康复的动物和免疫后的动物均可以产生终生免疫,即动物感染小反刍兽疫病毒以后能终身产生抗体,持续产生抗体反应,对再次感染可以产生完全保护,因此,抗体是一个很好的指标。大规模监测小反刍兽疫主要由血清学方法完成[4]。
小反刍兽疫病毒间接法化学发光抗体检测试剂盒使用的包被抗原为原核表达的N蛋白,具有高浓度、高活性、高纯度等优势,能够满足大批量生产。通过实验证明表达的N蛋白具有敏感性高、特异性好等特点。同时,针对底物系统进行了优化,用发光底物代替了传统的TMB底物,进一步提高了检测的敏感性、特异性、稳定性,并且加入发光底物室温反应5 min之后就可直接读值。实验操作更加简便,明显缩短了检测时间。本试剂盒在开发过程中使用的血清样本均经过进法国ID-VET试剂盒标定,最终的成品试剂盒阴、阳性符合率均大于95%。
参考文献:
[1] Lefevre P C,Diallo A.Peste des prtits ruminants[J].Rev Sci Tech,1990,9(4):935-981.
[2]Munir M,Zohari S,Berg M.Molecular biology and pathogenesis of peste des petits ruminants virus[M].Springer Berlin Heidelberg,2013.
[3]Diallo A,Barrett T,Barbron M,et al.Cloning of the nucleocapsid protein gene of peste-des-petits-ruminants virus:relationship to other morbilliviruses[J].J Gen Virol,1994,75(Pt 1):233-237.
[4]张喜悦,王志亮,刘春菊,等.小反刍兽疫病毒(PPRV)N蛋白的表达与ELISA检测方法的建立[J].中国兽医学报,2008(02):146-148,156.
