草莓果实中FaPP2CX1基因克隆与表达分析
2019-10-17陈新红沈元月
陈新红,沈元月
(北京农学院植物科学技术学院/农业应用新技术北京市重点实验室,北京 102206)
草莓属于蔷薇科(Rosaceae)草莓属(Fragaria),其果实酸甜可口,富含维生素、蛋白质、人体必需的矿物质和微量元素,深受广大消费者的喜爱,被誉为“水果皇后”[1-3]。草莓被认为是研究非呼吸跃变型果实成熟的模式材料[4-5],并建立ABA核心信号转导“ABA-PYR/PYL/RCAR-PP2C-SnRK2”调控草莓果实成熟的分子机制:ABA缺乏时,PYR/PYL/RCAR受体蛋白以二聚体形式存在,不能与PP2Cs相互作用,PP2C蛋白磷酸酶结合下游的SnRK2蛋白激酶,使SnRK2去磷酸化从而失活;ABA增多时,ABA与PYR/PYL/RCAR受体蛋白结合,改变受体的构型,进而与PP2Cs相互作用,使SnRK2s得到释放,恢复自我磷酸化与蛋白磷酸化活性,释放的SnRK2s激活下游转录因子、ABA响应元件结合蛋白(AREBs)和ABA响应元件结合因子(ABFs)等靶目标[6-8]。PP2C是ABA信号转导的核心组分,水稻和拟南芥的PP2C家族成员分别有78、80个[9]。拟南芥中ABI1、ABI2、AHG1、AHG3/AtPP2C-A、HAB1及HAB2等PP2C类蛋白属于A亚族,对ABA信号起负调控作用[10],这一点在其他作物得到验证[11-14]。
在栽培草莓转录组数据[15]中检测到12个PP2C家族基因,其中发现一个草莓属中独有的转录本,并与二倍体草莓转录变体X1(https://blast.ncbi.nlm.nih.gov/Blast.cgi)的同源性最高,并且含有PP2C保守结构域,故将此基因命名为PP2CX1。本研究通过基因克隆、生物信息学及基因在草莓果实不同发育时期的表达量进行分析,初步探究FaPP2CX1在草莓果实成熟调控中的作用。
1 材料与方法
1.1 植物材料
本试验使用北京农学院东大地温室栽培的八倍体草莓品种‘甜查理’。温度17~26 ℃、相对湿度70%~90%、光照14 h、黑暗10 h。选取30个草莓单株的90朵花,并对其进行花期标记。在果实发育的五个时期进行取样:大绿期(花后16 d)、白果期(花后22 d)、始红期(花后24 d)、片红期(花后26 d)和全红期(花后28 d),每个时期选取10个大小一致的果实样本,去瘦果(种子),切成0.5~0.8 cm3的立方体,液氮速冻,置于-80 ℃冰箱待用。
1.2 试验方法
1.2.1 RNA提取和cDNA合成 每个阶段的3个果实用于RNA提取和cDNA合成。使用OMEGA RNA提取试剂盒,从0.5 g草莓花托中提取总RNA。通过琼脂糖凝胶电泳、A260∶A230和A260∶A280比率分析RNA的纯度和完整性。使用全式金反转录试剂盒逆转录300 ng总RNA以合成cDNA。
1.2.2FaPP2CX1基因的克隆与测序 根据二倍体草莓转录变体X1(NCBI Reference Sequence:XM-011465736.1)的编码序列,设计扩增引物,上游引物:5′-ATGCTATCACCGGTCGTCGA-3′;下游引物:5′-TTAGTTTCTTTGAGCTCTCAT-3′。反应体系50 μL,其中ddH2O 31.5 μL,5×Q5 buffer 10 μL,10 mmol/L dNTPs 1 μL,上游引物 2.5 μL,下游引物 2.5 μL,cDNA模板 2 μL,Q5 High-Fidelity DNA Polymerases 0.5 μL。PCR扩增条件:98 ℃预变性30 s;98 ℃变性10 s ;65 ℃退火30 s;72 ℃延伸120 s;共33个循环;72 ℃延伸2 min;4 ℃保存。将得到的PCR产物在1.2%的琼脂糖凝胶上电泳,然后将目的条带进行胶回收纯化。将回收的目的条带与克隆载体pEASY-Blunt Simple连接,转化大肠杆菌感受态(E.coliDH5α),挑取单菌落进行PCR,条带正确的单菌落送生工生物(上海)有限公司测序,并将测序结果与二倍体草莓序列(NCBI Reference Sequence:XM-011465736.1)进行比对。
1.2.3FaPP2CX1基因生物信息学分析 利用NCBI CD-Search分析FaPP2CX1的功能保守结构域;利用ExPASy网站预测蛋白的分子量、等电点、稳定指数以及亲疏水性等信息;利用NCBI BLAST(Protein)功能,筛选出同源性较高的物种,构建进化树(MEGA 5.10),分析亲缘关系。
1.2.4FaPP2CX1表达量分析 利用Primer 5软件设计荧光引物,上游引物序列:5′-TCTACCGTCACTCAGCAACC-3′,下游引物序列:5′-AAACCCTTCGGGAACATC-3′。以草莓Actin为内参基因,上游引物序列:5′-TGCATATATCAAGCAACTTTACACTGA-3′,下游引物序列:5′-ATAGCTGAGATGGATCTTCCTGT-3′。以草莓果实总RNA反转的cDNA为模板,使用Trans Start Top Green qPCR Super Mix 试剂盒在Light Cycler 96实时PCR系统上进行qPCR。10 μL的反应含有2TransStrat top Green qPCR SuperMix,0.25 μL正向特异性引物(10 μmol/L),0.25 μL反向特异性引物(10 μmol/L),2 μL cDNA模板和2.5 μL双蒸水。通过LC96软件分析基因相对表达量,试验重复3次。利用SPSS 12.0软件进行统计分析(P<0.05)。
2 结果与分析
2.1 基因克隆与测序
以八倍体草莓‘甜查理’总RNA逆转录的cDNA为模板,克隆出FaPP2CX1基因,全长为3 765 bp,编码1 254个氨基酸,与二倍体草莓转录变体X1(NCBI Reference Sequence:XM-011465736.1)相差13个碱基(图1,方块标记部分),6个氨基酸,突变无终止密码子。

图1 二倍体与八倍体草莓PP2CX1基因序列对比Fig.1 Comparison of PP2CX1 gene sequence between diploid and octoploid strawberry
2.2 FaPP2CX1生物信息学分析
利用NCBI CD-Search分析出FaPP2CX1的功能保守结构域有四个(图2),分别是真核丝氨酸苏氨酸激酶的N-末端(STK_N)结构域、富亮氨酸重复蛋白(LRR)结构域、核苷酸结合(NB-ARC)结构域和蛋白磷酸酶(PP2C)结构域;经NCBI数据库蛋白序列比对,选择与FaPP2CX1同源性较高的物种,通过MEGA 5.10软件构建系统进化树,结果表明草莓属植物与其他属植物相分离。其中八倍体FragariaananassaFaPP2CX1与二倍体Fragariavesca(GenBank,XP_011464038.1)属于同一分支,同源性为100%(图3);而在另两个分支中,FaPP2CX1与Prunusavium(GenBank,XP_021817227.1)、Rosachinensis(GenBank,XP_024193972.1)蛋白序列的同源性分别为72.88%、81.17%,但是Prunusavium(GenBank,XP_021817227.1)中没有STK结构域、LRR结构域和NB-ARC结构域;Rosachinensis(GenBank,XP_024193972.1)中没有STK结构域和PP2C结构域,这些结果表明FaPP2CX1是草莓属中独有的基因;ExPASy网站预测到该蛋白有1 254个氨基酸,分子量为140.17 kD、等电点是6.46、不稳定指数(II)

图2 FaPP2CX1的保守结构域Fig.2 Conserved domain of FaPP2CX1
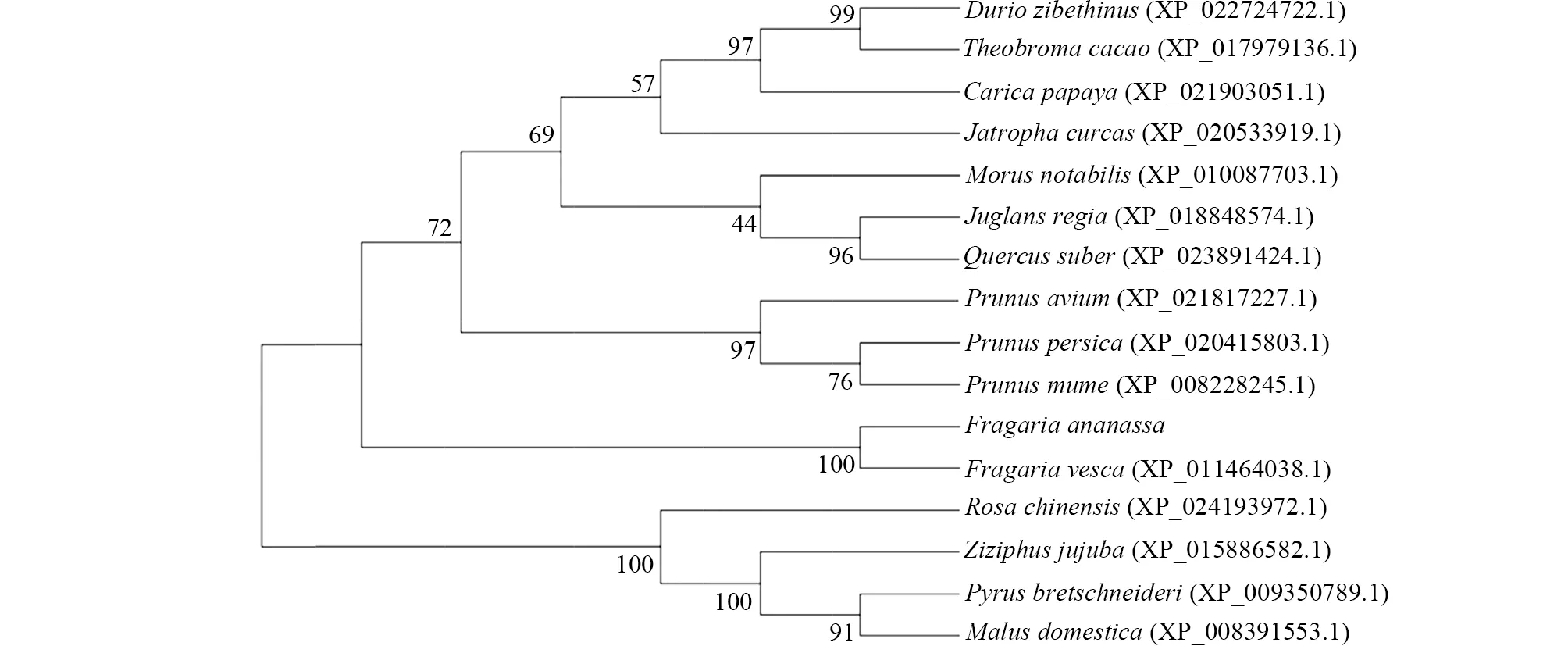
图3 FaPP2CX1的系统进化树分析Fig.3 System phylogenetic tree analysis of FaPP2CX1
计算为47.24,将蛋白分类为不稳定蛋白,亲水性的平均值(GRAVY)为-0.217,表明此蛋白为亲水蛋白。
2.3 FaPP2CX1表达量分析
以大绿期、白果期、始红期、片红期和全红期五个时期的cDNA为模板,进行荧光定量分析。从大绿期开始,FaPP2CX1的表达量逐渐降低,始红期到达最低值;而后随着草莓果实着色加深,表达量迅速上升,并在果实成熟(即全红期)达到最高,暗示着FaPP2CX1可能参与草莓果实的成熟调控(图4)。
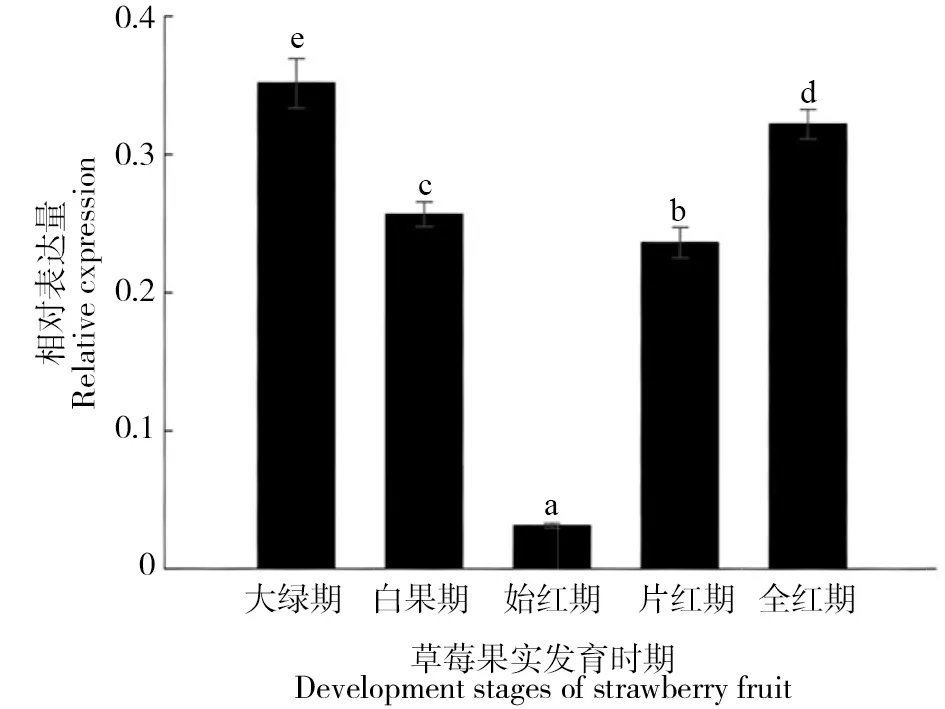
图4 不同时期FaPP2CX1的表达量Fig.4 Expression of FaPP2CX1 in different periods
3 讨 论
关于ABA信号转导的主要研究成果是ABA-PYR/PYL/RCAR-PP2C-SnRK2途径,PP2C作为核心组分在ABA信号转导中起负调控作用。在拟南芥中,PP2C蛋白磷酸酶A亚族负调控ABA信号;在草莓中,2C型蛋白磷酸酶FaABI1基因表达量随着果实的成熟而下降,作为负调控因子参与草莓果实成熟的调控[7],这与本研究中FaPP2CX1基因前期的表达量下降(大绿期、白果期、始红期)是一致的,推测果实成熟前期该基因的PP2C蛋白磷酸酶结构域主导负调控草莓果实的发育。氨基酸序列同源比对发现FaPP2CX1与抗病基因有较高的相似度,且LRR是生物体中抗病基因具有的结构域[16],推测与该基因抗病有关。另外,LRR结构域可与ABA结合并正调控草莓的成熟[17],这与草莓果实成熟后期(始红期、片红期和全红期)表达量迅速上升相符合,说明草莓果实成熟后期LRR结构域可能起主导作用。有研究发现BRI1的胞外LRR结构能感知BR[18],BR结合BRI1后,BRI1的激酶区构象改变,C端延伸区(6个丝氨酸和2个苏氨酸)被反向磷酸化,BRI1自我抑制解除,进而传递出BR信号[19],推测FaPP2CX1的LRR结构域可能与BR结合,激活N端STK结构域的激酶活性,使其与C端的PP2C磷酸酶结构域发生互作,从而调控草莓果实的成熟。
