苹果愈伤过表达MdMYB1对花色素苷合成的影响
2019-10-17姚允聪
陈 丽,姚允聪
(北京农学院植物科学技术学院/农业应用新技术北京市重点实验室,北京 102206)
苹果为蔷薇科(Rosaceae)苹果属(Malus)落叶乔木,是世界四大水果之首[1]。苹果产业在农业结构调整,农民增收和生态改良方面具有重要意义。经过多年发展,目前中国苹果栽培面积、总产量和出口量均居世界首位[2-4]。在苹果产量大幅提升的同时,苹果品质较低已经成为阻碍中国苹果产业发展的重要因素[5-7]。苹果品质的提升对于苹果产业的发展显得尤为重要。果实色泽是苹果果实重要的外观品质,能够在一定程度上影响其市场价格。而红色果皮主要由花色素苷的含量决定[8]。
花色素苷生物合成的分子机理研究表明影响花色素苷生物合成的基因有两类:一类是不同植物共同具有的花色素苷生物合成基因,它们直接编码花色素苷生物合成酶类[9];另一类是调节基因,调节花色素苷生物合成基因表达的强度和过程及色素在空间和时间上的积累[10]。MYB转录因子是植物中一类重要的花色素苷合成调节基因,在拟南芥、玉米、苹果、葡萄等作物的研究表明:MYB 转录因子能够通过与bHLH类蛋白互作,调控花色素苷生物合成基因的表达,从而影响植物器官的色泽发育[11-12]。在梨中,PbMYB10b的大量表达能够促进花色素苷生物合成关键基因PbDFR的表达,从而促进梨果皮中花色素苷的积累[13-14];苹果果实中,同源基因MdMYB10、MdMYB10、MdMYB1能够响应低温、光照的诱导,通过调节DFR、F3’H、ANS、UFGT等花色素苷生物合成途径下游基因的表达,在花瓣、叶片、果实中促进花色素苷的积累[15-16]。
实验室前期对苹果品种‘红富士’(Malusdomestica‘Red Fuji’)的不同发育时期进行转录组测序,发现在果实花色素苷大量积累的关键时期,MdMYB1表达水平显著上升。表明在苹果果实着色过程中,MdMYB1转录因子可能促进苹果果皮花色素苷的积累。本试验通过在苹果愈伤组织中过表达MdMYB1基因,观察表型变化并测定花色素苷类物质变化,同步检测花色素苷生物合成基因表达水平的变化,确定MdMYB1对花色素苷生物合成的调控功能。
深入研究苹果中MdMYB1转录因子参与的花色素苷调控机制,为探索苹果果皮色泽的形成机理和生物合成机理提供良好的理论基础,并且为苹果果实着色的遗传改良以及经济效益的提高提供理论基础和技术支撑。
1 材料与方法
1.1 试验材料
‘王林’(Malusdomesticacv. ‘Orin’)愈伤组织,继代培养愈伤组织生长在MS+1 mg/L 2,4-D+1 mg/L 6-BA+30 g/L蔗糖+8 g/L琼脂,pH=5.8的MS培养基上,在25 ℃中黑暗培养。愈伤组织选材由中国农业大学提供。培养材料放置于北京农学院组培中心。
1.2 愈伤组织遗传转化
选择生长20 d的愈伤组织作为遗传转化的材料。苹果愈伤组织遗传转化方法参照刘鑫[1]的方法。
1.3 苹果愈伤组织处理和RT-PCR分析
将未转化愈伤组织和转化MdMYB1愈伤组织分别取1 g样品,用液氮快速冷冻,并置于-80 ℃超低温冰箱保存。采用艾德莱EASYspin多糖多酚植物RNA快速提取试剂盒,提取液氮冻样的RNA,利用反转录试剂盒PrimeScript©RT reagent Kit (Perfect Real Time,TaKaRa)将RNA反转为cDNA。使用pRI101-MdMYB1的通用引物35S:5′-ACTGACGTAAGGGATGACGCAC-3′和EGFPN:5′-CGTCGCCGTCCAGCTCGACCAG-3′进行RT-PCR检测。
1.4 MdMYB1过表达载体的构建
MdMYB1全长序列为732 bp,与过表达质粒pRI101-GFP用限制性内切酶BamH I和Xba I双酶切,得到片段连接后转入大肠杆菌,测序正确的质粒转化农杆菌GV3101备用。
1.5 qRT-PCR分析
实时荧光定量PCR(qRT-PCR)参照SYBR©Premix Ex TaqTM II(TliRNaseHPlus)试剂(TAKARA)使用说明书,采用实时荧光定量PCR两步法(95 ℃预变性3 min,94 ℃变性20 s,60 ℃退火30 s,72 ℃延伸30 s,40次循环);以苹果18SRNA作为内参基因,上游引物为5′-TGACCGAATGAGCAAGGAAATTACT-3′,下游引物为5′-TACTCAGCTTTGGCAATCCACATC-3′;MdMYB1表达水平检测引物:上游引物为5′-GGCGCATGATCTTGGCGACA GT-3′,下游引物为5′-ACGCCACCACAAACGTCG TCG-3′;MdCHS表达水平检测引物:上游引物为5′-GTGACTGTCCAGGAAGTTCGC-3′,下游引物为5′-GCACACACTTGGATTCTCCTTTAG-3′;MdDFR表达水平检测引物:上游引物为5′-CCGAGTCCGAATCCGTTTGT-3′,下游引物为5′-CCTTCTTCTGATTCGTGGGGT-3′;MdANS表达水平检测引物:上游引物为5′-GAGAAGTATGCCAATGACCAGG-3′,下游引物为5′-GGCGGTTGCCTCAATGTAAT-3′。样品均进行3次生物学重复。采用2-ΔΔCT法对数据进行定量分析,用Excel软件作图。
1.6 HPLC法测定愈伤组织花色素苷含量
用液氮将愈伤组织磨成细粉,称取1 g粉末加入1 mL花色素苷提取液(体积比为V甲醇∶V甲酸∶V水=80∶1∶19),随后在45 ℃的水浴中超声50 min。对花色素苷提取液进行纯化处理,使用离心机(12 000 r/min)离心10 min,用0.22 μm微孔滤膜对上清液进行过滤,装于液相色谱上样瓶中用于HPLC检测[10]。
2 结果与分析
2.1 愈伤组织转基因鉴定
将含有pRI101-MdMYB1的农杆菌与‘王林’愈伤组织共培养,进行遗传转化,在抗生素筛选培养基上获得正常生长的转基因愈伤组织(图1A)。使用通用引物检测愈伤组织,结果显示,转基因愈伤组织在1 200 bp处有明显条带,与pRI101-MdMYB1通用引物之间的大小相符,而未转化愈伤组织无条带,表明pRI101-MdMYB1已成功转入愈伤组织中。如图1所示。

图1 A. MdMYB1转基因愈伤组织;B. PCR检测愈伤组织中对照和转基因株系中MdMYB1表达Fig.1 A. MdMYB1 transgenic callus; B. PCR detection of MdMYB1 expression in control and transgenic callus
2.2 低温和光照处理对愈伤组织的影响
将未转化和转基因愈伤组织放在同一个培养皿中,在不同的低温和光照下持续处理14 d,观察愈伤组织的表型变化。如表1所示,在高光10 000 lx和低温16 ℃的条件下,试验组愈伤组织变红,而对照组愈伤组织无明显变化;说明此条件下能促进花色素苷的积累,使愈伤组织变红。
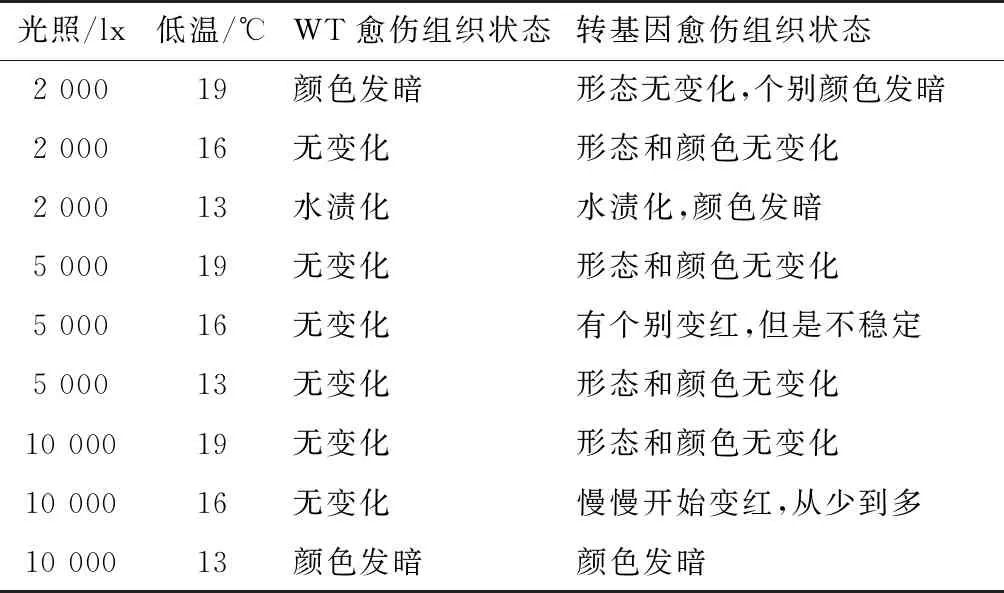
表1 不同低温和光照组合对愈伤组织的影响Tab.1 Effects of different low temperatures and lights on callus
2.3 HPLC测定愈伤组织花色素苷含量变化
为了确定MdMYB1转基因愈伤组织能够促进花色素苷的积累,对MdMYB1转基因愈伤组织进行色谱鉴定分析。如图2所示,MdMYB1转基因愈伤组织中花色素苷含量显著增加,MdMYB1转基因愈伤组织的花色素苷含量相比WT花色素苷含量明显升高8倍左右,说明MdMYB1可以正调控苹果愈伤组织中花色素苷的生物合成,促进花色素苷的积累。
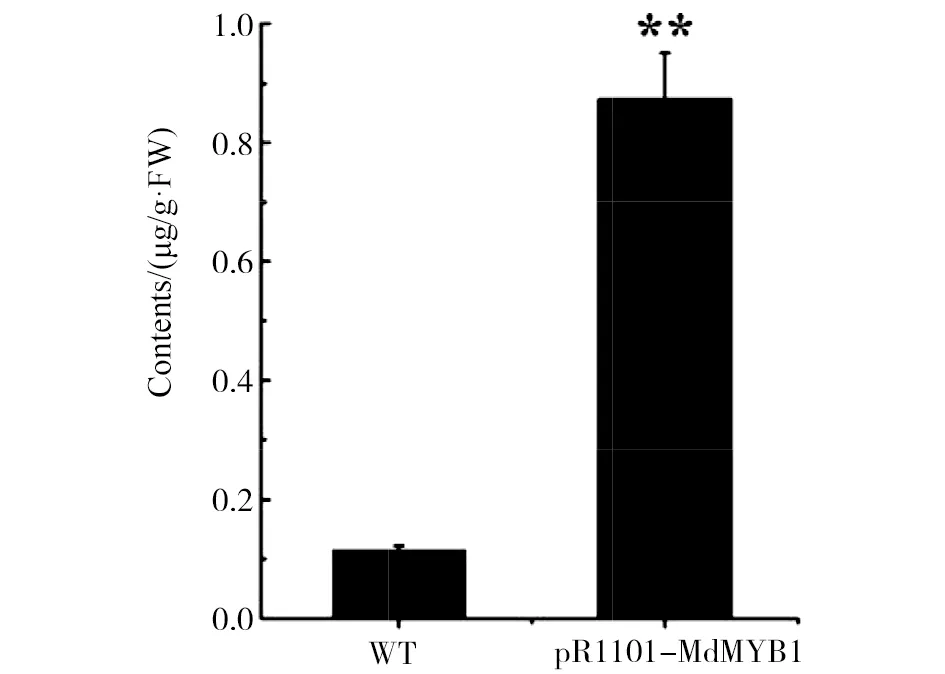
图2 愈伤组织花色素苷含量的变化Fig.2 The change of anthocyanin content in callus
2.4 MdMYB1基因表达水平
MdMYB1转基因愈伤组织在处理后的表型上发生变化,颜色变红(图3A)。为了确定转化MdMYB1能使愈伤组织变红,检测农杆菌转化后愈伤组织中MdMYB1和花色素苷生物合成基因的表达水平,并发现MdMYB1对花色素苷的影响。相比于对照组,转基因愈伤组织MdMYB1的表达水平明显升高20倍左右;并且花色素苷生物合成基因MdCHS,MdDFR,MdANS的表达水平均显著上升,证明MdMYB1转录因子的大量表达能够促进MdDFR,UFGT,MdANS基因的表达,促进花色素苷的生物合成积累(图3B)。

注:A.愈伤组织经低温和光照处理后的表型变化;B. qRT-PCR检测愈伤组织中MdMYB1基因表达水平和花色素苷生物合成基因表达水平。Note: A. The phenotype of callus after low temperature and light treatments; B. Expression level of MdMYB1 and anthocyanin biosynthesis genes in transgenic callus by qRT-PCR.图3 低温和光照处理14 d后转MdMYB1愈伤组织表型和表达分析Fig.3 The phenotype and expression analysis of callus after 14 d low temperature and light treatments
3 讨 论
苹果作为中国重要的经济作物,其果实的品质影响果实的经济效益。而在苹果的生产过程中,果实的色泽影响果实的品质,从而影响消费者的选择。研究苹果果实着色对于改善果实品质以及提高经济收益具有重要的意义[17]。
花色素苷有丰富的营养价值和抗氧化性能,是苹果叶、花和果中色泽的重要决定因素。花色素苷本身具有抗氧化活性,在提高观赏价值的同时还能够增加果实的营养价值,因此花色素苷对于苹果有至关重要的作用[18]。
MYB转录因子是植物最大的转录因子家族之一,在此前的研究中已经被证实其可参与到多种生物和非生物胁迫过程,通过调控类黄酮化合物的生物合成,使植物适应不同的环境变化[19]。
在苹果上先后发现MdMYB1、MdMYB10、MdMYBA、MdMYB110a基因能够响应环境诱导,与MdbHLH蛋白互作,从而调控苹果果实色泽发育[20-23]。同时,MYB转录因子调控花色素苷积累主要通过调控花色素苷生物合成基因的表达来实现。MdMYB10转录因子能够结合MdDFR基因的启动子,MdMYB1能够结合UFGT基因的启动子,而MdMYBA能够特定的结合MdANS基因的启动子,这些转录因子的大量积累,能够改变下游花色素苷生物合成基因的表达,从而促进花色素苷积累,实现对果皮色泽的调控。在本试验中,MdMYB1的大量表达使花色素苷生物合成基因MdCHS、MdDFR和MdANS表达水平明显增加,从而促进愈伤组织变红。与前人研究相符合。本研究为深入了解MdMYB1调控花色素苷作用机理提供技术支撑,为苹果果实品质的提高提供新方法,新思路。
