嗜热酯酶的研究进展
2019-10-16李婷婷张天喜武俊明陈华友
李婷婷, 张天喜, 武俊明, 陈华友
(1.江苏大学 生命科学研究院, 镇江 212000; 2.江苏中兴药业有限公司, 镇江 212000)
近年来,生物催化凭借其温和的作用条件,独特高效的底物选择性等特点,普遍应用于生物化工领域[1]。酯酶是一类水解酶,能够在水分子的作用下将酯类裂解成酸和醇,完成酯化、酯交换等重要反应,这些酶基于它们的特异性受体、蛋白质结构和功能而变化,广泛用于工业酶催化。
通过微生物发酵的方法生产酯酶具有价格低廉、原料丰富、方法简单等优点,而大多数工业生产使用的酯酶属于嗜温微生物,在高温、高碱等恶劣的工业环境中极不稳定乃至丧失活性[2],这就使嗜温酯酶的应用受到了一定的局限。嗜热酯酶指最适生长温度在60 ℃以上的酶类,它融合了嗜热酶和酯酶的基础特征,在极端的自然环境下仍能保持较好的热稳定性和化学稳定性,在生物催化领域越来越受到重视[3]。
1 嗜热酯酶的来源
1.1 利用定向分子进化技术改造常温酯酶得到嗜热酯酶
定向进化是提高蛋白功能与活性的有效途径。在确保酶稳定性的基础上,利用分子修饰来增强催化活性成为得到理想酶的新方法[4]。利用定向进化技术对嗜热酯酶进行改造能够提高重要功能性非天然化合物的催化性能[5]。例如,Adesioye等[6]应用定向进化技术改造乙酰木聚糖酯酶的底物特异性。Liu等[7]通过定向进化得到活性较高、底物特异性较广泛、热稳定性较好的突变体拟除虫菊酯水解酯酶。此外,利用DNA改组技术重组相关基因的片段来产生新的基因库,再通过筛选也可获得新的嗜热酯酶。
1.2 利用基因组克隆与表达技术大量表达嗜热酯酶
随着全基因组测序技术的发展,应用生物信息学技术分析获得疑似嗜热酯酶序列,再通过分子克隆技术扩增并表达出该蛋白,然后对该序列进行性质分析,能很快得到新型嗜热酯酶。通过该方法获得的嗜热酯酶与自然界中的其他酯酶不同,如来自T.Maritima的酯酶TM0033、TM0036,最适温度为95 ℃[8],且拥有很好的热稳定性。另外,来自Ureibacillusthermosphaericus的酯酶estUT1[9]在有机溶剂中表现出很高的稳定性和对有机溶剂的耐受性。此类耐热酯酶因其特殊的环状结构以及基因组易提取和克隆的特性,为工业生产提供了一定的参考。目前,已有多数嗜热酯酶被分离鉴定出来(表1)。

表1 嗜热酯酶的研究进展
2 嗜热酯酶的耐热机制
嗜热酯酶的催化功能和耐受性在高温条件下更突出,因此嗜热酯酶比嗜温酯酶具有更多优点,如发酵温度高,从而减少了杂菌的污染;在高温下无机盐增加了离子作用,有利于生物量的提高;稳定性好,酶解反应速率快,易于在室温下保存等[15],因此在工业生产中有着较好的应用潜能。
2.1 蛋白质的氨基酸组成
嗜热酯酶中的部分氨基酸如半胱氨酸、谷氨酰胺、丝氨酸等,在高温条件下会发生氧化水解、二硫键相互转化等共价修饰作用;带有支链的氨基酸如缬氨酸、苏氨酸等在螺旋的排布中会有较多的限制,所以这些氨基酸在嗜热酯酶中较少出现,约占10%;而脯氨酸、精氨酸、谷氨酸含量较高,约占32.5%,因为脯氨酸的特殊结构,在组成蛋白时比较容易折叠,但折叠后若需要解折叠则要更高的能量,因而富含脯氨酸的蛋白质热稳定性较高[16];而精氨酸和谷氨酸相比带同种电荷的氨基酸侧链结构更大,而且侧链提供的离子相互作用和疏水相互作用也有利于蛋白质热稳定性的提高。
2.2 蛋白质的天然构象
嗜温酯酶与嗜热酯酶的序列同源性较高,但两者形成蛋白质高级结构的非共价作用力不同,嗜热酯酶更倾向于形成高稳定性和催化活性的高级结构。从晶体结构的角度分析,驱动蛋白质折叠形成空间结构的主要力量是疏水作用,它为蛋白质在水溶液中的折叠提供能量。而离子对超嗜热蛋白的稳定性起重要作用,它能够稳定二级结构以及加强其刚性[17]。通过上述分析,来源于嗜热微生物的蛋白通常具有耐热的初级结构,还有形成高级结构的疏水力,即便在体外的纷繁复杂的环境中仍能维持较好的耐热性;因此选择嗜热酯酶应用于生物催化领域,具有事半功倍的效果。
2.3 环境因素
大部分嗜热酯酶本身具备热稳定性,另外还有少数菌体内的嗜热酯酶经菌体内环境因素增强其耐热性。某些金属离子如Ca2+、Mg2+、K+以及Zn2+等[18]也可以提高大多数酶的耐热性。蛋白酶易失活,在应用上有一定的局限性,而来自嗜热菌的嗜热蛋白酶优点显著。如Habib等[19]从温泉中分离出两种新的嗜热菌(Tepidimonassediminissp.nov.andTepidimonasalkaliphilussp.nov.),具有较高的热稳定性。分子伴侣与细胞内蛋白的折叠与装配紧密相连,它可以在生长温度达到最高且靠近胞内蛋白质与酶的变性温度时,通过重折叠保护其他蛋白质和酶的活性,这种保护形式使嗜热微生物能够习惯在高温环境下生存。
3 嗜热酯酶的固定化
酶的固定化技术是通过物理方法或化学方法连接游离酶和相应载体,进而加强酶的稳定性的一类技术(表2),在工业生产实际中发挥着重要作用[20]。固定化酶应用于生物催化过程有较大优势,主要是由于固定化的生物催化剂能反复使用,稳定性更高,后处理工艺简单,生产效率大大提高;然而该技术有着不容忽视的弊端:酶在固定化过程中费用昂贵且比较费时,循环利用时酶活力会受到损失等。

表2 嗜热酯酶不同固定化方式的比较
有关嗜热酯酶的固定化报道较多,如Huttner等[26]研究了4种酯酶在嗜热真菌中的固定化,并通过物理吸附在不同孔径的二氧化硅颗粒上进行了优化。Ren等[27]利用共价连接成功地将嗜热酯酶AFEST固定在环氧载体EC-EP上,并将固定化酶作为生物催化剂用于制备ε-己内酯,通过系统研究该酶,发现固定化酶EC-OD-AEFST具备较好的热稳定性和操作稳定性。然而,这些固定化方法通常操作过于繁琐且成本较高,因此迫切需要新型的酶固定化方式。
近些年枯草杆菌芽孢衣壳蛋白作为良好的分子载体备受研究人员的青睐。该芽孢展示系统利用共价固定与芽孢吸附等作用,将外源蛋白展示在芽孢表面而不需要通过跨膜运输,因此利用该展示系统可以较容易地把大分子蛋白展示在芽孢表面(图1)[28]。此外,枯草芽孢杆菌具备特殊的抗逆性和益生性,并且耐高温、强碱等恶劣环境,回收利用方法简单,明显节约了工业成本。该展示系统也是具有强抗逆性的酶的良好固定化载体,高温环境的利用对耐热性酯酶有一定的借鉴意义。
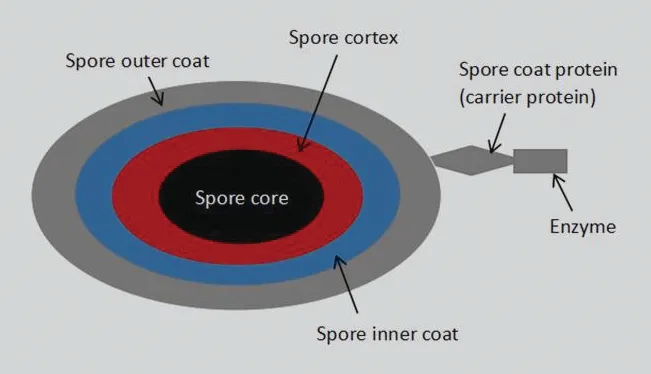
图1 枯草杆菌芽孢表面展示酶示意图
4 嗜热酯酶的主要应用
目前很多酯酶已经商品化,广阔的应用前景使该类酶遍及多种行业。如Whiteley等用嗜热酯酶催化合成生物柴油[29],获得期望结果。生物柴油与普通的油料相比,燃烧更充分,且无铅,对环境影响小。研究表明,嗜热酯酶最有价值的工业属性表现如下:1)高稳定性。能够在室温下分离、纯化、包装和运输,嗜热酯酶作为催化剂时,其环境温度正常大于45 ℃[30],所以这类酶在45 ℃以上稳定性较好。2)在有机试剂中有较好的稳定性和活性。用有机试剂代替水作为生物催化剂有助于疏水性底物的反应、产品的回收、酶热稳定性的提高、防止由水引起的副反应等[27]。因此,有机溶剂有助于嗜热酯酶活性的保持,在工业生物催化等方面发挥着重要作用。3)耐盐性。嗜盐微生物的酯酶尚未全面开发,它们对变性盐的作用有很好的抗性。根据以上描述分析可知,具有多重性质的酯酶在工业领域应用更为广泛,相对于其他类型的酯酶,嗜热酯酶具备较高的热稳定性和底物特异性,因此在工业应用中具有独特的优势。基于工业生物催化剂的重要性,深入研究具有新型特征组合的酶对工业的发展具有重要作用。
5 展望
近年来,随着定向进化、固定化等技术的发展,研究人员发掘了大批具有应用潜力的嗜热酯酶,进一步研究了其耐热机制并获得了显著成效,为以后嗜热酯酶的改造以及产业化生产提供了坚实的理论依据。但同时也发现了一系列的问题,诸如仍有多数嗜热酯酶有待开发;嗜热酯酶的稳定性是否受其刚性和柔性的影响尚不可知;还原剂对嗜热酯酶活性的影响因素、嗜热酯酶的其他催化作用以及该酶的工业化应用领域等,有待进一步探索。
后续关于嗜热酯酶的研究可以从以下几个方面进行探索:结构学上研究DTT(DL-Dithiothreitol,二硫苏糖醇)对嗜热酯酶活性影响的机制,虽然有文献报道嗜热酯酶有很好的耐热性,但很少有文献报道从结构上探索嗜热酯酶的耐热性机制;此外,还可以通过响应面方法(RSM)对插入连接肽的重组酯酶的性质进行分析;也可以从融合蛋白结构上分析插入连接肽后对展示的嗜热酯酶活性影响的机制,这些将是今后研究嗜热酯酶的热点。
