利用碘化钾和淀粉鉴别亚硝酸钠和氯化钠的实验探究
2019-10-16王都留吴生平张少飞杨建东
王都留,燕 翔,吴生平,张少飞 ,杨建东
(陇南师范高等专科学校农林技术学院,甘肃 成县 742500)
1 问题的提出
亚硝酸钠是一种白色或浅黄色晶体或粉末,有咸味,很像食盐,往往容易错当食盐使用。如果误食0.3~0.6g亚硝酸钠就会中毒,食后10min就会出现明显的中毒症状:呕吐、腹痛、紫绀、呼吸困难,甚至抽搐,昏迷,严重时还会危及生命。亚硝酸钠不仅有毒,而且还是致癌物,对人体健康危害很大。
那么如何鉴别固体亚硝酸钠与氯化钠呢?一般从二者的物理性质如颜色、溶解性或化学性质如氧化性、还原性等方面进行鉴别。例如用pH试纸测定二者水溶液的酸碱性鉴别,氯化钠水溶液呈中性,亚硝酸钠溶液呈碱性;让二者与酸反应,利用亚硝酸的不稳定性鉴别;利用亚硝酸钠的还原性与高锰酸钾反应,使高锰酸钾褪色的性质鉴别;利用亚硝酸钠与硝酸银溶液反应生成白色亚硝酸银沉淀,加稀硝酸后沉淀溶解的性质鉴别等等[1-4]。大多数学生实验的方法,是向样品中加入碘化钾溶液反应,再加入淀粉溶液,根据溶液是否变蓝色来鉴别[5]。具体方法是,取两支试管,依次加入少量的NaNO2固体和NaCl固体,分别加入2滴2 mol·L-1H2SO4溶液,振荡,NaNO2固体的试管中冒气泡,NaCl固体只溶解;各加入2 mL 0.1 mol·L-1KI溶液,振荡,NaNO2固体的试管中变成棕黄色,NaCl固体溶解后无明显的现象;然后分别加入2滴2%的淀粉溶液,NaNO2固体的试管中溶液由棕黄色变为深蓝色,NaCl固体的试管中仍然没有明显的现象变化。其主要的反应离子方程式为:
然而,在学生实验中仔细观察会发现,上述实验中NaCl固体的溶液也产生很淡的蓝色溶液(绝大多数人很容易忽视这一现象),学生无法解释这种异常的现象。即在酸性条件下,向亚硝酸钠和氯化钠中加入碘化钾试剂和淀粉溶液,二者均能变蓝色,为什么?
2 实验设计
为了探究实验中的异常现象,设计以下实验进行探究。
2.1 检验氯化钠中是否有碘
2.2 检验碘化钾溶液中是否有碘
3 实验用品
0.1 mol·L-1的 KI溶液,1 mol·L-1的 H2SO4溶液,NaNO2固体(分析纯),NaCl固体(分析纯),新配制2%的淀粉溶液10mL试管。
4 实验过程
4.1 取一只试管,加入少量的氯化钠固体,振荡,再加入一滴2%的淀粉溶液,观察,无蓝色出现。
4.2 取一只试管,加入少量的氯化钠固体,振荡,加入2 mL 0.1 mol·L-1的碘化钾溶液,再加入2滴2%的淀粉溶液,观察,有蓝色溶液出现。
4.3 取一只试管,加入少量的氯化钠固体,振荡,加入2 mL 0.1 mol·L-1的碘化钾溶液,加入2滴1 mol·L-1的 H2SO4溶液,再加入2滴2%的淀粉溶液,观察,有蓝色出现。
4.4 取一只试管,加入2 mL 0.1 mol·L-1的碘化钾溶液,振荡,再加入2滴2%的淀粉溶液,观察到有蓝色溶液出现,加入2滴1 mol·L-1的 H2SO4溶液,蓝色加深。
5 实验结论
5.1 实验用的氯化钠为分析纯试剂,里面没有碘单质,也没有能氧化碘化钾的氧化剂碘酸钾(如加碘盐中含有碘酸钾)等物质。
5.2 碘化钾溶液中含有少量的碘单质,导致检验氯化钠的过程中有蓝色出现,加入硫酸后蓝色更深,意味着酸性条件下生成的碘更多。
6 理论分析
6.1 查亚碘、氧气的标准电极电势可知[6],酸性条件下


φθ=1.229V
碘离子与空气中的氧气反应,很容易生成少量的碘单质:
(3)4I-(aq) + O2(g) + 4 H+(aq) =2H2O(l) + 2I2(s)
由于碘与淀粉变蓝色的灵敏度非常高,为1.0×10-5mol·L-1[7],所以这些碘单质足以使淀粉溶液变蓝色。加酸或空气中的二氧化碳溶于水均能使碘化钾溶液显酸性而生成少量的碘单质。
根据能斯特方程,氧气的实际电极电势为:
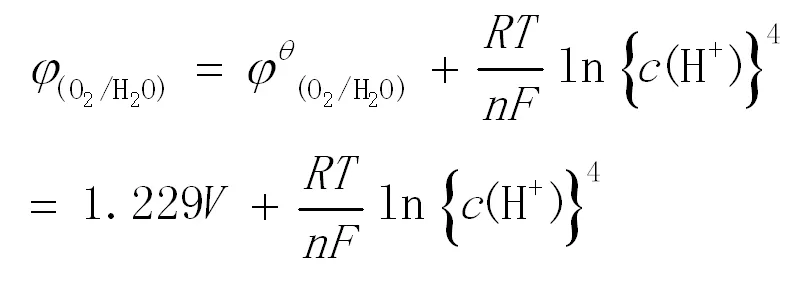
6.2 在碱性条件下

φθ=0.401V

此时,氧气不能氧化碘离子而产生碘单质,碘离子可以稳定存在。以上理论分析表明,在酸性或中性条件下,配制好的碘化钾溶液中存在一定量的碘单质,放置越久生成的碘越多。另外,白色的碘化钾晶体在空气中长期放置,也会遇氧气发生氧化反应生成碘,晶体颜色变成黄色[8],用这样的碘化钾晶体配成的溶液必然含有少量碘单质。碘化钾溶液中存在一定量的碘单质,是造成鉴别亚硝酸钠和氯化钠实验中,氯化钠的试管中加入淀粉溶液后出现蓝色的本质原因。
7 如何配置碘化钾溶液?
查阅有关文献[9-10],配制KI溶液需要加入Na2CO3固体,以保证KI溶液为碱性环境,不致被空气中的氧气氧化成碘单质。
配制方法:以配制0.01 mol·L-1的 KI溶液为例。称取0.166 g KI固体和1 g结晶Na2CO3,溶于水,定容至100mL。其关键措施是加入结晶Na2CO3,利用Na2CO3水解后的弱碱性保证KI溶液不被空气中的氧气氧化成碘。
8 利用碘化钾和淀粉溶液鉴别亚硝酸钠和氯化钠的正确方法
经过多次实验,在利用碘化钾和淀粉溶液鉴别亚硝酸钠和氯化钠的实验中,用加入碳酸钠的晶体配制碘化钾溶液;碘化钾溶液配制成浓度为0.01 mol·L-1;H2SO4用1 mol·L-1的(浓度低产生的碘单质较少,与淀粉变色的颜色不致过深),就可以将二者完全鉴别出来,不再出现异常现象。
实验过程如下:
取两支10 mL试管,依次加入少量的NaNO2固体和NaCl固体,分别加入2滴1 mol·L-1H2SO4溶液,振荡,NaNO2固体的试管中冒气泡,NaCl固体只溶解;各加入2 mL 0.01 mol·L-1KI溶液,振荡,NaNO2固体的试管中变成棕黄色,NaCl固体溶解后无明显的现象;然后分别加入2滴2%的淀粉溶液,NaNO2固体的试管中溶液由棕黄色变为深蓝色,NaCl固体的试管中为无色溶液。
9 结论
利用碘化钾和淀粉溶液鉴别亚硝酸钠和氯化钠,必须加入碳酸钠晶体配制碘化钾溶液;加过量的硫酸酸化会导致碘化钾溶液中生成少量的碘单质,干扰实验现象。为了顺利完成该实验,需要注意以下几点:
(1) 配制碘化钾溶液时加入碳酸钠晶体才能保证试剂的稳定性。
(2) 采用低浓度的碘化钾溶液实验效果比较好。
(3) 加入硫酸酸化时,加入1 mol·L-1的H2SO42滴为宜。
