线粒体氧化磷酸化抑制剂FCCP体外对人精子动力学和线粒体功能的影响
2019-10-16许剑锋王晓尉张林媛傅龙龙梁小薇
许剑锋,王晓尉#,张林媛,傅龙龙,梁小薇*
(1.国家卫生健康委科学技术研究所男性临床研究室,北京 100081;2.中国疾病预防控制中心职业卫生与中毒控制所毒理室,北京 100050)
能量代谢是支撑精子功能的关键因素,在受精过程中,精子的运动、获能、超活化和顶体反应都是高度依赖能量,所以能量代谢在正常男性配子功能中起着极其重要的作用。三磷酸腺苷(ATP)主要由氧化磷酸化与糖酵解两种途径产生,是精子运动和发挥功能的主要能量来源。目前研究认为:人类精子的能量供应同时需要氧化磷酸化与糖酵解这两种途径,前者发生在线粒体,后者发生在精子头部和鞭毛主段[1]。无论哪一种途径受到抑制或损害,都将影响精子的活力和功能。为此,本研究采用线粒体氧化磷酸化特异性抑制剂羰基氰-对-三氟甲氧基苯腙(carbonylcyanidep-trifluoromethoxyphenyl-hydrazone,FCCP)处理人精子,通过检测精子运动参数、线粒体膜电位和ATP含量等的变化,探讨线粒体氧化磷酸化在精子能量代谢中的作用。
资料与方法
一、研究对象
1.精液样本来源:本研究的精液标本来自国家卫健委科学技术研究所人类精子库的捐精志愿者。本研究经该所生殖医学伦理委员会批准,捐精志愿者均签署知情同意书。精液的收集和纳入标准参照《世界卫生组织人类精液检查与处理实验手册 》第5版[2](以下简称《第五版手册》)方法,精液体积2~5 ml,精子浓度≥40×106/ml,前向运动≥32%,精子活动率≥40%,精子正常形态率≥4%,pH 7.2~7.5。
2.主要试剂:精子BWW培养基、Percoll梯度分离液、Hepes缓冲液、伊红染液均为北京索莱宝产品;伊红-苯胺黑染液为深圳华康产品;FCCP(C2920,Sigma,美国)。
3.主要仪器:台式高速离心机(Thermo,德国)、恒温培养箱(Thermo,德国)、Makler精子计数板(Sefi-Medical Instruments,以色列)、酶标仪(Tecan Infinite M200,瑞士)、计算机辅助精液分析仪(Hamilton Thorne-IVOS CASA,Beverly,美国)、流式细胞仪(BD Accuri C6,美国)、荧光显微镜(Nikon,日本)。
二、研究方法
1.精液收集和预处理:捐精志愿者年龄22~40岁,禁欲5~7 d,以手淫法获取一次射精的全部精液,放入无菌带盖塑料杯内,置于37℃恒温培养箱中30~60 min,使之完全液化。用Makler精子计数板在显微镜下初检精子浓度和活动率,符合纳入标准的精液参照《第5版手册》采用非连续梯度密度离心法[2]处理。优选后的高质量精子用含20 mmol/L Hepes的BWW培养基洗涤两次(300g,10 min)并调整精子悬液浓度为20×106/ml待用。
2.FCCP共孵育:吸取少量DMSO溶解FCCP,用BWW稀释至实验终浓度为0 μmol/L、2.5 μmol/L、5 μmol/L和10 μmol/L,DMSO的含量保持低于0.1%。
符合标准的精液标本共8份,预处理后的精子悬液各分成4组,每组分别以等体积与不同浓度的FCCP在37℃共孵育1 h、3 h、5 h。
3.精子动力学指标检测:调整精子悬液浓度为20×106/ml。FCCP处理1、3、5 h后,从每份精子悬液中取出10 μl以计算机辅助精子分析系统(CASA)评价每份样本至少200个精子的运动能力。记录活动率(%)、前向运动百分率(%)、平均路径速率(VAP)、直线速率(VSL)、曲线速率(VCL)、前向性(STR,为平均路径的直线性。STR=VSL/VAP)、直线性(LIN,为曲线路径的直线性。LIN=VSL/VCL)、精子头部侧向运动平均振幅(ALH)和鞭打频率(BCF)。
4.线粒体功能检测:(1)线粒体膜电位(Mitochondrial membrane potential,MMP):调整精子悬液浓度为1×106/ml,受试物处理5 h后,按照JC-10线粒体膜电位检测试剂盒(AAT Bioquest,美国)说明书操作;采用流式细胞仪检测,FL1通道收集绿色荧光信号,FL2通道收集红色荧光信号,记录FL2/FL1比值。(2)精子细胞内ATP 含量:采用EZScreenTMATP Colorimetric Assay Kit(Biovision,美国)试剂盒检测,按照试剂盒说明书操作,在酶标仪(Tecan Infinite M200,瑞士)上检测光密度。ATP含量以pM/百万个精子表示。
5.质膜完整性(plasma membrane integrity,PMI)检测:精子悬液与不同浓度的FCCP共孵育5 h后,参照《第5版手册》中方法伊红-苯胺黑染色分析统计精子质膜完整率。
三、统计分析
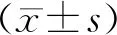
结果
一、FCCP对精子运动的影响
统计结果显示,FCCP处理精子1 h后,10 μmol/L组的活动率[(36.00±2.65)% vs.(55.20±10.16)%]和前向运动百分率[(19.67±1.53)% vs.(40.00±14.51)%]均显著低于对照组(P<0.05),5 μmol/L和10 μmol/L组的ALH有显著降低(P<0.05),其他运动参数未见显著变化(P>0.05)(表1)。
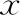
表1 不同浓度FCCP处理精子1 h后精子的动力学参数(-±s)
注:与对照组(0 μmol/L)比较,*P<0.05
FCCP处理精子3 h后,10 μmol/L组的活动率、前向运动百分率、VAP、VSL、VCL、ALH和BCF与对照组的相应指标比较均显著下降(P<0.05),5 μmol/L组的ALH和BCF也显著低于对照组(P<0.05)(表2)。
不同浓度的FCCP处理精子5 h后,各项运动参数仍呈随着处理浓度增加而下降的趋势,10 μmol/L组与对照组相比,活动率、前向运动百分比、VSL、VCL、ALH和BCF显著低于对照组(P<0.05),VAP也降低,但无统计学显著性(P>0.05);5 μmol/L组的活动率、前向运动百分比和BCF显著低于对照组(P<0.05);2.5 μmol/L组前向运动百分率也显著低于对照组(P<0.05)(表3)。
二、FCCP对精子线粒体功能及质膜完整性的影响
根据上述结果,FCCP处理精子1、3、5 h均对精子活力产生了影响,特别是5 h,随着时间延长,精子活力下降明显。故选择5 h作为观察终点,进行MMP、ATP及质膜完整性(PMI)的检测。结果显示,5 μmol/L和10 μmol/L FCCP处理精子5 h后,均显著降低MMP和ATP(P<0.05),并随着浓度增加有逐渐降低趋势;10 μmol/L组的PMI为(73.94±7.11)%,显著低于对照组(84.53±11.65)%,差异有统计学意义(P<0.05)。其他浓度组的PMI尽管低于对照组,但无显著性差异(P>0.05)(表4)。
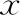
表2 不同浓度FCCP处理精子3 h后精子的动力学参数(-±s)
注:与对照组(0 μmol/L)比较,*P<0.05,#P<0.01
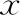
表3 不同浓度FCCP处理精子5 h后精子的动力学参数(-±s)
注:与对照组(0 μmol/L)相比,*P<0.05,#P<0.01
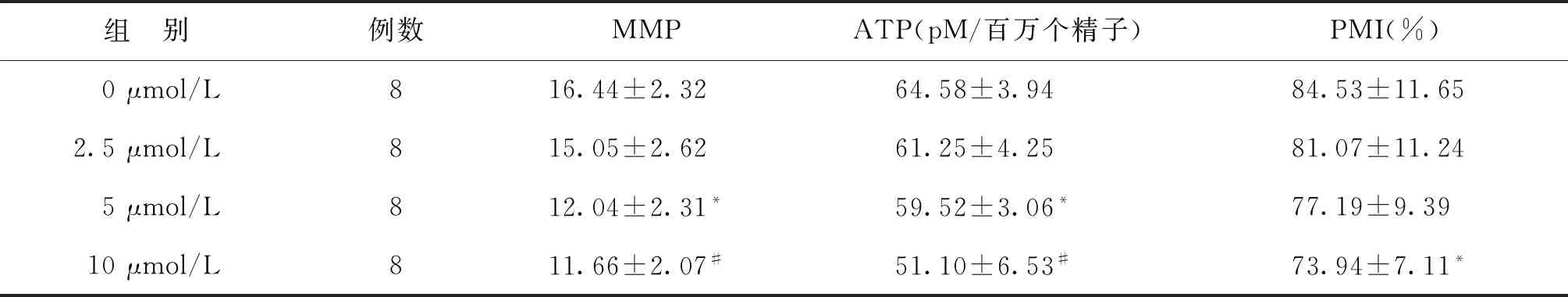
表4 不同浓度FCCP处理精子5 h后对精子质膜完整性和线粒体功能的变化
注:与对照组(0 μmol/L)比较,*P<0.05,#P<0.01
讨论
精子是高度分化的细胞,能够适应不同的环境条件,ATP为精子执行核心功能提供了能量。如果精子受到外源性物质的刺激,可能导致质膜和动力学的改变,使能量代谢变化,进而影响其与卵母细胞结合以及受精的能力[3]。有研究表明,精子ATP的产生可以通过两种途径即糖酵解和氧化磷酸化。从理论上讲,通过氧化磷酸化产生的ATP是糖酵解的15倍[1]。但是关于人的精子更多的利用氧化磷酸化还是糖酵解的能量代谢方式以维持精子运动尚有争论。因此,本研究利用氧化磷酸化的抑制剂,观察精子的氧化磷酸化途径受到抑制而糖酵解正常状态下精子运动和线粒体功能的影响。
已知羰基氰-对-三氟甲氧基苯腙(FCCP)是经典的氧化磷酸化解偶联剂。早在1990年有研究者描述了FCCP在线粒体内膜水平的作用机制[4]。FCCP是亲脂性弱酸,可以轻易地扩散穿过线粒体内膜,进入呈酸性的线粒体膜间部位,以不带电(质子化)形式将膜间隙的H+带回线粒体并释放到基质中,从而消除了线粒体内膜两侧的H+浓度梯度,使ATP合成酶丧失被激活的质子驱动力,不能合成ATP,因此解除了氧化与磷酸化的偶联,抑制氧化磷酸化[5]。Davila等[6]采用线粒体解偶联剂CCCP处理种马精子,发现种马精子的线粒体膜电位下降,ATP产量下降,精子活动率下降。该研究也采用了糖酵解的抑制剂,也出现相似的结果,但各项指标降低程度是不同的,证实两种供能途径都是需要的,但以氧化磷酸化为主[6]。Ramió-Lluch等[7]研究表明线粒体活性解偶联能降低公猪精子活力,表明线粒体ATP的产生是至关重要的。本研究采用体外试验常用的FCCP浓度2~10 μmol/L[7]处理人精子,结果表明精子与FCCP共孵育1 h,运动速率没有显著变化,而随着FCCP处理时间延长,精子的活动率、前向运动百分率和运动速率都呈下降趋势,特别是平均路径速率(VAP)、直线速率(VSL)、曲线速率(VCL)降低明显;并且,随着FCCP的浓度增加,各项指标均呈浓度依赖的下降,提示较高浓度的FCCP可能更大程度上打破了线粒体内膜两侧的浓度梯度,ATP的合成受到较大影响,而使精子的供能不足从而影响了精子运动。尽管糖酵解可能仍在发挥功能作用,但也未能抵消氧化磷酸化受到抑制后对精子运动的影响。在3个处理浓度中5 μmol/L和10 μmol/L均能很好地抑制精子运动,而浓度较低的2.5 μmol/L组的各项指标在不同孵育时间下变化均不明显。在体外试验中若采用FCCP作为阳性对照组,可以考虑适当提高处理浓度和孵育时间。
精子线粒体是反应精子健康状态和生育的标志物[8-9],在能量生成中线粒体具有核心的作用。线粒体具有两侧膜结构-外膜和内膜。线粒体内膜(IMM)是通过氧化磷酸化产生ATP的部位,控制着离子和代谢产物通过转运蛋白传输,以及细胞的氧化状态[10]。IMM的完整和非渗透性保证了线粒体功能的正常。线粒体膜电位反应了沿着电子传递链电子传递而形成的质子梯度,而这个梯度被ATP合成酶利用产生ATP[11]。外源性物质作用于线粒体的靶部位之一是线粒体内膜[11]。本研究引入氧化磷酸化抑制剂FCCP,发现5 μmol/L和10 μmol/L FCCP处理精子5 h使线粒体膜电位和ATP含量均比对照组显著降低,可能的机制为IMM对质子的渗透性增加,跨膜质子梯度破坏,导致跨膜电位崩溃,损害ATP合成的驱动力,使得精子能量供应受损[11-12]。表明氧化磷酸化对精子活动的能量供应有重要作用。
有研究推测氧化磷酸化通路主要在人类精子运动前期起主导作用,后期精子主要利用糖酵解进行供能,其目的是为了减少氧化损伤从而来维持长时间快速前向运动;糖酵解和线粒体的氧化呼吸都参与ATP的合成,它们互相依赖,从而使精子在应对体外不同能量代谢底物刺激时能灵活转变,从而提供充足的能量以维持精子活动力和功能[13-14]。也有研究认为精子能量供应方式有物种差异,如牛精子线粒体氧化磷酸化或糖酵解均较强,而人类和大鼠、小鼠主要依赖糖酵解供能[15-16]。本研究采用了氧化磷酸化抑制剂FCCP与人精子共孵育,检测了精子动力学指标和线粒体功能标志物,结果表明FCCP通过对氧化磷酸化的解偶联作用使精子运动能力和线粒体活性明显降低,并且这种能量供应的不足是糖酵解所不能完全代偿的,所以氧化磷酸化是维持人类精子功能的重要能量代谢途径。
