表皮生长因子对大鼠睾丸间质干细胞增殖和分化的影响研究
2019-10-15纪洵敏苏志坚蒲俏虹彭拓华张吉凯
张 磊,纪洵敏,苏志坚,唐 芮,蒲俏虹,彭拓华,张吉凯
睾丸间质细胞(leydig cell)是哺乳动物睾丸间质中的一种内分泌细胞,具有合成和分泌睾酮的功能,是男性体内雄激素的最主要来源[1],具有促进胚胎期生殖器官的分化发育、形成和维持男性第二性征,促使精子发生与成熟,激发性欲,维持性功能以及调节人体的新陈代谢(如蛋白质合成、骨骼生长及红细胞生成等)等极其重要的生理功能[2]。近几十年来,伴随着全球老龄化问题的加剧,中老年男性部分性激素缺乏综合征引起的社会问题日益突出,而传统的激素治疗方法存在严重不足,因而迫切需要开发全新的生物相容性高的替代治疗方法。在这种形势下,睾丸间质细胞再生分化的研究逐渐成为时下研究的热点。
表皮生长因子(epidermal growth factor,EGF)于1962年首次在小鼠的颌下腺中发现[3]。EGF是由53个氨基酸组成的多肽单链,分子量为6 045,EGF的生物学效应是通过与其受体(EGFR)结合而发挥作用的。它是一种促细胞分裂剂,能加速核酸和蛋白质的合成,从而促进多种细胞分裂增殖,并影响细胞的分化[4]。近年来,研究显示EGF与睾丸间质细胞的增殖分化功能存在密切关系[5],但是缺乏直接的研究证据,由于睾丸间质细胞株和原代睾丸间质细胞存在的缺陷和不足[6],该研究采用课题组构建的二甲磺基乙烷(ethylene dimethanesulfonate,EDS)处理曲细精管体外培养模型[7]来探讨EGF在睾丸间质细胞的再生分化过程中对其增殖和分化的影响,目前国内开展这方面的研究较少,该模型直观地反映了EGF在睾丸间质干细胞再生增殖分化中的作用,为研究EGF在治疗中老年男性部分性激素缺乏综合征中的功能和作用提供了重要的研究基础数据和实验依据。
1 材料与方法
1.1 材料与仪器SD大鼠(约150 g)购自广东省实验动物中心;EDS由中山大学化工学院庞冀燕老师合成;睾酮放射免疫分析药盒购自北京北方生物技术研究所;EGF购自美国RD公司;胰岛素-转铁蛋白-亚硒酸钠(insulin-transferrin-sodium selenium,ITS,I1884)和促黄体生成素(luteinizing hormone,LH,L9773)购自美国Sigma公司;Click-iT®EdU HCS Assays(C10350)购自美国Invitrogen公司;DMEM/F12培养基购自美国Gibco公司;24孔板(3156)购自美国Corning公司;荧光定量PCR仪、荧光染料 SsoAdvacedTMSYBR®Green(172-5261)以及DNA合成试剂盒iScript cDNA Synthesis(170-8890)均购自美国Bio-Rad公司;RNA抽提试剂盒RNeasy®Plus Mini Kit(74134)购自德国QIAGEN公司;本实验所有引物由华大基因合成。
1.2 方法
1.2.1曲细精管体外模型的构建 参照文献[8],雄性SD大鼠实验前7 d腹腔注射EDS(75 mg/kg),CO2处死后,将睾丸取出,置于冰冷的D-PBS中,剪除被膜,血管与曲细精管剥离,将曲细精管分离成单根,于DMEM/F12培养基中(0.1% BSA和ITS)34 ℃、5% CO2的条件下培养过夜。
1.2.2细胞增殖实验 按照1.2.1中的方法提取分离大鼠曲细精管,构建曲细精管体外培养模型。次日,将曲细精管分至24孔板,加入细胞因子处理曲细精管,分组为ITS组(DMEM/F12培养基中加入0.1% BSA和ITS)、LH组(ITS组加入LH,LH终浓度为10 ng/ml)、EGF100组(ITS组加入EGF,EGF终浓度为100 ng/ml)和EGF10组(ITS组加入EGF,EGF终浓度为10 ng/ml),处理24 h后,Click-iT®EdU HCS Assays试剂盒进行5-乙炔基-2′脱氧尿嘧啶核苷(5-ethynyl-2′-deoxyuridine,EdU)染色,具体操作说明参照试剂盒说明书。
1.2.3细胞分化实验 按照1.2.1中的方法提取分离大鼠曲细精管,构建曲细精管体外培养模型。次日,将曲细精管分至24孔板,加入细胞因子处理,EGF的浓度为100 ng/ml、10 ng/ml,LH浓度为10 ng/ml,处理时间为72 h,而后将含有细胞因子的培养基更换为含LH的培养基继续培养至21 d,每3.5 d更换1次培养基,收集第14天和第21天的培养基上清液待测睾酮,收集第14天和第21天样品提取RNA,荧光定量PCR检测睾酮合成通路上相关酶的表达情况,基因引物序列见表1。

表1 各基因的引物序列
1.3 统计学处理使用SPSS 17.0软件进行分析,多组间比较采用方差分析(ANOVA),两组之间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 EGF对大鼠睾丸间质干细胞促增殖作用EdU染色方法检测大鼠睾丸间质干细胞的增殖情况,结果见图1,在经过LH和EGF处理24 h后,在曲细精管的表面出现了大量的纺锤形的、EdU标记的细胞。与ITS组比较,LH组能够显著促进睾丸间质细胞的大量增殖(t=10.35,P<0.000 1),EGF100组能够显著促进睾丸间质干细胞的增殖(t=12.61,P<0.01),而EGF10组虽然也能显著促进睾丸间质干细胞的增殖(t=6.51,P<0.01),但是与EGF100组比较,其作用效果明显要弱。EGF能够促进睾丸间质干细胞的增殖,并且其作用效果呈现出一定的剂量依赖性。
2.2 EGF对大鼠睾丸间质干细胞促分化作用检测睾丸间质细胞分化的重要指标-睾酮的分泌情况,从图2中可以看出,经过3 d的EGF处理后,换为含LH的培养基继续培养至21 d,与ITS组比较,EGF100组能够显著地促进睾酮的产生(t=6.05,P<0.01),EGF10组也能够显著地促进睾酮的产生(t=3.46,P<0.01),表明EGF能够诱导睾丸间质干细胞向睾丸间质细胞方向的分化,而LH组则没有明显地促进睾酮的产生(t=0.85,P<0.01)。
2.3 睾酮合成过程中几个关键基因的表达情况如图3所示,EGF诱导3 d后,加入含有1 ng/ml LH的培养基继续培养11 d,实验结果显示,EGF能够影响几个基因在mRNA水平的表达。对于Star基因,与ITS组比较,LH组能够显著促进Star基因的表达(P=0.000 5), EGF100组和EGF10组也能显著促进该基因的表达(P=0.000 6、0.000 5),并且与LH组比较, EGF100组的诱导表达作用要明显更强(P=0.000 3);对于Hsd3b1基因,EGF的诱导表达的作用与Star基因相似,与ITS组比较,LH组、EGF100组和EGF10组均能显著地促进Hsd3b1基因的表达(P=0.000 1、P<0.000 1、P<0.000 1),并且与LH组比较, EGF100组的诱导表达作用要更强(P=0.013 3);位于细胞线粒体上的Cyp11a1基因在睾丸间质细胞的分化是一个非常明显的标志物,在睾酮合成过程中也是非常重要的一个中间酶,与ITS组比较,EGF100组能够明显促进Cyp11a1基因的表达(P<0.000 1),并且与LH组比较,其诱导表达要明显更强(P=0.000 2);作为睾丸间质细胞从睾丸间质祖细胞阶段向未成熟睾丸间质细胞阶段分化的典型标志物基因Hsd17b3与前几个基因的表达存在差异,与ITS组比较,EGF100组和EGF10组均没有明显的诱导表达作用(P=0.899 0,P=0.361 7);对于Srd5a1基因,与ITS组比较,EGF100组和EGF10组具有明显的诱导表达作用(P=0.000 3、P=0.007 1)。
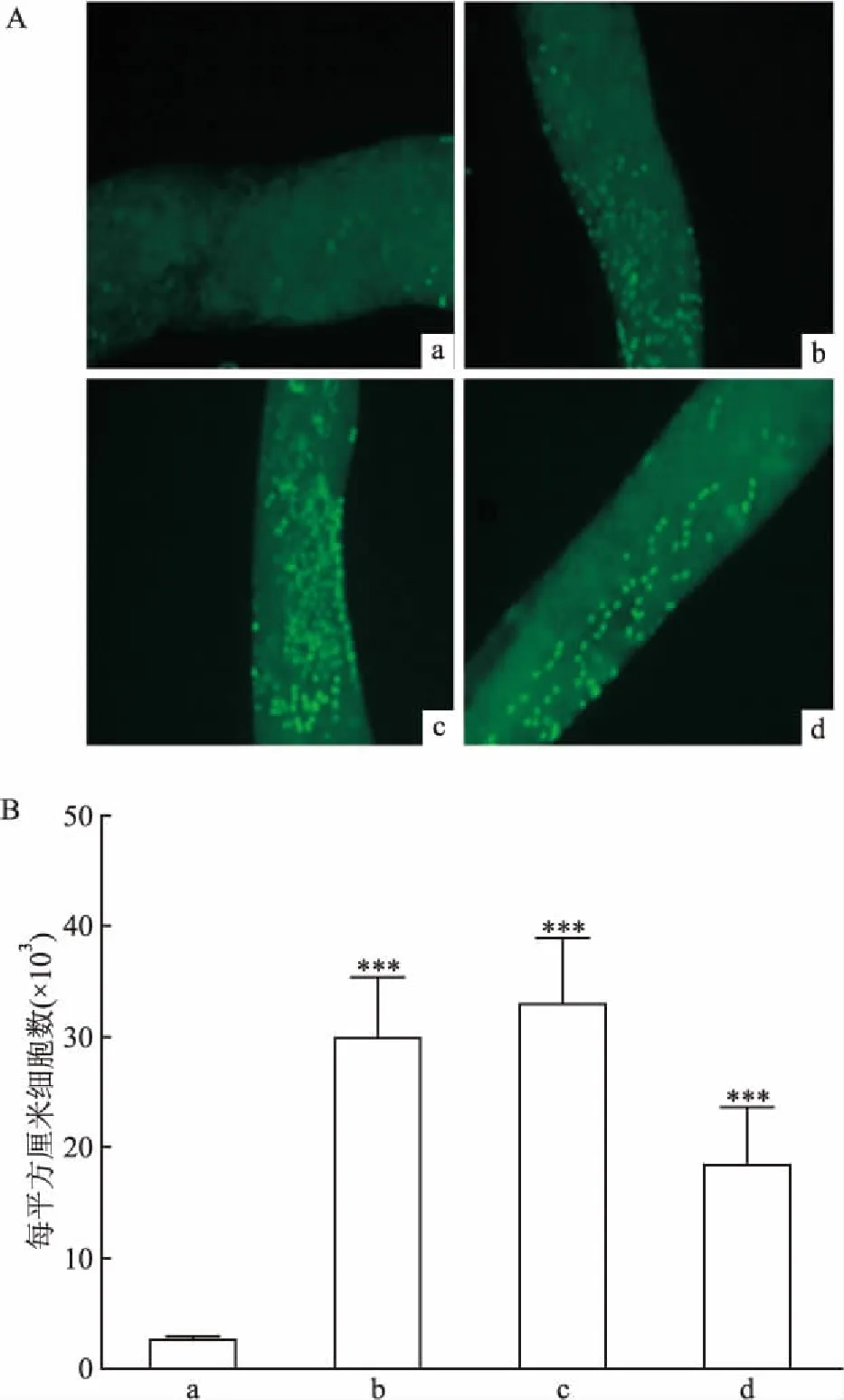
图1 曲细精管的EdU染色
A:EdU染色×100;B:增殖细胞数的统计分析;a:ITS组;b:LH组;c:EGF100组;d:EGF10组;与ITS组比较:***P<0.001
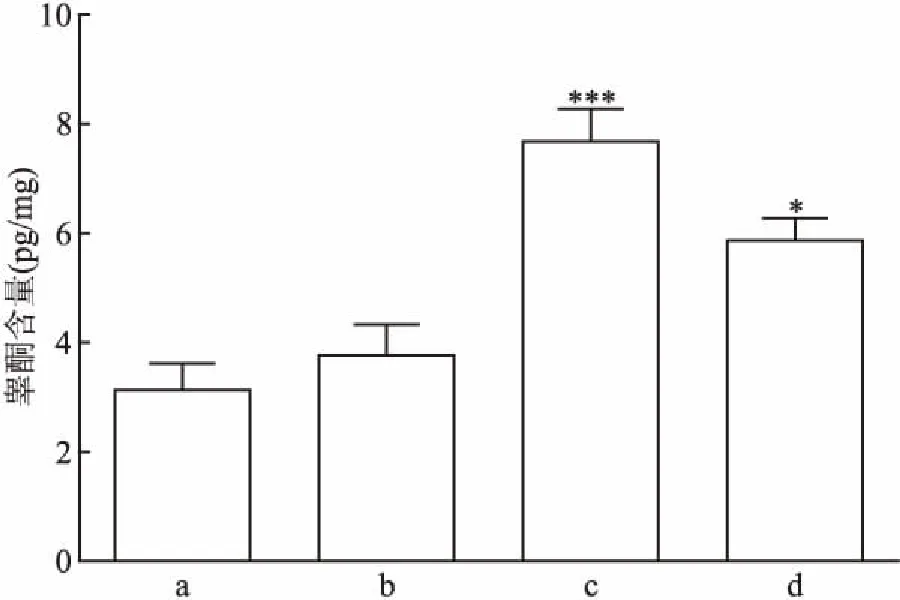
图2 曲细精管培养21 d时培养基上清液中睾酮的分泌情况
A:ITS组;b:LH组;c:EGF100组;d:EGF10组;与ITS组比较:*P<0.05,***P<0.001
3 讨论
成熟睾丸间质细胞的分化主要包括四个阶段:睾丸间质干细胞、睾丸间质祖细胞、未成熟睾丸间质细胞和成熟睾丸间质细胞[9]。研究[10]显示,从出生后7 d的雄性大鼠睾丸内能够分离到睾丸间质干细胞,并且这些细胞主要位于曲细精管的表面。在成年大鼠睾丸内,成年的睾丸间质细胞一旦成熟,将不会再增殖分化。然而,当成年睾丸间质细胞被特异性的抑制剂EDS杀死后,新的睾丸间质细胞就会生成[11]。
大量研究[12]显示EGF能够显著地影响睾丸间质细胞分泌睾酮的能力。但是EGF对大鼠睾丸间质干细胞增殖分化的影响少有报道。在本研究所构建的曲细精管体外培养模型中,EGF能够显著地促进睾丸间质干细胞分化过程中Star、Hsd3b1、Cyp11a1和Hsd17b3等几个关键基因的表达,表明其具有明显地促分化作用,这与研究中睾酮的检测情况是一致的。促增殖作用方面,100 ng/ml和10 ng/ml EGF均能显著地诱导EdU标记阳性的睾丸间质干细胞的增殖,但是在曲细精管培养体系中,出现增殖的不止睾丸间质干细胞,还包括精原细胞和精细胞系的多种细胞,精原细胞和精细胞系的细胞形态及其所处位置均与睾丸间质干细胞不同。
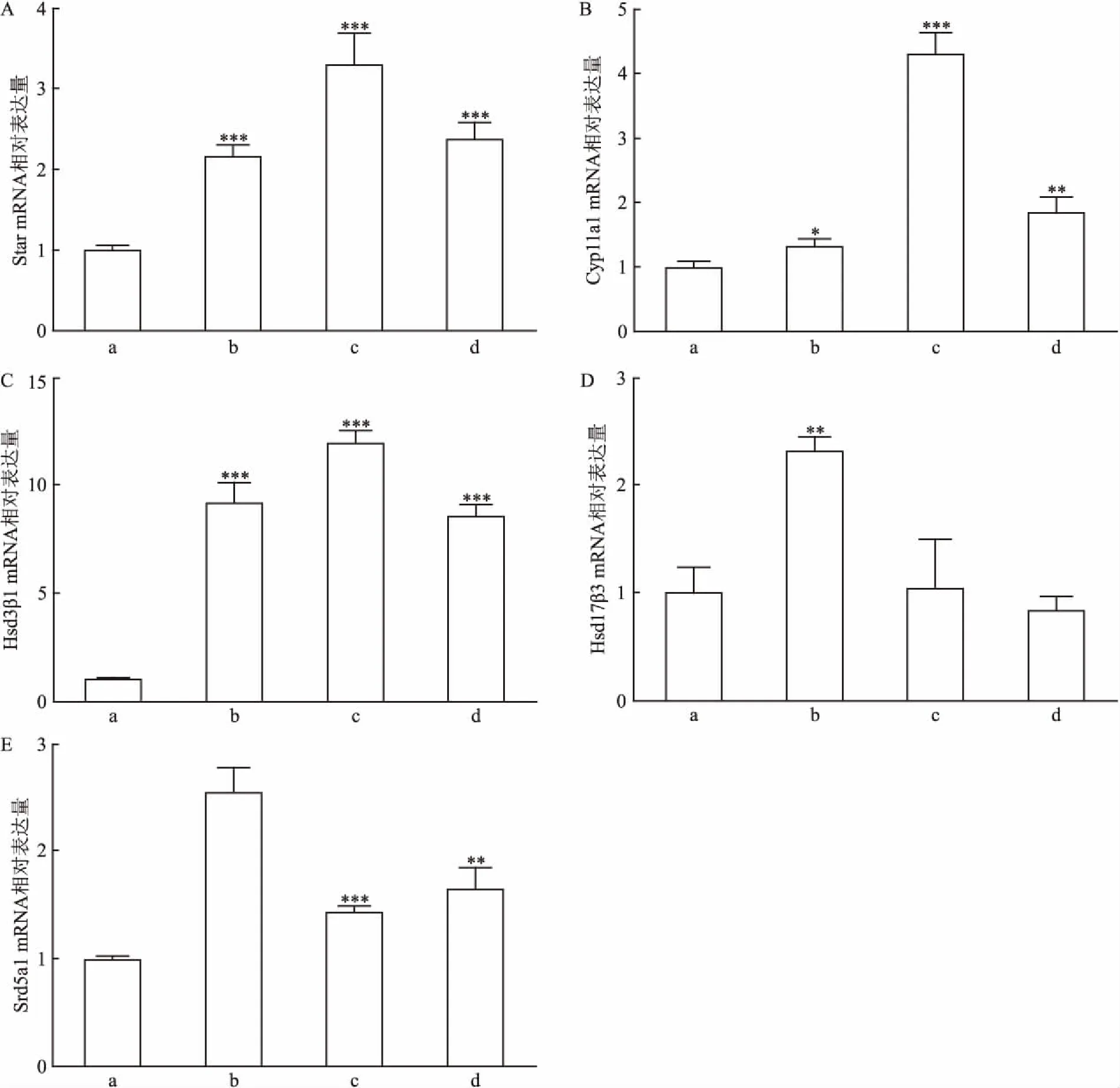
图3 睾酮合成通路几个关键酶基因的表达情况
A:Star; B: Cypllal; C:Hsd3β1;D:Hsd17β3;E:Srd5a1;ITS组;b:LH组;c:EGF100组;d:EGF10组;与ITS组比较:**P<0.01,***P<0.001
本研究首次在体外组织培养体系中证实了EGF的直接促增殖和促分化作用,近几年,许多研究结果也间接证明了EGF对睾丸间质细胞的作用。Pan et al[5]通过运用RT-PCR、Western blot和免疫组化技术研究发现EGF和EGFR在牦牛睾丸的发育精子生成过程中发挥着十分重要的作用;Tamada et al[13]研究发现犬类睾丸中EGF及其受体主要在曲细精管上表达,并且在mRNA水平上随着年龄的增加EGF受体逐渐减少而EGF没有显著变化,表明EGF及其受体在犬类睾丸发育过程中发挥作用;He et al[14]研究显示,新生的公羊驼睾丸并没有EGF表达,而到了青春期、性成熟期,睾丸中EGF在生精细胞、支持细胞、间质细胞才有明显表达;宋卫儒 等[15]研究发现,EGF在食蟹猴睾丸不同发育阶段的表达存在差异,以新生猴期最低,而后各个发育时期EGF表达量升高。
综上所述,利用曲细精管体外培养模型,本研究在mRNA水平和酶学水平均直接证明了EGF对睾丸间质干细胞的作用,这些实验数据将为治疗中老年男性雄激素部分缺乏综合征(PADAM)提供非常重要的线索,即可将EGF作为治疗PADAM的候选药物,开发生物源性雄激素补充药物或睾丸间质细胞再生替代等全新的治疗方法。
