苯硫脲苦味实验存在问题及重新设计
2019-10-15周洲
周 洲
(南京师范大学 生命科学学院,南京 210021)
0 引 言
苯硫脲(Phenylthiocarbamide,PTC)是一种人工合成的白色晶体化合物,因含有N—C=S基团而有苦涩味。PTC尝味能力主要受位于人类7号染色体上的TAS2R38基因影响,尝味者与味盲者主要区别在于TAS2R38基因编码区145位(C/G)、785位(C/T)和886位(G/A)三处存在单核苷酸多态性(SNPs)[1],属于常染色体不完全显性遗传。PTC尝味实验是遗传学实验中常见实验项目,主要用于学习基因在群体水平上的传递规律[2-11]。该实验采用阈值法检测学生PTC尝味能力,然后根据首次尝出苦味的溶液编号确定其基因型,并计算出基因频率和基因型频率,最后分析其是否处于遗传平衡状态。但之前已有研究显示,PTC尝味能力是受多基因控制[8,12],实践调查也表明PTC尝味能力并不完全符合单基因孟德尔遗传规律[13],如父母双方基因型都为tt,子代基因型却为Tt。另外,PTC的苦涩味重并具有毒性,结果易受心理因素干扰[14],学生对其比较排斥,实践中不愿意认真配合调查工作。本文对PTC尝味实验进行重新设计,首先改进实验材料获取方法,而后选择合适PCR引物扩增TAS2R38苦味基因,最后采用RFLP法确定被调查者的基因型,从而获得更为准确与科学的实验结果[15]。
1 实验准备
(1) 实验对象。受试者为在校大学生,年龄为19~20周岁。
(2) 实验试剂。PTC梯度稀释液;50 mmol/L NaOH;1 mol/L Tris-Cl (pH8.0);PCR试剂盒(上海生工);PCR引物(上海生工合成):引物1(5′-CCTTCGTTTTCTTGGTGAATTTTTGGGATGTAGTGAAG-AGGCGG-3′);引物2(5′-AGGTTGGCTTGGTTTGCAA-TCATC-3′);QDL2000 Quantitative DNA Marker (Takara);内切酶Hae III (Takara)等。
(3) 实验仪器。水平电泳槽、微波炉、微量移液器、PCR仪、紫外透射仪等。
2 实验方法
2.1 阈值法
按相关教材方法配制PTC梯度溶液(1~14)[2-11],测试者首先从14号管液体滴加于受试者舌根处,令其缓缓咽下品尝,测试者应尽量避免受试者看到标签。询问受试者能否准确鉴别两种溶液的味道,若不能鉴别或鉴别不准,此依次用13、12号液体重复,直至能明确鉴别出PTC的苦味为止;当受试者鉴别出某一号液体时,应用此号溶液重复尝味3次,3次结果一样时,结果才可靠。根据受试者最初觉察苦味溶液的编号,查对照表查出相应的基因型并做记录。
2.2 PCR-RFLP法
2.2.1 口腔黏膜细胞收集
(1) 实验室取样。取出0.2 μL PCR管,在PCR管加入50 μL 50 mmol/L NaOH溶液;用纯净水轻微漱口,用无菌牙签轻刮脸颊内壁多次,将刮取物置于NaOH溶液中搅动释放细胞,然后弃去牙签。
(2) 校园调查取样。吸取1 mL无水乙醇于1.5 mL离心管中;被调查者用纯净水轻微漱口,用牙签轻刮脸颊内壁多次,将刮取物置于无水乙醇中;剪去不含刮取物的多余牙签部分,盖紧管盖后,带回实验室;置于旋涡混合器上振荡30 s,打开管盖后用弃去牙签;盖紧管盖后,3 000 r/min离心10 min,轻轻倾倒掉上清液,可用移液器轻轻吸取剩下上清液,将离心管倒扣在无菌滤纸上空气晾干,或置于真空干燥仪中快速干燥;加入50 μL 50 mmol/L NaOH溶液,用移液器吹打沉淀,然后将混合液转移至0.2 mL PCR管中。
2.2.2 模板DNA直接制备
将PCR管短暂离心后,置于PCR仪中,95 ℃下裂解10 min;取出PCR管,加入5 μL 1 mol/L Tris-Cl (pH8.0)缓冲液(1/10体积),混匀后即为用于PCR的模板DNA。
2.2.3 PCR扩增
在冰上放置1.5 mL离心管,PCR试剂解冻后立即置于冰上,鉴于溶液黏性造成误差,先按PCR反应所需量配制除DNA模板以外总的混合液,然后在0.2 μL PCR管中精确分成相应等份,实验操作时单独添加模板。30 μL PCR反应体系:5 μL DNA模板,3 μL 10×buffer (1×),1.8 μL MgCl2(1.5 mmol/L),2.4 μL dNTPs (0.2 mmol/L),0.6 μL引物1 (0.2 μmol/L),0.6 μL引物2 (0.2 μmol/L),0.2 μL Taq酶(1.0U),16.4 μL ddH2O。PCR反应条件:95 ℃预变性2 min,94 ℃变性30 s,67 ℃退火45 s,72 ℃延伸45 s,共30个循环,最后在72 ℃下延伸5 min,结束后取出样品4 ℃保存备用。
2.2.4 PCR产物浓度测定
采用4 ℃保存的2.5%琼脂糖凝胶和缓冲液进行电泳检测,加样时将PCR产物与Marker共同点样,以5 μL QDL2000 Quantitative DNA Marker上样量为例,2 000、1 000、750、500、250、100 bp条带的DNA量分别为200、100、75、50、25以及10 ng;100~150 V电泳检测30~40 min;根据Marker和PCR产物电泳条带的大小与亮度,观察与估算PCR产物的大小与浓度。
2.2.5 酶切反应与检测
使用限制性内切酶Hae III对TAS2R38基因PCR产物进行消化。20 μL酶切反应体系:17 μL PCR产物(≤1 μg),2 μL 10×M Buffer (1×),1 μL Hae III内切酶(10U),37 ℃温育3~4 h,最后取出样品进行电泳检测。采用4 ℃保存的2.5%琼脂糖凝胶和缓冲液进行电泳检测,酶切结果检测上样量为20 μL,100~150 V电泳检测40~50 min,最终根据Marker和酶切结果确定基因型。
3 实验结果与讨论
3.1 电泳结果
在凝胶成像系统下观察与拍照,PCR产物电泳检测结果如图1和图3所示,PCR预期产物为221 bp的DNA条带,接近于Marker的250 bp条带,其中图1为实验室取样,图3为校园调查取样,实验结果表明不管是何种取样方法,都可以扩增出221b目的片段。图2和图4分别为图1和图3的酶切电泳检测结果,显性基因T经过Hae III酶切后,长度变为177和44 bp,Hae III无法酶切隐性基因t,因此仅出现177 bp片段则说明是TT基因型;出现221和177 bp片段出现则说明是Tt基因型;仅出现221 bp片段则说明是tt基因型;其中44 bp的DNA片段太短,比较靠前,容易与PCR引物二聚体混在一起,所以无需依据它的存在与否确定PTC基因型。
3.2 实验讨论
采用半定量分子Marker主要是用于确定PCR产物含量问题。从实验结果看,20μL PCR产物的DNA含量达不到1 μg,因此以后开展此实验时,可采用其他常规分子Marker。在实验教学中同时采用阈值法与PCR-RFLP法检测TAS2R38基因型,发现约有19%的同学的尝味结果与基因分型结果不一致,这也说明PTC尝味能力不符合单基因遗传规律。遗传学实验教学内容理应与最新科学研究成果相一致,不能因为之前的方法相对简便,就仍然坚持采用旧内容与方法进行实验教学。采用PCR-RFLP法带来的问题是学生缺乏直观体验,由于十字花科蔬菜中的苦味物质含有N—C=S基团,因此可调查学生对十字花科蔬菜的嗜好性,如萝卜、卷心菜、西兰花等,在调查时要求被调查者如实填写,例如明显能够感觉到苦味为超敏感,偶尔能感觉到的为一般敏感,没有感觉的为不敏感,学生可直观感受TAS2R38基因型与此类蔬菜嗜好性的相关性,激发学生学习兴趣和增强实验教学效果。

图1 实验室取样PCR扩增结果
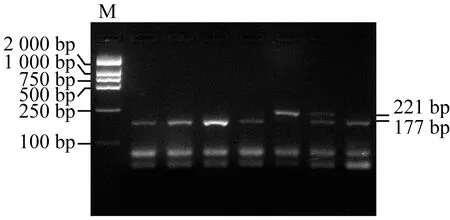
图2 实验室取样酶切结果

图3 校园取样PCR扩增结果

图4 校园取样酶切结果
4 结 语
传统的阈值法即便采用毒性较小的PROP代替PTC进行尝味能力调查,在用于本科实验教学时,仍存在之前的问题,同时该试剂也存在其它缺点,如测量区间更窄,不同基因型对应溶液存在重叠,若要细分出不同基因型,需要与NaCl溶液配合使用,被测试者需反复品尝这两个溶液并做比较,从而难以获得准确结果数据[1]。本实验方法主要通过收集被调查者口腔粘膜细胞,采用直接法快速获取模板DNA,从而简化了实验材料的收集,方便学生进行实验与开展校园调查,同时对实验试剂和仪器要求较低,大多数高校都可以开设此实验。
