组学在花药发育研究中的应用进展Ⅰ:转录组学
2019-10-14张在宝胡梦辉邓丽君李九丽袁红雨
张在宝, 赵 海, 胡梦辉, 邓丽君, 王 琦, 李九丽, 袁红雨,2
1.信阳师范学院生命科学学院, 河南 信阳 464000;2.信阳师范学院, 河南省茶学重点实验室, 河南 信阳 464000
开花植物中,花药不仅为花粉的产生、发育及成熟提供了适宜的环境,并且花药发育过程是直接决定植物育性的关键所在。因此研究植物的花药发育,进一步解析植物的生殖发育调控网络,对于提高植物的抗逆能力、阐明植物雄性不育机制、培育新的作物品种以及最终提高粮食产量具有重要的理论意义与经济价值。
当前,在花药中单纯研究某个基因或单一生物分子的变化,已经很难满足系统生物学越来越高的研究期望。因此,综合多组学数据,从基因、转录、蛋白和代谢水平全面深入地对生物过程进行阐释以更好地对生物系统进行全面了解已成为研究的热点。组学研究是随着系统生物学的发展迅速发展起来的,它的运用为系统生物学提供了大量的实验数据和先进的技术方法,并且为系统生物学的发展提供了新颖的研究思路,加速了系统生物学的发展。
近年来,以转录组学、蛋白质组学和代谢组学为代表的组学分析方法正逐步在植物花药发育的研究上应用,取得了很多突破性的研究成果。本系列文章较全面地介绍了转录组学、蛋白质组学和代谢组学[1]在植物花药和花粉发育、雄性不育和逆境胁迫中的研究成果,以及在非编码RNA中的研究进展,总结和评述了组学整合分析的发展趋势,以期为花药发育相关研究提供参考。
转录组学的概念由 Velculescu等[2]首先提出,指某一特定生理条件下从RNA水平研究基因表达的情况,即生物样本内全部转录本的RNA序列的测序,是研究基因功能和细胞表型的一个重要手段。目前研究转录组学的主要研究方法有:表达序列标签、基因表达序列分析、基因芯片、cDNA-AFLP、高通量测序、逆转录PCR、实时荧光定量PCR、生物信息学等。在花药中进行转录组学研究有利于阐明花药发育过程中发生的生物过程的潜在机制,本文主要阐述了转录组学在植物花药发育研究中的应用进展。
1 转录组学在研究花药发育功能基因方面的应用
前人在花药发育关键基因上的认识主要是通过功能基因敲除、诱变或RNA干扰技术收集的信息[2]。在拟南芥中,许多对花药发育至关重要的基因已被阐明。在拟南芥花药发育的早期阶段,SPL和EMS1发挥着重要作用[3~10],SPOROCYTELESS(SPL)/NOZZLE和ROX参与孢原细胞分化[3,4,11],AtMYB103、DYT1、TDF1、AMS和MS1在绒毡层发育和细胞程序性死亡中起重要作用[5~9]。此外,ems1转录组的变化表明细胞和细胞的信号传导能够显著影响绒毡层中的转录调控网络[12]。目前通过微阵列和序列合成技术已经在许多植物中分析了花药转录组。比如使用比较转录组学方法鉴定了170个小麦基因,用于花药和花粉发育、花粉和雌蕊相互作用等的研究,结果发现小麦近三分之一的基因组经历了亚基因组分化,在鉴定出的基因中,那些参与编码脂质代谢途径的酶基因占最大类别,表明脂质代谢在小麦生殖发育中比较重要和特殊[13]。Ma等[14]通过分析拟南芥小孢子败育的不育突变体(ams)早期花药的转录组谱发现,与野生型花药相比,1 368个基因在ams中差异表达,这影响到了代谢、运输、泛素化和应激反应。此外,他们还将ams转录组谱与其他两种不育突变体,spl/nzz和ems1/exs的序列组合,显示至少一种突变体中有3 058个基因的表达发生改变。ams花药转录组的分析及其与spl/nzz和ems1/exs花药的比较揭示了重叠和不同的受调控基因组,包括编码转录因子和其他蛋白质的基因。Feng等[15]对dyt1和野生型花药的比较转录组分析表明,dyt1是正常表达途径所必需的,包括脂质代谢和转运、花粉层形成、细胞壁修饰、木质素和类黄酮生物合成以及转运。已有的研究表明dyt1与绒毡层功能以及减数分裂和花粉形成的进程紧密相关[16,17]。另外,他们通过转录组分析表明dyt1可能作为精确控制绒毡层功能的转录调控网络中的枢纽。此外,许多基因也在水稻中被鉴定和表征,揭示了基因功能的差异或新的基因功能。Deveshwar等[2]对水稻花药发育的四个阶段,即减数分裂前、减数分裂、单细胞花药和三核花粉进行转录组综合分析,发现在至少一个花药发育阶段中表达的22 000个基因中,减数分裂时期数量最多,在三核花粉时期数量最低。此外,他们通过基因本体论和阶段特异性基因分析揭示了那些编码转录因子和蛋白质折叠、分选和降解途径的基因在减数分裂中占主导地位,而在三核花粉中,编码细胞结构和信号转导的基因比较丰富。
成熟花粉的发育和释放取决于花药的营养细胞层和生殖细胞层中诸多基因的精细协调,花粉的大规模转录组分析研究有助于表征植物花粉发育过程中的基因表达谱[18]。在水稻中,使用44K水稻寡核苷酸微阵列平台和57K水稻基因组阵列,通过激光显微切割绒毡层,小孢子和花粉来研究发育中花粉的转录组,发现水稻中花粉优先产生或阶段特异性转录物的“U型”变化,其中在双细胞阶段优先表达的基因数量最少[19](表1)。研究人员使用拟南芥8K基因芯片研究了拟南芥成熟花粉的转录组,他们分别在成熟花粉中鉴定了992个和1 587个差异表达的基因,估计拟南芥中花粉表达基因的总数在3 500~5 500之间[21,30]。Li等[18]通过对油菜花药发育过程进行全转录组分析,发现脂质和碳水化合物代谢在整个花药发育过程中比较活跃;早期花药优先表达参与脂质代谢的基因,这与花粉形成以及胚细胞和胞质体生物合成相关,而晚期花药表达与碳水化合物代谢相关的基因以形成花粉并在成熟花粉粒中积累淀粉,这揭示了花药发育过程中早期和晚期花药发育阶段之间基因表达的动态变化。
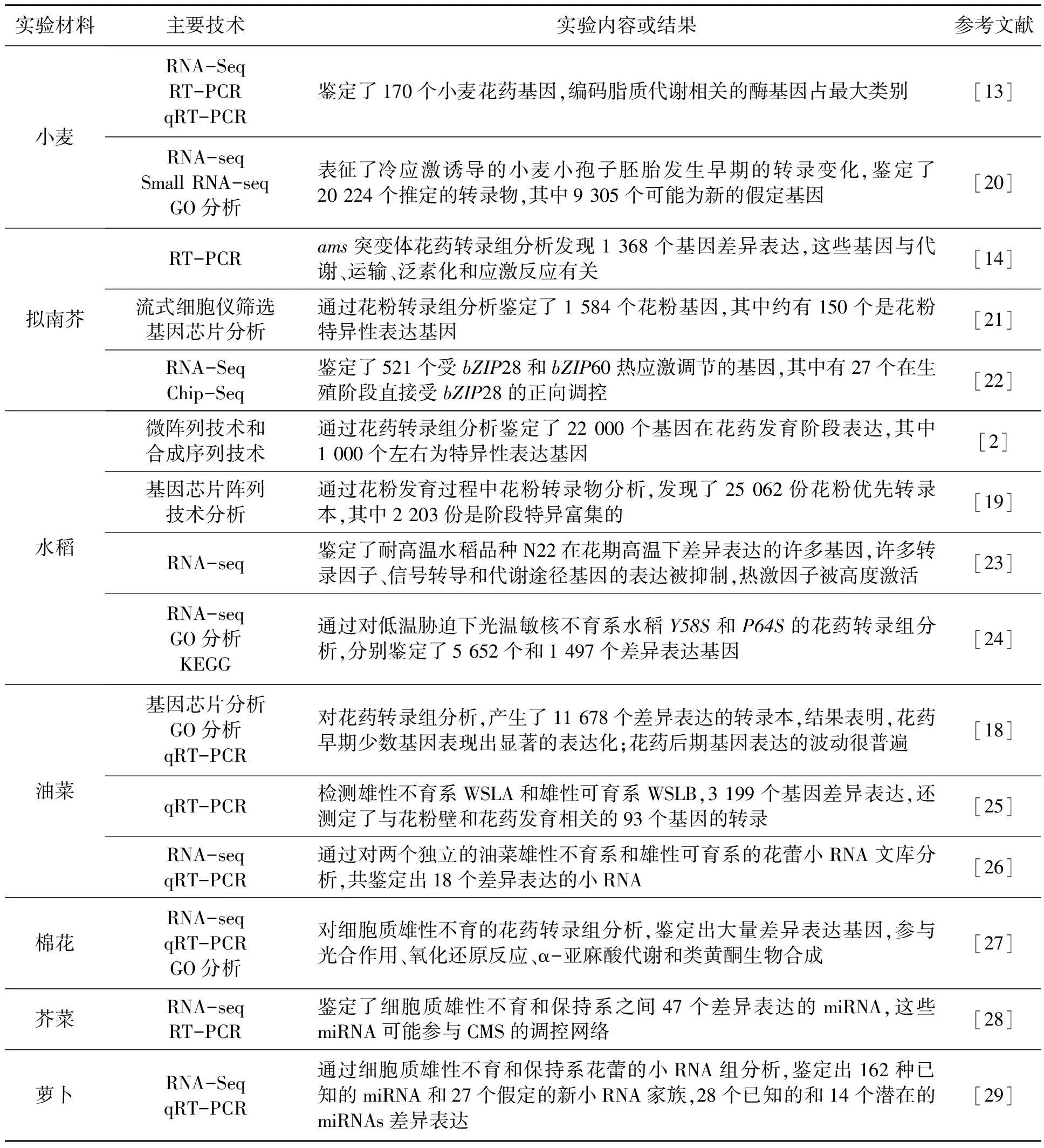
表1 转录组学在花药发育研究中的应用Table 1 Application of transcriptomics in anther development research.
2 转录组学在挖掘花药抗逆基因方面的应用
高温对植物的生殖发育有很大的影响。在对热应激的拟南芥研究中,观察到营养生殖组织中不同的反应模式,在高温胁迫下,数百个基因在花组织中被特异性的上调或下调[22](表1)。Gonzalez-Schain等[23]对N22品种水稻开花期间热处理和对照处理的生殖组织进行RNA测序,揭示了许多编码转录因子家族的基因,以及信号转导和代谢途径基因的表达被抑制。另一方面还发现编码热激因子的基因被高度激活,而且许多基因主要在花药发育的后期阶段表达。
在低温敏感小麦品种的冷处理早期,对小孢子胚胎发育时期的转录变化和调节的研究中确定了大量推定的转录物,这些转录物可能是诱导小孢子胚胎发生的特定基因,Honys等[20]首次了解了小RNA在小孢子重编程中对胚胎细胞命运的调节作用(表1)。水稻生殖阶段的低温胁迫通常会导致花药发育异常,造成小穗育性降低和产量下降。之前仅在幼苗期使用水稻叶片进行水稻冷响应的转录组研究,忽略了对冷更敏感的孕穗期,更忽略了与产量高度相关的生殖器官,如花药。鉴于该阶段在水稻栽培中的重要意义,研究孕穗期耐低温遗传机制势在必行。Bai等[24]使用RNA-Seq分析来研究冷处理后生育敏感阶段两种不同光温敏雄性不育水稻花药的转录组,鉴定了差异表达的基因,例如转录因子、信号转导组分和参与代谢的基因,扩展了对植物冷应激反应的理解。此外,与DNA复制和核糖体相关的差异表达基因也在已有研究中得到了很大程度的丰富,这意味着这些过程可能在水稻花药对冷胁迫的反应中起重要作用(表1)。
3 转录组学在解析雄性不育分子机制方面的应用
雄性不育是开花植物中普遍存在的一个现象,其特征在于植物不能产生正常功能的雄配子,但雌蕊仍具有接受来自其他正常植物的可育花粉并产生种子的能力[31]。导致雄性不育的原因很多,如低温、高温、干旱、重金属、盐度等非生物胁迫会导致花药中很多蛋白质发生变化,进而造成雄性不育[32]。雄性不育是对植物进行遗传改良和利用作物杂种优势进行优化生产的重要工具,也是探索花药和花粉发育生物学中细胞质机制和逆转信号通路的经典模型。
现有的测序技术,已经产生了高质量的水稻、拟南芥和玉米的花药孢子体转录组。这些转录组数据有助于在不同领域进行研究,包括发育基因活动网络、酶和代谢域的变化,通过数量调节、分泌调节、反义转录物调节和小RNA预测蛋白质功能,促进了雄性不育的研究[33]。Qu等[25]通过检测油菜雄性不育系WSLA和雄性可育系WSLB,发现差异表达的基因中有很大一部分涉及与开花相关的生物过程,包括花粉管萌发和生长、花粉壁组装和修饰,以及花粉外壁形成和授粉。此外,与孢粉质积累相关的一部分基因在WSLA中均上调表达,过量的孢粉素导致花粉壁形成缺陷,这导致WSLA雄性不育(表1)。Yang等[27]在棉花细胞质雄性不育研究中鉴定了大量具有生物学意义的差异表达基因,特别是与光合作用、氧化还原反应、α-亚麻酸代谢和类黄酮生物合成有关的基因。
4 在寻找调控类非编码RNA方面的应用
非编码RNA(ncRNA)是一类广泛存在于植物、不编码蛋白质的RNA分子。植物中的ncRNA主要由小ncRNA和长链非编码RNA(lncRNA)组成,小ncRNA包括miRNA(microRNA)和siRNA(small interfering RNA)。它们直接以RNA分子的形式存在于植物体内,具有重要的调节功能,并参与细胞分化和个体发育等生理过程。研究植物的ncRNA可以为深入了解植物的生长发育及系统进化提供重要信息。
植物miRNA是20~24个核苷酸的非编码小RNA,它通过转录后降解或抑制翻译来调控靶基因的表达[34]。许多研究表明,miRNA在植物花药发育过程中发挥着重要作用,miRNA已在许多作物中被鉴定和表征。在芥菜中已经鉴定了细胞质雄性不育(cytoplasmic male sterility, CMS)和保持系之间47个差异表达的miRNA,这些miRNA可能参与花药发育过程中与CMS发生有关的调控途径[28]。在甘蓝型油菜中,参与花粉发育的54个保守的和8个新的miRNA家族被鉴定[26](表1)。在萝卜花药中也鉴定出162种已知的miRNA,其中分别发现28种已知的miRNAs和14种潜在的miRNAs在CMS和保持系之间的进一步发育过程中差异表达[29]。在陆地棉中,16个保守miRNA家族中的6个在花药发育过程中细胞核雄性不育(genic male sterility, GMS)突变体和野生型之间显示出明显的表达差异[35]。Zhang等[36]对三系杂交棉系统减数分裂阶段的花蕾进行小RNA和转录组测序联合分析,发现许多miRNA(DEMs)及其靶基因差异表达,进一步分析显示这可能与CMS和育性恢复有关。另外,对玉米fzt突变体中的雄性不育缺陷个体进行分析,结果表明在玉米花药成熟的最后阶段必须有miRNA的存在,并且花药壁缺陷表明miRNA在花药发育早期可能具有关键的调控作用[37]。
另外,长链非编码RNA(lncRNAs)是指长度大于200个核苷酸、缺少编码蛋白质功能的RNA。目前已经有一些研究报道了在花药发育过程中起调控作用的lncRNAs,例如玉米Zm401是一种主要在花药绒毡层和小孢子中表达的花粉特异性lncRNA,Zm401表达水平显著影响MZm3-3、ZmC5和ZmMADS2的表达,这对于花药发育十分重要;Zm401沉默后导致MZm3-3上调,以及ZmMADS2和ZmC5下调,并造成绒毡层功能和小孢子发育异常,最终导致植物雄性不育[38]。此外在大白菜花粉发育中具有重要功能的BcMF11,是一种含有828个核苷酸的lncRNA。BcMF11在花粉发育的许多阶段转录,当降低其表达时,绒毡层降解会延迟,同时也导致小孢子分离和花粉粒发育中止[39,40]。在水稻中鉴定了一种与长日特异性雄性不育相关的lncRNA(LDMAR),在长日照条件下,正常花粉发育需要足够的LDMAR转录物表达,LDMAR的突变沉默会导致发育中的花药细胞过早地程序性死亡,从而造成植物光敏感雄性不育[41]。
综上所述,转录组学在花药发育功能研究、抗逆基因筛选、雄性不育机制探究乃至表观遗传(调控类非编码RNA)解析等方面发挥广泛而重要的作用。除了对不同发育阶段的花药器官或组织进行转录谱分析外,针对某一特定花药发育关键基因的突变体的转录组分析策略得到广泛地应用,这对深入探究花药发育的网络调控机制具有显著的促进作用;花药是植物对环境胁迫最敏感的器官之一,利用转录组分析技术挖掘抗逆基因很早就已得到应用,某些抗逆关键基因的挖掘和应用,无疑将极大地推动农作物的遗传改良和观赏植物的推广种植;雄性不育是作物育种的主要材料来源之一,其与转录组学技术的结合是探究雄性不育背后的分子机制的关键手段;非编码RNA的调控作用是生物的表观遗传现象之一,尽管目前已经鉴定了一些非编码RNA参与调控某些花药基因的表达,但是还有极其多的调控类非编码RNA未得到鉴定,大规模转录组学的应用在一定程度上缓解了这个问题。
5 展望
技术的诞生和创新源于应用的需求。自从第二代测序技术问世以来,测序技术的发展可谓日新月异。目前,由于基因组和转录组数据所展现的混合细胞群体的限制,人们已经开始探索并应用单细胞测序技术来研究单一或单种细胞的基因和表达信息。2019年中国科技协会在科协年会上发布了20个前沿科学问题和工程技术难题,其中就有“单细胞多组学技术”。世界上没有两片完全一样的叶子,同理,世界上也没有两个完全一样的细胞,即使在同一个组织中刚刚经有丝分裂产生的两个子细胞之间也是如此。就花药发育而言,花药从外到内分别由外表皮、内表皮、中间层、绒毡层和生殖细胞组成,每种细胞都有其特定的起源、分化和功能。先前的研究主要是利用某基因的组织表达模式来推断某细胞群在花药发育中的功能,未来单细胞基因组和转录组技术的应用将极大地促进各类型细胞功能的精确鉴定,另外其在各类型细胞起源的追溯和花药器官的重建方面也具有非常重要的应用潜力。
