羊λ3干扰素在家蚕杆状病毒表达系统中的表达及其抗病毒活性检测
2019-10-14王先翔刘兴健胡小元张志芳李轶女房岭丽叶爱华
王先翔, 赵 泽, 王 朋, 刘兴健, 胡小元, 张志芳, 李轶女, 房岭丽, 叶爱华*
1.安徽农业大学生命科学学院, 合肥 230036;2.中国农业科学院生物技术研究所, 北京 100081
干扰素是机体内一种重要的细胞因子,被发现于20世纪50年代,是研究者们使用灭活的禽流感病毒感染鸡胚绒毛尿囊膜时发现的一种细胞分泌物,其能够干扰和抑制禽流感病毒的复制,故将其命名为干扰素(interferon,IFN)[1]。干扰素可以通过抑制病毒RNA和蛋白质的合成达到抗病毒作用,通过诱导细胞凋亡和自噬来达到抗肿瘤及调节细胞损伤修复和自身免疫等作用[2]。目前,根据作用方式和特性的不同可将干扰素分为Ⅰ、Ⅱ、Ⅲ三型,其中Ⅰ型干扰素成员最多,具有较强的抗病毒作用,包括IFN-α、IFN-β、IFN-δ、IFN-ζ、IFN-ε、IFN-ν、IFN-κ、IFN-τ、IFN-ω等[3];Ⅱ型干扰素只有1种成员,即IFN-γ,IFN-γ是通过激活髓样细胞以消除病原体的细胞因子,主要受抗原提呈细胞(antigen-presenting cells,APC)分泌的细胞因子IL-12和IL-18的控制,这些细胞因子在先天免疫反应中刺激IFN-γ的产生[4],虽然IFN-γ仅由免疫细胞产生,但几乎对所有类型的细胞都有作用[5],尤其在调节免疫功能以及桥接先天性和获得性免疫中发挥重要作用[6,7];Ⅲ型干扰素是近些年来新发现的细胞因子,主要为IFN-λ1、IFN-λ2、IFN-λ3,分别被称为IL-29、IL-28A、IL-28B,此外还有在人体中发现的IFN-λ4[8]。
Ⅲ型干扰素(IFN-λs)在系统发生上与Ⅰ型干扰素和IL-10关系密切,并可与IL-10、IL-22和IL-26相同的受体(IL-10R2)相结合[9]。其另外一个特异性受体分子为IFN-λR1,IFN-λR1主要是在上皮细胞中表达,故IFN-λs曾被认为是上皮细胞因子,在粘膜部位发挥抗病毒等生物学功能[10]。然而,现在越来越多的研究发现IFN-λs在免疫应答调节中发挥着关键作用。免疫细胞(如中性粒细胞和树突细胞)对IFN-λs有反应,IFN-λs可通过刺激中性粒细胞导致Janus激酶/信号转导和转录激活子(Janus kinase/signal transducer and activator of transcription,JAK-STAT)通路激活和STAT1磷酸化而显示出抗炎功能[11~13];而利用IFN-λs刺激树突细胞,能够激活JAK-STAT通路和上调干扰素诱导基因产物的转录,从而刺激其产生Ⅰ型IFN并诱导肿瘤坏死因子(tumor necrosis factor,TNF)的表达,对抗肿瘤具有重要意义[14]。此外,IFN-λs与受体结合后,也可激活JAK-STAT通路,从而上调多达数百种干扰素刺激基因(interferon-stimulated genes,ISGs)的转录和表达,通过复杂的正负反馈机制调节免疫功能[15]。最近研究表明,IFN-λs对中性粒细胞的作用可以在真菌感染期间保护宿主,显示了其抗真菌的能力[16];IFN-λs刺激的树突状细胞仍然能够在脂多糖(lipopolysaccharide,LPS)刺激下上调转录因子T-bet并产生更高水平的IL-12[17]。
羊的干扰素可抑制水泡性口炎病毒、羊的慢病毒等,近来研究发现其对口蹄疫病毒也具有较好的抗病毒活性[18]。羊的干扰素还对繁殖和内分泌起到重要作用,可调节子宫内膜的雌激素、催产素等激素的受体[19],而且其还可作用于母体子宫内膜以防止黄体溶解因子前列腺素F2α的释放,预防黄体退化,确保妊娠的持续[20]。
杆状病毒表达系统是一种高效节时的真核表达系统,Arslan等[21]将杆状病毒表达系统表达的鸡IFN-λ3作用于鸡胚细胞后,重要的免疫基因和抗病毒信号通路均有所上调,显示出其抗病毒的潜力。本实验室在之前的研究中构建了一种失活拯救型家蚕杆状病毒穿梭载体reBmBac,其缺失复制必需基因ORF1629,使其获得重组病毒的效率几乎高达100%[22]。本实验室利用此系统已经多次成功高效表达出具有生物活性的外源蛋白,如赵璐璐等[23]使用家蚕杆状病毒表达系统表达出牛IFN-λ3,检测其抗水泡性口炎病毒(vesicular stomatitis virus,VSV)活性为(8.1±0.52)×105U/mL。本研究中选用家蚕作为生物反应器来表达目的蛋白——羊λ3干扰素(OvIFN-λ3),在羊细胞系中检测其抗病毒活性并筛选纯化,以期为羊的抗病手段提供新思路。
1 材料与方法
1.1 实验材料
实验用家蚕为江苏科技大学蚕业研究所提供的JY1品种;OvIFN-λ3基因由南京金斯瑞生物科技有限公司合成;大肠杆菌感受态Top10、杆状病毒转移载体pVL1393、失活拯救型穿梭质粒、家蚕卵巢传代细胞(Bm-N)、羊肾上皮细胞和重组表达绿色荧光蛋白的水疱型口炎病毒(VSV-GFP)均由本实验室传代、保存。高保真DNA聚合酶和HiScript Ⅱ 1st Strand cDNA Synthesis Kit(+ gDNA wiper)购自南京诺唯赞生物科技有限公司;昆虫细胞培养基(TC-100)购自德国AppliChem公司;哺乳动物细胞培养基和胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司。
1.2 实验方法
1.2.1OvIFN-λ3的优化和合成 首先,查找Genbank公布的羊λ3干扰素的氨基酸序列,在得到的多条结果中用序列比对软件进行比对,选择共有序列,最终确定登录号为XP_014962163.1的氨基酸序列。将此序列在不改变氨基酸的前提下根据家蚕密码子的偏好性进行优化,替换易使mRNA形成发夹结构的密码子,提高密码子适应指数(codon adaptation index,CAI),调整GC含量,去除常用酶切位点后,在两端分别加入BamHⅠ和EcoRⅠ酶切位点,在起始密码子ATG前加入Kozak序列(AAC)。交由南京金斯瑞生物科技有限公司使用化学合成法合成优化后的基因,将此基因命名为OvIFN-λ3。
1.2.2转移载体pVL1393-OvIFN-λ3的构建 合成的优化基因已经构建在pUC57载体上,用BamHⅠ和EcoRⅠ内切酶将目的基因片段剪切下来后进行琼脂糖凝胶电泳,胶回收,将回收下来的片段与已用BamHⅠ和EcoRⅠ内切酶切好的pVL1393载体片段在T4 DNA连接酶的催化下于22℃连接3 h。再将连接产物转化至大肠杆菌Top10感受态内,在氨苄固体选择培养基中挑选出单克隆,经BamHⅠ和EcoRⅠ双酶切鉴定连接成功后,命名为转移载体pVL1393-OvIFN-λ3。
1.2.3重组病毒的获得及其在家蚕中的表达
将转移载体pVL1393-OvIFN-λ3与本实验室构建的失活拯救型家蚕杆状病毒穿梭载体reBmBac DNA在脂质体的介导下共转染家蚕卵巢传代细胞Bm-N,27℃培养4~5 d后收集细胞培养液,离心取上清,进行PCR鉴定,根据目的基因来设计引物,上游引物序列为5′-ATGGCTCCTGGCTGCACCTTGGT-3′,下游引物序列为5′-TTAAACACACTGATCTCCGCTA-3′。PCR反应体系(共50 μL)为:模板1 μL,上、下游引物各1 μL,10 μmol/L dNTP 1 μL,10×Buffer 5 μL,DNA聚合酶 1 μL,水 40 μL。PCR程序为:95℃ 5 min;95℃ 30 s,58℃ 30 s,72℃ 30 s,共30个循环;72℃ 10 min。经PCR验证后得到含OvIFN-λ3基因片段的重组病毒液。将病毒液按照105pfu/头的含量注射5龄起家蚕,同时设置阴性对照组,再培养4~5 d后,根据家蚕发病情况收集蚕血淋巴,于-20℃保存。
1.2.4蚕血淋巴基因组DNA的提取 取100 μL蚕血淋巴于EP管中,加入等体积的1 mol/L NaOH,摇匀后室温放置5 min,再加入20 μL 10 mol/L NH4AC,混匀后室温放置5 min,终止碱液反应。随后,加入饱和酚/氯仿/异戊醇(25∶24∶1)混合溶液,摇匀后静置10 min,4℃、12 000 r/min离心10 min,取上清置于新管中,用2.5倍乙醇沉淀核酸,4℃、12 000 r/min离心10 min后弃上清,再用-20℃预冷的75%乙醇清洗沉淀,4℃、12 000 r/min离心10 min,弃上清后将沉淀烘干,溶于50 μL TE溶液中,置于-20℃保存。
1.2.5蚕血淋巴RNA的提取和反转录 取100 μL蚕血淋巴于EP管中,加入1 mL Trizol,混匀后室温放置5 min,再加入200 μL氯仿,剧烈震荡后静置3 min,4℃、12 000 r/min离心15 min后取上层水相移入新EP管,加入等体积异丙醇,摇匀后冰浴5 min,4℃、12 000 r/min离心10 min后弃上清,用-20℃预冷的75%乙醇清洗沉淀后7 500 r/min离心5 min,弃上清后将沉淀烘干,溶于50 μL DEPC水中。经琼脂糖凝胶电泳查看RNA状态良好后使用微量分光光度计测定其浓度,使用HiScript Ⅱ 1st Strand cDNA Synthesis Kit试剂盒,并参照说明书进行反转录,将产物置于-20℃保存。
1.2.6OvIFN-λ3重组病毒的构建及其感染和转录的PCR鉴定 分别以1.2.4和1.2.5获得的基因组DNA和反转录产物为模板,PCR反应体系和程序同1.2.3。
1.2.7表达产物抗病毒活性检测 用PBS将1.2.3中收集的蚕血淋巴稀释10倍后使用超声破碎仪破碎细胞,12 000 r/min离心10 min后取上清,经0.22 μm膜过滤后分装待用。采用微量细胞病变抑制法测定干扰素表达产物的抗病毒活性[24],在羊肾细胞中检测其对VSV-GFP的抗病毒作用,使用Reed-muench方法来计算其效价。首先将羊肾细胞按照105个/mL的浓度铺在96孔板(100 μL/孔)上,在37℃、5% CO2浓度的培养箱中培养24 h,将上述分装的干扰素样品稀释1 000倍后,按照3倍梯度稀释于96孔板中,每孔100 μL体积,设置7个稀释度,每个稀释度设置8个复孔为1列,另设1列病毒对照和1列细胞对照。再培养24 h后用100TCID50的VSV-GFP病毒攻毒,约24 h后根据绿色荧光观察细胞发病情况,计算效价。
1.2.8空斑筛选法筛选重组病毒 将Bm-N细胞接种于35 mm的细胞培养皿中,27℃培养1 d后,用无血清的TC-100培养基将1.2.3中获得的共转染产物(含重组病毒的上清)稀释104倍,取1 mL稀释液加入到培养皿中;置于27℃昆虫培养箱中培养1 h后取出,弃上清;加入半固体培养基(含10%胎牛血清和1%低熔点凝胶)培养基,于27℃培养4~6 d,在解剖镜下观察病毒感染细胞后所产生的细胞空斑,挑选24个空斑并编号后收集病毒。此过程相当于纯化病毒,1个细胞空斑内的所有病毒都来源于同一个亲本。将Bm-N细胞均匀铺在24孔板中,分别接种所收集到的病毒,27℃培养4~6 d后,收集各孔上清,获得24个毒株,将其分别注射家蚕,待家蚕发病后收集蚕血淋巴进行抗病毒活性检测。
2 结果与分析
2.1 重组病毒的构建及其感染、转录的PCR鉴定
用BamHⅠ和EcoRⅠ将构建好的载体pVL1393-OvIFN-λ3进行双酶切鉴定,随后经1%琼脂糖核酸电泳分离出2条带(图1A),目的基因的大小为591 bp,pVL1393载体大小为9 607 bp,电泳结果与预期一致。将酶切验证正确的质粒交由公司测序,返回结果经MEGA比对基因序列后显示完全一致,证明转移载体pVL1393-OvIFN-λ3构建成功。
提取蚕血淋巴基因组后,通过PCR验证目的基因重组病毒的构建及其感染、转录的情况。目的基因的大小为591 bp,PCR成功扩增且大小与其相符(图1B),将条带胶回收后交由公司测序,返回结果显示目的基因已成功重组并感染家蚕。以蚕血淋巴RNA反转录后得到的cDNA产物为模板,同样用上述引物进行PCR鉴定,得到的产物经琼脂糖凝胶电泳鉴定大小相符(图1C)后送测序,返回结果显示其已在家蚕中进行转录。
2.2 抗病毒活性检测
利用微量细胞病变抑制法检测OvIFN-λ3的抗病毒活性。GFP的吸收峰在495 nm左右,使用荧光显微镜在紫外光波段下观察细胞,有绿色荧光出现表示病毒感染细胞并大量复制。攻毒次日每2 h观察1次,待病毒对照组的8个复孔均出现绿色荧光时开始记录。结果(图2)显示,高浓度的干扰素能够完全抑制病毒感染和复制,无绿色荧光出现;随着稀释度的提升,干扰素对细胞的保护作用降低,个别孔开始出现绿色荧光;细胞对照组的细胞状态良好,无绿色荧光出现。根据不同稀释度出现绿色荧光的孔数来反映干扰素对细
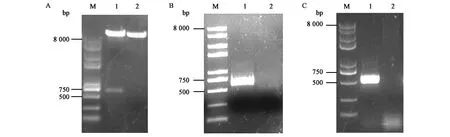
图1 pVL1393-OvIFN-λ3重组质粒酶切鉴定(A)和重组病毒感染家蚕(B)并在家蚕中转录(C)Fig.1 Restriction enzyme analysis of recombinant transfer vector pVL1393-OvIFN-λ3 (A) and the infection (B) and transcription (C) of recombinant baculovirus.注:A:M: DNA marker,1:pVL1393-OvIFN-λ3重组质粒双酶切产物,2:阴性对照(pVL1393载体);B:M:DNA marker,1:以样品蚕血基因组为模板的PCR产物,2:对照蚕血的基因组为模板的PCR产物;C:M:DNA marker,1:以cDNA为模板的PCR产物,2:以提取的RNA为模板的PCR产物。

图2 羊肾细胞感染VSV-GFP后发病情况Fig.2 The morbidity of Ovis aries kindly cells infected with VSV-GFP.A:高浓度干扰素完全抑制VSV复制;B:低浓度干扰素对细胞部分保护;C:病毒对照组;D:细胞对照。
胞的保护作用,若某一孔出现绿色荧光,则在对应表格上记为+,否则记为-,结果如表1所示,使用Reed-Muench方法计算其效价,并进行重复实验后计算其结果为(6.5±0.27)×105U/mL血淋巴。
2.3 重组病毒的筛选
将筛选纯化后得到的24个重组病毒分别感染5龄起家蚕幼虫,待发病后收集血淋巴进行抗病毒活性检测,测定结果如图3所示,0号为未筛选的共转染产物直接感染家蚕后的蚕血淋巴效价,为(6.5±0.27)×105U/mL血淋巴,而筛选的24个样品中,6号效价最高,为(3.1±0.42)×106U/mL血淋巴。
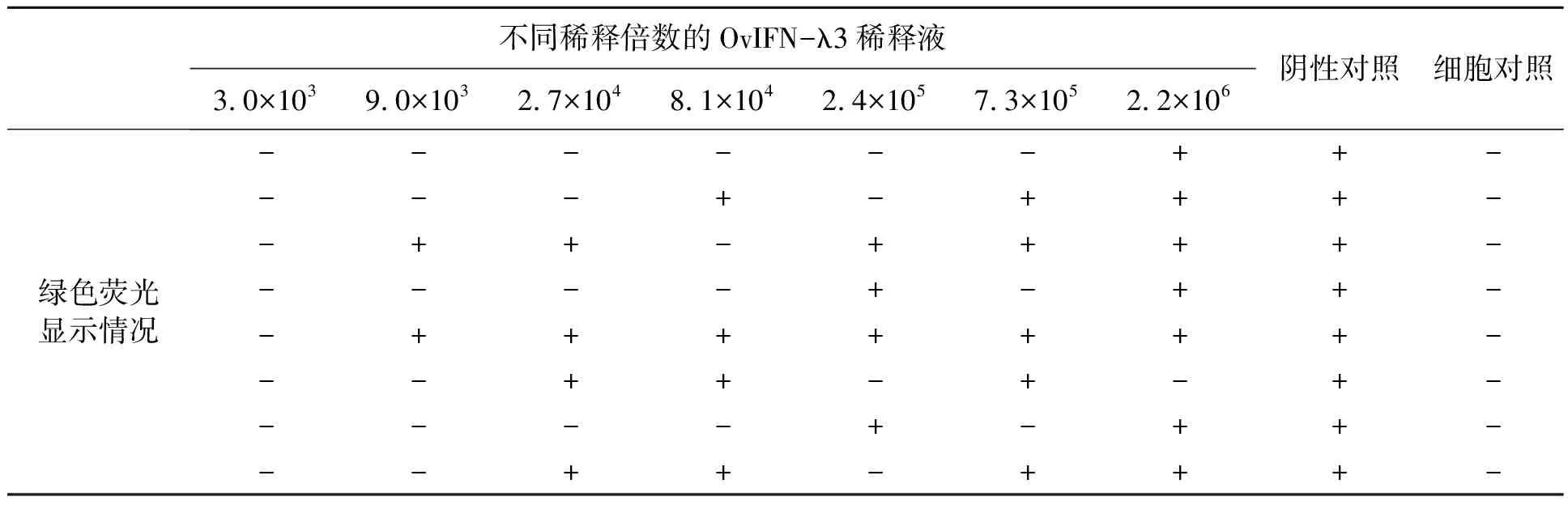
表1 家蚕幼虫血淋巴中OvIFN-λ3的抗病毒活性Table 1 Antiviral activity assays of recombinant OvIFN-λ3 in haemolymph of silkworm larvae.
注:“-”表示无绿色荧光;“+”表示有细胞显示绿色荧光;阴性对照:羊肾细胞+VSV-GFP;细胞对照:仅羊肾细胞。
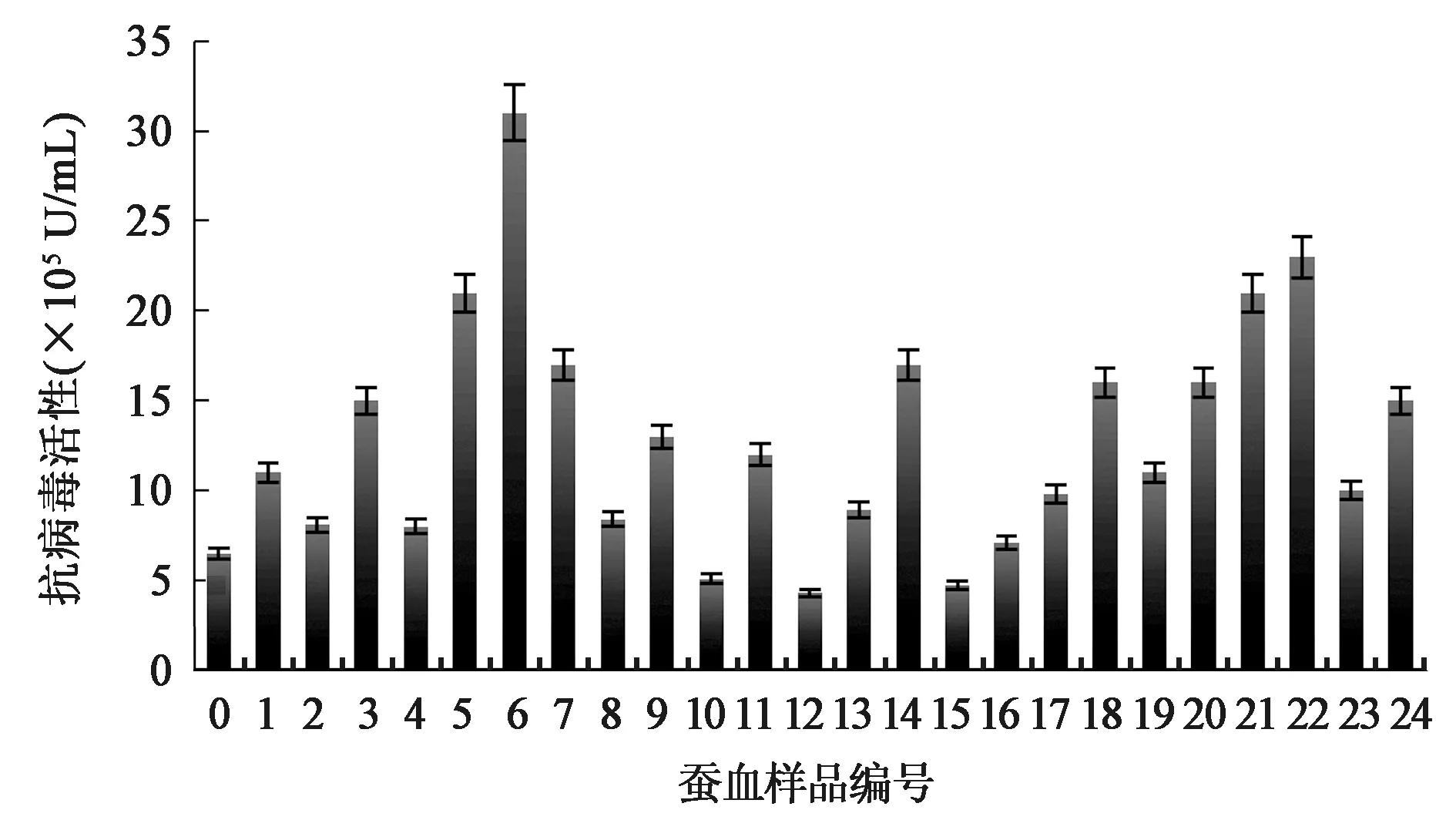
图3 不同重组病毒表达OvIFN-λ3的活性测定Fig.3 Antiviral activity assay of OvIFN-λ3 expressed by recombinant baculovirus.注:0:未筛选的共转染产物;1~24:筛选的24个样品。
3 讨论
本研究成功利用家蚕杆状病毒表达系统高效表达出具有生物学活性的羊λ3干扰素。该系统中杆状病毒的复制必需基因ORF1629的删除使得共转染过程中的重组率理论上为100%,其含诱导型大肠杆菌复制子,可在大肠杆菌中操作,易进行进一步的改良;同时,杆状病毒本身基因组较大,可携带较大片段外源基因,并且敲除了病毒基因组中降解外源基因的蛋白酶基因和几丁质酶基因。此外,该系统在表达出外源蛋白后会对其进行一系列加工修饰过程,如糖基化、乙酰化等,比较适用于真核蛋白的表达,有利于其形成类似天然蛋白的高级结构,提高生物学活性。相对于其他表达系统,家蚕杆状病毒表达系统表达量更高,可批量表达,且杆状病毒不能在脊椎动物中复制,对脊椎动物无害,生物安全性较好,使得其在生产上具有重要意义。因而,使用杆状病毒表达系统表达羊的干扰素具有表达量高、抗病毒活性好的优点,如邵丽萍等[25]使用家蚕杆状病毒表达出羊IFN-γ,对产物进行抗VSV活性检测,结果显示其效价可达1.6×106U/mL。本研究利用家蚕杆状病毒表达系统表达出羊λ3干扰素,初始效价为(6.5±0.27)×105U/mL,随后利用空斑筛选法筛选重组病毒,感染家蚕后,测定其效价最高可达(3.1±0.42)×106U/mL。
由于密码子具有简并性,不同物种密码子的偏好性也不同,密码子偏好性优化是提高异源蛋白表达量的有效方式[26]。因此,得到OvIFN-λ3基因序列后,在不改变氨基酸序列的前提下,根据家蚕的密码子偏好性对其进行优化,提高CAI值,调整GC含量;另外,删除了原有序列中的一些常用酶切位点,并在序列两端加上酶切位点;还在起始密码子前加上Kozak序列,其可与翻译起始因子结合而介导含有5′帽子结构的mRNA翻译起始,从而提高目的蛋白的表达量[14]。微量细胞病变抑制法是测定干扰素活性的常用方法,在本研究中采用VSV-GFP病毒系统攻毒,可根据绿色荧光蛋白的表达情况反映干扰素对细胞的保护作用,避免了细胞状态、主观判断等因素对实验结果的影响,多次重复试验后,OvIFN-λ3的抗病毒效价基本平稳,可达到(3.1±0.42)×106U/mL血淋巴。
羊的养殖是畜牧业中重要的一环,而口蹄疫、羊痘、寄生虫等疾病常常威胁着羊的养殖。一般抗生素等药物具有药物残留等缺点,而干扰素的安全性是其他药物所没有的,其所具有的抗病毒、抗寄生虫等潜力对于羊病的预防与治疗有一定的积极意义。本研究为利用杆状病毒表达系统大批量生产廉价的干扰素制剂提供了可能,也为羊干扰素应用于生产疫苗、抗体等生物制品提供了理论依据。未来,可将不同干扰素混合使用,相比单一干扰素,其抗病毒等能力可能会有所提高。
