磷酸化对UCHL3体外去泛素化酶活性的影响
2019-10-14任禹静梅子青
丁 珊, 任禹静,2, 姜 凌, 梅子青*
1.中国农业科学院生物技术研究所, 北京 100081;2.北京理工大学生命学院, 北京 100081
泛素化修饰是指通过泛素激活酶(ubiquitin-activating enzyme,E1)、泛素结合酶(ubiquitin-conjugating enzyme,E2)以及泛素连接酶(ubiquitin-protein ligase,E3)等一系列酶促级联反应将靶点底物蛋白通过其上赖氨酸的侧链氨基与泛素分子C末端甘氨酸(Gly76)以异肽键相连而被共价修饰的过程[1]。泛素化修饰是真核细胞内重要的蛋白质翻译后修饰方式,几乎在所有生命活动中都发挥着重要作用,如蛋白质的降解、信号转导以及DNA损伤修复等[2~4]。由于泛素分子具有自由的氨基,其N端甲硫氨酸和7个赖氨酸(M1、K6、K11、K27、K29、K33、K48、K63)均可与其他参与泛素链形成的泛素蛋白分子上的Gly76的羧基缩合形成肽键/异肽键,进而形成链接类型更为复杂的多聚泛素链。众多研究已表明,不同链接类型的泛素链会介导底物蛋白参与不同的生命过程[5,6]。
与E1-E2-E3负责的泛素化过程相反,去泛素化是泛素化修饰的逆过程,由去泛素化酶负责完成[7~9]。真核细胞的去泛素化酶(deubiquitinating enzymes,DUBs)主要包含6个家族:泛素特异性加工酶(ubiquitin-specific processing proteases,USPs)家族、UCH家族、卵巢肿瘤蛋白酶(ovarian tumour proteases,OTUs)家族、Jab1/Pab/MPN结构域金属酶(Jad1/Pad/MPN domain containing metallo-enzymes,JAMM)家族、马查多-约瑟夫病相关酶(Machado-Joseph disease related enzymes,MJD)家族和单核细胞趋化蛋白1诱导蛋白(monocyte chemotactic protein-induced protein,MCPIP)家族。UCHL3蛋白是UCH家族的重要成员,其可催化Ⅰ型干扰素受体的去泛素化,从而调控Ⅰ型干扰素介导的抗病毒作用[10]。研究表明,UCHL3在成骨细胞中过表达,可对信号转导蛋白Smad(drosophila mothers against decapentaplegic protein)家族中的Smad1进行去泛素化调控[11]。另有研究报道,UCHL3在乳腺癌细胞内高表达[12],是乳腺癌细胞对放疗和化疗产生抗性的根源[13],因而,近年来,靶向抑制UCHL3蛋白已成为乳腺癌治疗的新思路。此外,UCHL3被发现可通过对RAD51(DNA repair protein RAD51 homolog 1,DNA双链断裂修复蛋白)进行去泛素化,参与DNA损伤修复调节[13];其还可通过对TDP1(tyrosyl DNA phosphodiesterase l,调控修复拓扑异构酶介导的染色体断裂的关键蛋白)去泛素化,调控染色质断裂修复[14]。
在相当长时间内,UCHL3一直被认为只能对单泛素及其缀合物、或者泛素结合酶与泛素的复合物进行切割,而不能对泛素链进行切割[15,16]。2016年,Luo等[13]首次发现UCHL3上Ser75发生磷酸化后,可对底物RAD51多聚泛素链进行切割,但是,这项研究均为体内实验结果,磷酸化赋予UCHL3切割多聚泛素链活性的结论尚缺少体外实验证据的支持。
基于此,本研究利用点突变方法将UCHL3上的Ser75突变成Glu,实现模拟磷酸化修饰,并使用亲和层析、离子交换层析及凝胶过滤层析等多种纯化技术,在大肠杆菌中异源重组表达并纯化到了性质均一的野生型UCHL3(UCHL3WT)和模拟磷酸化的UCHL3蛋白(UCHL3S75E),进而在体外生化水平上研究磷酸化对UCHL3的泛素链切割活性的影响,以期为深入了解其受翻译后修饰调控的分子机制奠定基础。
1 材料与方法
1.1 实验材料
质粒pET-28a_UCHL3WT为本实验室保存;DH5α感受态细胞、BL21(DE3)感受态细胞购于北京全式金生物技术有限公司。
Q5 DNA聚合酶、DpnⅠ酶均购于美国NEB公司;牛血清白蛋白购自北京信科奥达科技有限公司;鸡卵清白蛋白购自美国Sigma公司;苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)购自美国Thermo Fisher Scientific公司;Bradford试剂购自美国Bio-Rad公司。Ub-AMC和K27、K48以及K63链接类型二泛素(K27 diub、K48 diub、K63 diub)均为清华大学刘磊教授实验室赠送。其他主要试剂均购于美国Sigma公司。
HitrapQ层析柱、Superdex 200凝胶过滤层析柱均购自美国GE医疗公司。
1.2 实验方法
1.2.1基因克隆 研究所用目的基因来源于人源cDNA,在本实验室已有的pET28a_UCHL3质粒的基础上,利用QuikChange定点诱变技术构建点突变质粒,将Ser75突变为Glu[17]。设计上游引物为:5′-GAAAAAATAAAAgagCAGGGACA-AGATGTTACATC-3′,下游引物为:5′-gaaTTTTATT-TTTTCTTCCTCTTCTGTTC-3′(小写部分为突变位点)。引物由华大基因公司进行合成。PCR反应体系(共20 μL)为:野生型UCHL3质粒模板0.4 μL,上、下游引物各0.4 μL,5×Q5缓冲液4 μL,5×Q5 Enhancer 4 μL,dNTP 1.6 μL, Q5 DNA聚合酶0.2 μL,灭过菌的去离子水9 μL。PCR反应程序为:95℃ 10 min;95℃ 30 s,58℃退火30 s,72℃延伸3 min,共25个循环;72℃延伸5 min。PCR产物经琼脂糖凝胶电泳验证后,使用DpnⅠ酶在37℃酶切消化3 h。随后,将消化产物转化进DH5α感受态细胞中,并涂布于含卡那霉素的LB平板,37℃过夜培养,挑取单克隆,送至华大基因公司进行测序,将成功构建的pET28a_UCHL3S75E质粒于-20℃保存备用。
1.2.2蛋白表达与纯化 将pET28a_UCHL3S75E质粒转化进BL21(DE3)感受态细胞后,接入50 mL LB液体培养基中,37℃、220 r/min摇床培养3~4 h。随后转接至1 L LB液体培养基中进行扩大培养(37℃、220 r/min);待菌体生长至OD600=1.0时,加入异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)至终浓度为0.2 mmol/L,于22℃诱导培养12~16 h。pET28a_UCHL3WT质粒诱导表达的方法同pET28a_UCHL3S75E质粒。
分别将诱导培养的菌液在4℃、4 000 r/min条件下离心15 min,收集菌体后,用Lysis Buffer(25 mmol/L的pH 8.0 Tris、150 mmol/L NaCl)重悬,并加入0.3 mmol/L PMSF,超声破碎(600 W功率下超声3 s,停止9 s,总共超声30 min)。在4℃、13 000 r/min条件下离心50 min去除沉淀后,利用镍柱进行亲和层析纯化,使离心所得上清液与柱料充分结合后,用25 mmol/L的pH 8.0 Tris、500 mmol/L NaCl进行第1次清洗(W1),再用25 mmol/L的pH 8.0 Tris、10 mmol/L咪唑进行第1次洗脱(E1),最后用25 mmol/L的pH 8.0 Tris、150 mmol/L咪唑进行二次洗脱(E2)。选择较好的洗脱液进行下一步阴离子交换层析HitrapQ以及凝胶过滤层析Superdex 200纯化,最终得到高纯度、高质量的目的蛋白。
1.2.3利用Bradford法测定蛋白浓度 配制不同浓度梯度的牛血清白蛋白(包括0.125 mg/mL、0.25 mg/mL、0.375 mg/mL以及0.5 mg/mL);分别取10 μL各浓度梯度的牛血清白蛋白,加入1 mL Bradford试剂中,检测OD595读值;重复3次,并取平均值,进而制作牛血清白蛋白浓度对OD595的标准曲线。另取1 mL Bradford试剂,加入10 μL稀释后的UCHL3WT或UCHL3S75E蛋白,进行OD595数据测定,并利用标准曲线分别计算UCHL3WT以及UCHL3S75E的蛋白浓度。
1.2.4Ub-AMC切割活性实验 参照Lee等[18]的方法,利用Ub-AMC切割活性实验来验证模拟磷酸化对UCHL3蛋白功能的影响。向包含50 mmol/L Tris-HCl(pH 7.5)、1 mmol/L乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、1 mg/mL鸡卵清白蛋白、5 mmol/L ATP/MgCl2、1 mmol/L二硫苏糖醇(dithiothreitol,DTT)的反应体系中分别加入浓度为5 nmol/L的UCHL3WT和UCHL3S75E蛋白,再加入65 μmol/L Ub-AMC来启动反应。Ub-AMC的水解活性主要通过Synergy HT多功能酶标仪(美国BioTek公司)在Ex360/Em460处进行实时检测。每30 s记录1次荧光强度,共记录15 min。每个实验重复3次,并计算平均值。
1.2.53种不同链接类型二泛素的切割活性实验
基于此前对UCHL3与二泛素的相互作用力的测定结果[19],选择3种不同链接类型的二泛素(K27 diub、K48 diub、K63 diub)作为底物,来进行比较UCHL3WT与UCHL3S75E(4 μmol/L)的二泛素切割活性实验。同时,选择OTUD2(一种去泛素化酶)作为阳性对照。在25 mmol/L的pH 8.0 Tris、150 mmol/L NaCl反应体系中进行反应。分别加入3种酶(OTUD2、UCHL3WT、UCHL3S75E)启动反应,在不同时间点(0 min、120 min,UCHL3S75E实验组还包括60 min)取样,最后通过SDS-PAGE来检验切割活性。
1.2.6UCH家族多序列比对及系统发育树构建
利用Uniprot网站(https://www.uniprot.org/)查找UCH家族中成员(UCHL3、UCHL1、UCHL5和BAP1)的蛋白质序列,使用DNAMAN软件进行多序列比对,使用MEGA-X软件构建系统发育树。
利用NCBI网站BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)查找UCHL3在不同物种中的同源蛋白(包括小鼠Musmusculus、果蝇Drosophilanavojoa、水稻Oryzasativa、玉米Zeamays以及拟南芥Arabidopsisthaliana),使用DNAMAN进行多序列比对,使用MEGA-X软件构建系统发育树。
2 结果与分析
2.1 UCHL3S75E质粒的构建
为了获得模拟磷酸化的UCHL3蛋白,通过QuikChange定点诱变技术构建pET-28a_UCHL3S75E质粒。如图1所示,目的条带在5 000 bp~10 000 bp之间,与预测分子量(6 062 bp)基本相符。同时,测序结果显示本研究克隆的UCHL3S75E基因序列完全正确。
2.2 UCHL3WT和UCHL3S75E蛋白的纯化
为了获得高纯度、高质量的UCHL3WT和UCHL3S75E蛋白,利用大肠杆菌BL21(DE3)对其进行表达并尝试利用多种层析技术进行纯化。如图2所示,经过亲和层析、离子交换层析和凝胶过滤层析多步纯化,UCHL3WT蛋白的纯度超过90%(图2A),在Superdex 200的洗脱体积为16.5 mL左右,对应分子量大小正确。SDS-PAGE显示其分子量在21~33 kDa,与目的蛋白的预测分子量26 kDa相一致。图3为UCHL3S75E蛋白的纯化结果,表明其纯度、洗脱体积和分子量与UCHL3WT类似。
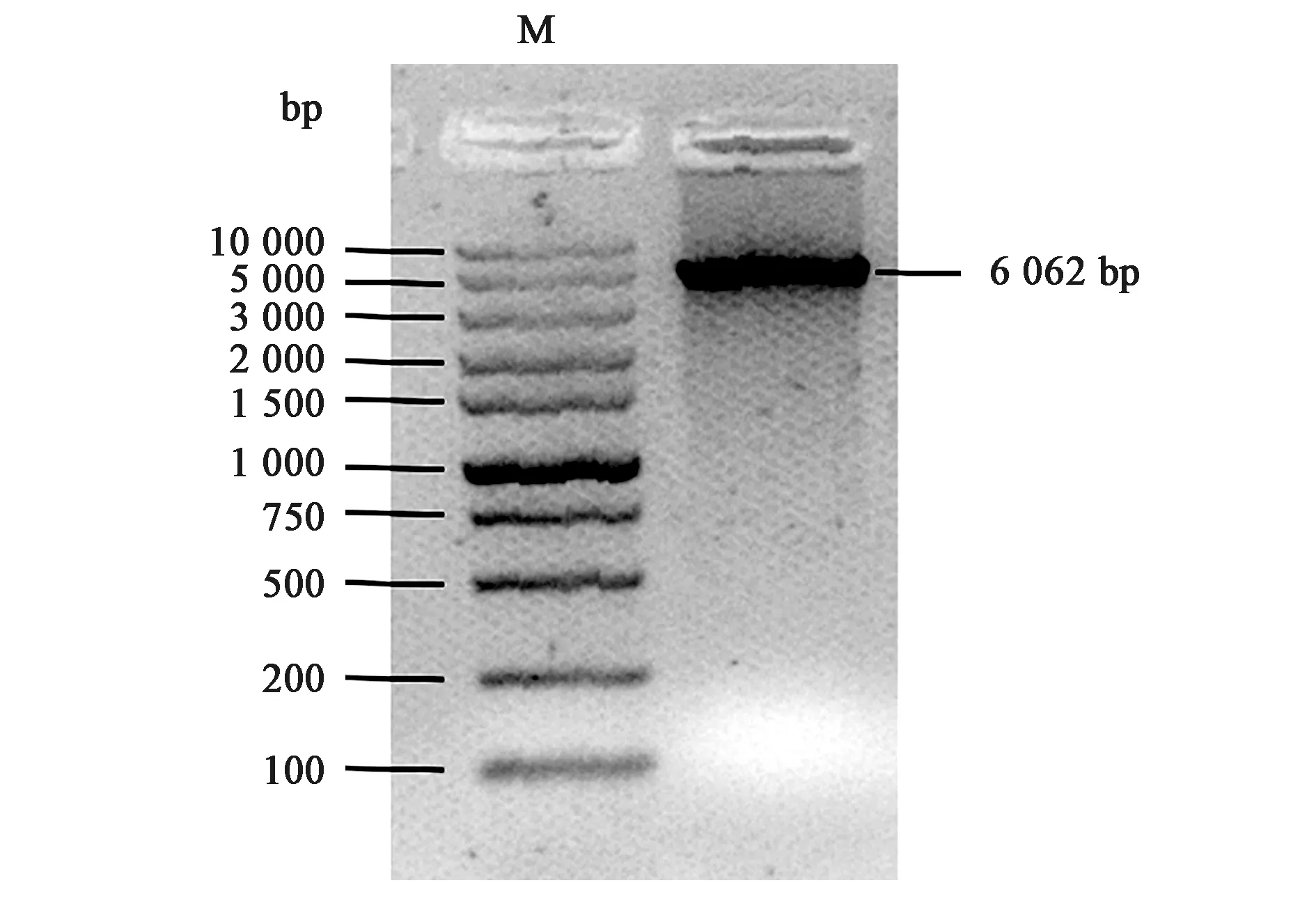
图1 pET-28a_UCHL3S75E(6 062 bp)PCR鉴定Fig.1 The PCR identification of pET-28a_UCHL3S75E(6 062 bp).
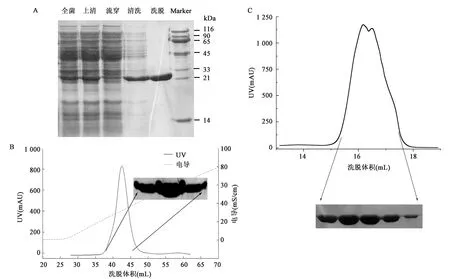
图2 UCHL3WT蛋白纯化结果Fig.2 The purification of UCHL3WT protein.注:A: UCHL3WT 亲和层析纯化结果以及SDS-PAGE鉴定;B: UCHL3WT Hitrap Q阴离子交换层析及SDS-PAGE鉴定;C: UCHL3WT SD 200凝胶过滤层析纯化及SDS-PAGE鉴定。
2.3 蛋白浓度测定
为了获得准确的蛋白浓度,测定并拟合了蛋白浓度测定标准曲线,并根据拟合曲线以及蛋白稀释倍数计算得到待测蛋白浓度。其中,UCHL3WT为2.8 mg/mL(16.8 μmol/L)、UCHL3S75E为2.4 mg/mL(14.5 μmol/L)。
2.4 磷酸化对Ub-AMC切割活性的影响
为了理解磷酸化对UCHL3活性影响,对UCHL3切割Ub-AMC的活性进行了分析。如图4A所示,相比于UCHL3WT蛋白,模拟磷酸化的UCHL3S75E切割Ub-AMC的活性明显升高。经Origin软件分析可知,在同等酶量以及底物浓度条件下,UCHL3S75E的切割活性比UCHL3WT提高了70%。
2.5 磷酸化对二泛素切割活性的影响
为了探索磷酸化对UCHL3切割二泛素活性的影响,采用不同链接类型的二泛素作为底物,进行了相关的酶切活性实验。如图4B、4C和4D所示,作为阴性对照,单独的K27、K48以及K63等链接类型二泛素在不加酶的体系中保持不变;作为阳性对照,OTUD2可对上述3种类型二泛素实现有效切割。相比之下,UCHL3WT对上述3种二泛素均不具备切割活性,模拟磷酸化的UCHL3S75E对K27、K48链接类型二泛素也不具备切割活性,但对K63链接类型二泛素展现出微弱的切割活性,不过此活性远远小于生理水平切割活性。
2.6 UCH家族多序列比对以及系统发育树分析
为了验证该种磷酸化调控机制在UCH家族中的保守程度,进行了相应的多序列比对以及系统发育树分析。如图5A所示,磷酸化位点Ser75仅存在于UCHL3中,在UCH家族其他3个成员中均不保守,即便是在与其亲缘关系最为接近的UCHL1中也不保守(图5A、5B)。随后,为了验证该种磷酸化调控机制在不同物种中的保守程度,进行了不同物种中UCHL3同源蛋白的多序列比对以及系统发育树分析(图5C、5D)。结果显示,Ser75位点在小鼠、果蝇、水稻和玉米中均保守存在,仅在拟南芥中突变成了Glu(图5C)。而由系统发育树可知,人源UCHL3与小鼠中UCHL3亲缘关系较近,而水稻和玉米中UCHL3蛋白亲缘关系较近,模式生物果蝇以及拟南芥与其他物种中UCHL3蛋白亲缘关系较远(图5D)。
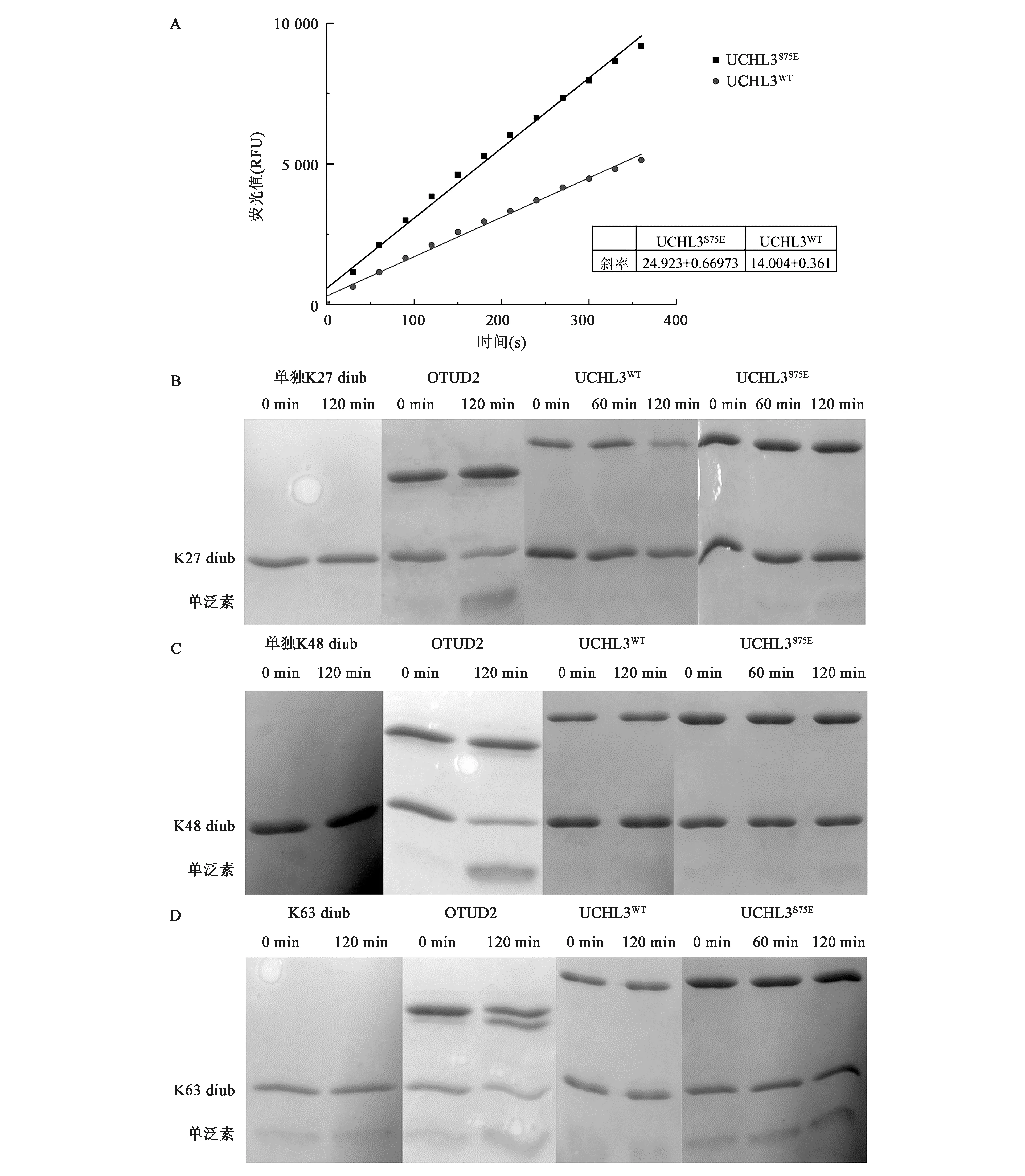
图4 UCHL3S75E 以及UCHL3WT酶对Ub-AMC以及不同类型二泛素分子的切割活性反应Fig.4 The cleavage activity of UCHL3WT and UCHL3S75E towards Ub-AMC and different types of ubiquitin-linked chains.注:A: 5 nmol/L浓度下,UCHL3S75E 以及UCHL3WT对Ub-AMC的酶切反应及速率分析;B: UCHL3S75E 以及UCHL3WT对K27链接类型二泛素酶切反应的SDS-PAGE检测结果;C: UCHL3S75E 以及UCHL3WT对K48链接类型二泛素酶切反应的SDS-PAGE检测结果;D: UCHL3S75E以及UCHL3WT对K63链接类型二泛素酶切反应的SDS-PAGE检测结果。
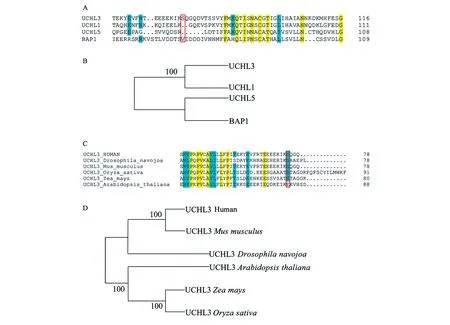
图5 UCH家族成员以及不同物种UCHL3序列对比及系统发育树构建Fig.5 Sequence alignment and phylogenetic trees of UCH family and UCHL3 sequence of different species.注:A: UCH家族成员成员多序列比对结果,其中黄色代表4种蛋白中保守度为100%的氨基酸;青色代表保守度大于75%的氨基酸;红色框代表UCHL3中磷酸化位点Ser75及其在其他家族成员中对应的氨基酸。B: UCH家族系统发育树。C: 不同种属来源的UCHL3之间序列对比。D: 不同种属来源的UCHL3系统发育树构建。
3 讨论
作为UCH家族的重要成员,去泛素化酶UCHL3参与了DNA损伤修复[13]、染色质断裂[20]以及成骨细胞分化[11]等众多重要生命过程。在被发现后的很长时间内,UCHL3一直被认为只能对单泛素及其缀合物,或者泛素结合酶与泛素的复合物进行切割,而不能对泛素链进行切割[15,16]。但近期的一些研究显示,UCHL3在细胞内可对Smad1、Rad51等底物上的多聚泛素链进行切割[10,13,21],尤其是受到磷酸化修饰后,该活性明显增强。这些工作暗示UCHL3在细胞内的去泛素化酶活性可能受到翻译后各种修饰的调控。由于至今为止尚未有任何体外实验显示UCHL3WT具有切割泛素链的活性[15,16],因此关于UCHL3切割泛素链的活性缺乏体外证据。如果UCHL3的体内活性报道真实,则很可能是细胞内UCHL3在表达后受到了关键的翻译后修饰。而原核系统表达的UCHL3由于没有修饰,不具备切割泛素链的活性。因此,展开UCHL3的体外修饰研究将对该问题做出一定程度上的阐释。
Ser突变为Glu是常用的模拟磷酸化策略,在很多蛋白激酶的体外研究中有过成功案例。在近期的去泛素化酶翻译后修饰研究中,无活性的USP14在模拟磷酸化后展现了对Ub-AMC的切割活性[22]。本研究正是基于先前的模拟磷酸化成功案例进行实验设计,利用点突变技术将Ser75突变为Glu,成功构建模拟磷酸化的UCHL3S75E,并纯化得到性质均一的UCHL3S75E蛋白,随后进行体外去泛素化酶的活性测定。首先,在5 nmol/L浓度下,UCHL3S75E切割Ub-AMC的活性比UCHL3WT提高了70%,显示了模拟磷酸化对UCHL3活性的调控作用。其次,UCHL3WT没有展现对K27 diub、K48 diub和K63 diub等二泛素的切割活性[16];出人意料的是,UCHL3S75E也没有展现出对这3种链接类型二泛素的生理水平切割活性。这些结果首次提供了UCHL3磷酸化之后活性提高的体外证据,一定程度上支持了UCHL3受磷酸化调控的理论。同时,这些结果也暗示UCHL3切割泛素链可能存在尚未发现的、更为复杂的分子机制。
在本课题组近期解析的UCHL3与K27二泛素复合物的晶体结构中,K27二泛素的2个泛素分子分别占据了UCHL3蛋白表面上的S1以及S2位点[19](图6)。而去泛素化酶实现切割的前提是2个泛素的异肽键应接近于活性中心,即2个泛素分子应分别位于S1和S1’位点。由此推测,UCHL3也许是以二泛素为结合基本单元(在S1和S2位点结合),对三泛素或者更长的泛素链进行切割,更确切地说是对S1与S1’之间的异肽键进行切割。结构分析显示,Ser75的位置正处于UCHL3分子的S1’附近,其磷酸化可能诱导S1’位点结构重排,帮助S1’位点形成接纳泛素链底物的空间构象,激活UCHL3蛋白对泛素链的切割活性。
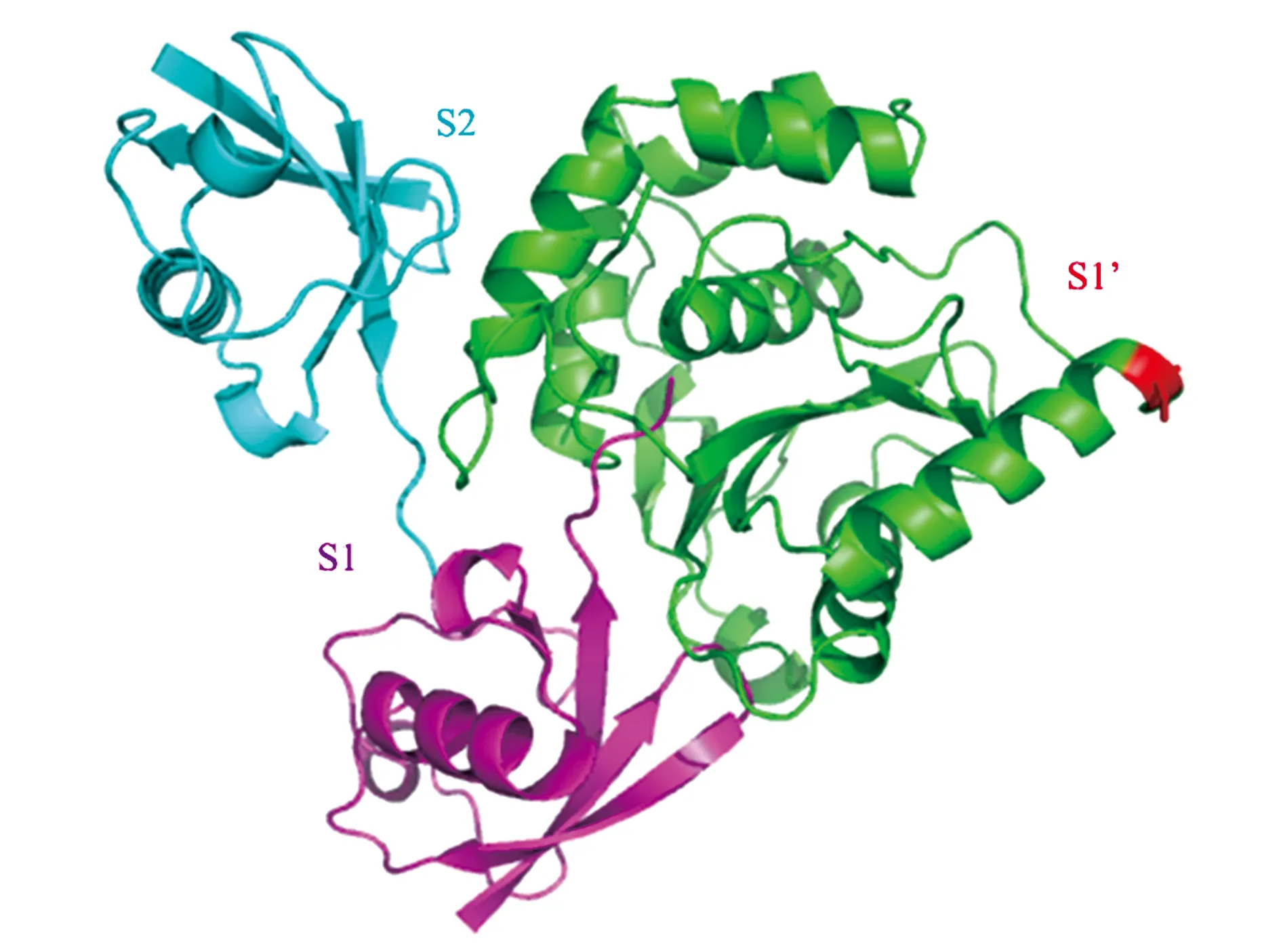
图6 UCHL3与K27diub复合物晶体结构及Ser75位置[19]Fig.6 The crystal structure of UCHL3 and K27 diub complex and position of Ser75[19].注:绿色代表UCHL3蛋白;青色和玫红色代表K27 diub,其中玫红色泛素分子占据了UCHL3蛋白的S1位点,而青色泛素分子则占据了UCHL3蛋白的S2位点;红色位点代表UCHL3中Ser75。
此外,尽管UCHL3与UCHL1的亲缘关系最近,但Ser75只存在于UCHL3中,在UCHL1中并不存在,表明UCHL3受磷酸化调控的进化独特性。这与目前的研究结果较为吻合,即UCHL1只能对单泛素及其缀合物进行切割[16],且并未发现其存在磷酸化调控机制,也未有文献报道其具备切割多聚泛素链的活性。尽管与UCHL1序列同源,可以推测出,正是由于在Ser75位点的不同,UCHL3的底物范围从单泛素及其缀合物扩展到多泛素链,在细胞内已进化成一个真正可以对多泛素链底物进行切割的去泛素化酶。当然,这些推测还需要进一步的生物化学以及结构生物学实验数据加以证实。此外,值得注意的是,Ser75位点在小鼠、果蝇、水稻和玉米中保守存在,但是在拟南芥中却变成了Glu,暗示着拟南芥中的UCHL3蛋白很可能是组成性活化的,无需其他激酶的磷酸化修饰便可切割泛素链。因此,在后续研究中,可以在拟南芥中将组成型活化位点Glu突变为Ser,观察植株表型变化,探索植株水平上磷酸化调控UCHL3的意义。
