水环境下羟自由基致布洛芬分子损伤的机理
2019-10-14姜春旭王佐成高峰佟华杨晓翠丛建民
姜春旭,王佐成,高峰,佟华,杨晓翠,丛建民
(1. 白城师范学院理论计算中心,吉林 白城137000;2. 白城师范学院传媒学院,吉林 白城 137000;3. 白城师范学院物理学院,吉林 白城 137000;4. 白城师范学院生命科学学院,吉林 白城 137000)
布洛芬(IBU)具有抗炎、止痛和解热等作用,可治疗强直性脊椎炎、风湿性关节炎等疾病[1-2]。由于IBU的重要应用,人们对其进行了广泛的研究。代卫国等[3]的研究表明,布洛芬对映体在人工光电催化剂表面可以手性识别。郭慧卿等[4]的研究表明,布洛芬的热分解可通过脱水、C—C键断裂和分子键断裂三个过程实现。文献[5-7]的研究表明,气相IBU分子具有稳定性,水分子簇的催化可使IBU缓慢地消旋。文献[8]研究表明,水与MOR分子筛的共催化也可使布洛芬缓慢地旋光异构。
生命体内有羟自由基存在,羟自由基具有较强的氧化能力,它可通过抽氢和加成反应等多种方式与多种分子作用,造成氨基酸、蛋白质和DNA等物质氧化性损伤[9]。文献[10-11]的研究表明,羟自由基抽取α-H可致丙氨酸和缬氨酸损伤,文献[12-13]的研究表明,羟自由基的进攻可使腺嘌呤和鸟嘌呤损伤。紫外线照射可导致空气中的水电离产生自由基,这是否会导致暴露在外的布洛芬损伤失效。患者心态和情绪不佳、不健康饮食和手机辐射等多种因素都会导致体内产生自由基,自由基是否会导致布洛芬损伤,相关研究目前未见报道。基于此并考虑到生命体内的水溶剂环境,本工作对水汽相及水液相环境下羟自由基抽取IBU分子的α-H和羟自由基与IBU分子苯环上的C加成反应机理进行了研究,说明了水汽相和水液相环境下羟自由基如何诱导布洛芬损伤,为安全储存和较好地发挥IBU的疗效给予理论指导。
1 研究与计算方法
用密度泛函的B3LYP[14]方法,采用6-31+G(d, p)基组对水汽环境下标题反应的驻点进行优化,通过对过渡态[15]进行IRC[16]计算来确认过渡态的可靠性。为获得高水平的势能面,用从头算的MP2[17]方法,采用6-311++G(2df, pd)基组计算驻点的单点能。计算水溶剂化效应时,吉布斯自由能热校正采用水汽环境下的数据,高水平的单点能采用自洽反应场理论的SMD模型[18]计算,用Gtotal=Gtc+ESP计算各驻点的总能(Gtc和ESP分别为吉布斯自由能热校正和高水平的单点能)。IBU分子的构象1与羟自由基水分子簇通过氢键作用形成氢键络合物,记作IBU_1·[(·OH)·H2O],羟自由基攻击S-IBU_1的苯环C3位点的过渡态记作S-TS_1·(·OH)_C3,其余体系用相似的方法表示。文中计算均由Gaussian09[19]软件包完成。
2 结果与讨论
研究表明,羟自由基致S-IBU和R-IBU的损伤机理相同,本工作只对羟自由基致S-IBU的损伤进行讨论。图1是S-IBU分子的两种稳定构象,以S-IBU_1的能量为势能零点计算的S-IBU_2的相对能量是-0.71 kJ/mol ,S-IBU_1比S-IBU_2的稳定性微差。下面对羟自由基通过抽氢和加成方式致S-IBU_1和S-IBU_2的损伤分别进行讨论。
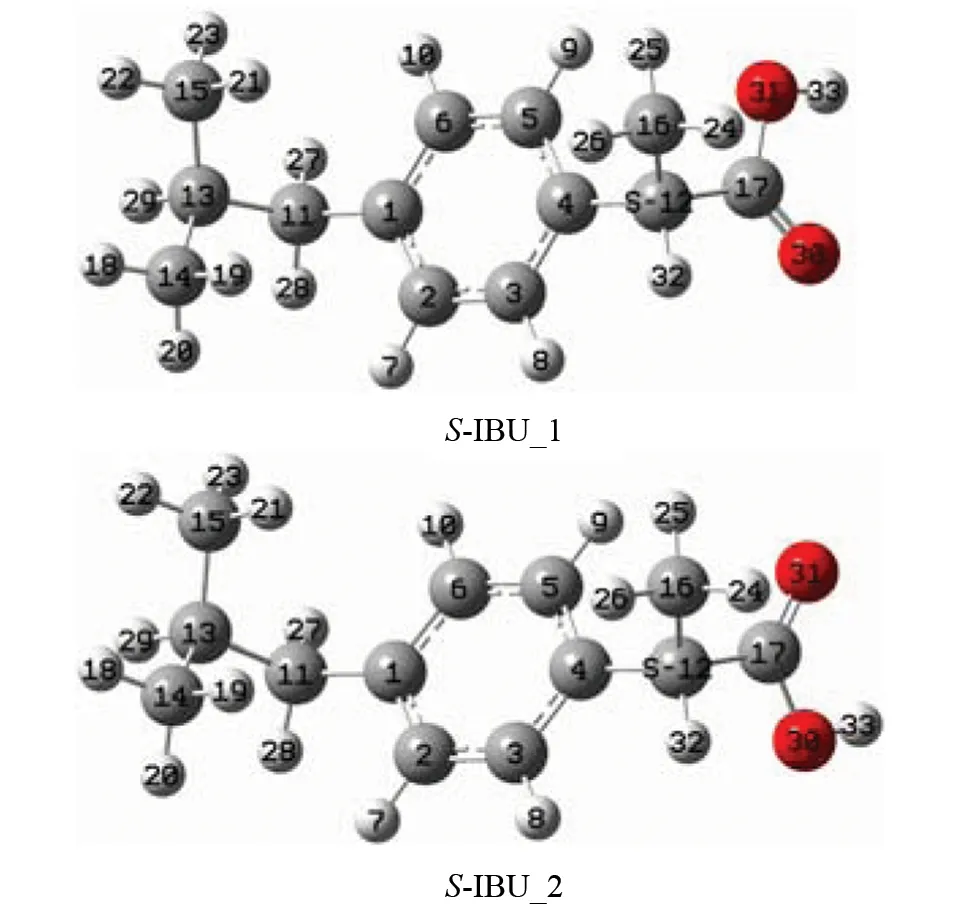
图1 两种S型布洛芬分子的几何构象Fig.1 Geometric conformation of two S-type ibuprofen molecules
2.1 羟自由基(水分子簇)抽氢致S-IBU的损伤
由于无论是水汽相还是水液相,羟自由基都可以独自存或与水分子形成羟自由基水分子簇,因此羟自由基抽氢致S-IBU_1和S-IBU_2损伤都有羟自由基抽α-H和水分子辅助羟自由基抽α-H两种机理,分别进行讨论。
2.1.1 羟自由基(水分子簇)抽氢致S-IBU_1损伤S-IBU_1在羟自由基(水分子簇)作用下的损伤历程,见图2,反应势能剖面见图3(@water线为水溶剂化的势能剖面)。
1)对于羟自由基抽α-H致S-IBU_1损伤。
首先,羟自由基34O—35H与S-IBU_1的α-氢32H和羰基氧30O通过氢键作用,形成络合物S-IBU_1·(·OH)。然后,S-IBU_1·(·OH)经·OH抽α-氢的过渡态TS1_1·(·OH),形成IBU_1*·H2O。水分子是由32H与羟自由基形成,IBU_1*的C12失去了手性,是损伤的S-IBU_1。此基元反应是·OH抽取了α-碳上的氢原子32H与之形成水分子,IBU_1*电荷仍然为零。从S-IBU_1·(·OH)到TS1_1·(·OH)过程,键长12C-32H从0.109 3 nm拉伸到0.114 8 nm断裂,拉伸幅度是0.005 5 nm;骨架二面角16C—12C—4C—17C从126.74°增加到130.20°。一个化学键很小的伸长和骨架很小的形变需要的能量不多,TS1_1·(·OH)产生的能垒只有40.30 kJ/mol 。TS1_1·(·OH)产生的能垒远远小于2个水分子簇催化的此基元反应的能垒152.5 kJ·mol-1[6],原因是·OH的氧化性比(H2O)2分子强。二面角3C—4C—5C—12C、16C—12C—4C—17C和12C—17C—30O—31O分别是178.59°、-177.72°和-179.00°,IBU_1*·H2O的苯环骨架碳原子、α-碳12C及羧基的骨架原子形成了共轭离域大π键,35H与羰基氧30O的距离是0.198 4 nm,IBU_1*分子与H2O分子形成了较强的分子间氢键,因此IBU_1*·H2O极其稳定,处在势能面较低的位置。
从图3可以看出,羟自由基抽α-H致S-IBU_1损伤的逆反应能垒是168.71 kJ/mol,此能垒太高,难以越过,此损伤过程不可逆,说明损伤产物IBU_1*难以修复。
从图3还看出,S-IBU_1·(·OH)→TS1_1·(·OH)→IBU_1*·H2O反应在水溶剂环境下的能垒是39.00 kJ/mol ,说明水溶剂效应对·OH抽α-H致S-IBU_1损伤的反应基本没有影响。IBU_1*·H2O相对于S-IBU_1·(·OH)的溶剂化能量有所降低,是因为IBU_1*·H2O的偶极矩是5.129 D,大于前者的偶极矩4.097 D,导致在极性溶剂水中IBU_1*·H2O构象相对更稳定。
计算表明,IBU_1*与纸面里的1个水分子形成的氢键络合物,经α-碳12C抽取水分子的氢原子的过渡态,可以形成R-IBU_1。此基元反应相似于S-IBU_1·(·OH)→TS1_1·(·OH)→IBU_1*·H2O的逆过程,需要越过的能垒在160.00 kJ/mol 以上,因此,IBU_1*→R-IBU_1只是在理论上存在。
2)对于H2O辅助·OH抽α-H致S-IBU_1损伤。
首先,·OH和H2O与S-IBU_1的32H和30O通过氢键作用,形成络合物S-IBU_1·[(·OH)·H2O]。然后,S-IBU_1·[(·OH)·H2O]经·OH抽α-H的过渡态TS1_1·[(·OH)·H2O],形成IBU_1*·2H2O(计算表明,这时的损伤布洛芬分子构象同于前面的IBU_1*,所以都用IBU_1*表示)。此基元反应是·OH抽取了α-C上的氢原子32H形成H2O,IBU_1*电荷数仍然为零。IBU_1*已经失去了手性,是损伤的S-IBU_1。从S-IBU_1·[(·OH)·H2O]到TS1_1·[(·OH)·H2O]过程,键长12C—32H从0.109 3 nm拉伸到0.116 4 nm断裂,拉伸幅度是0.007 1 nm;反应活性中心骨架二面角16C—12C—4C—17C从126.26°增加到133.38°,一个化学键很小的伸长和骨架很小的形变需要的能量不多,TS1_1·[(·OH)·H2O]产生的能垒是34.68 kJ/mol 。TS1_1·[(·OH)·H2O]产生的能垒小于TS1_1·(·OH)产生的能垒,原因是它们的氢键角12C—32H—34O分别是176.92°和163.41°,因此,前者比后者氢键强,结构稳定。结构分析表明,相似于IBU_1*·1H2O,IBU_1*·2H2O的苯环上的碳原子、α-碳以及羧基的骨架原子也形成了共轭离域的大π键,38H与羰基氧30O的距离是0.188 3 nm、35H与36O的距离是0.189 1 nm、24H与34O的距离是0.294 2 nm,IBU_1*·2H2O形成了2个较强的和1个较弱的分子间氢键,因此IBU_1*·2H2O极其稳定。
从图3可以看出,相似于羟自由基抽α-H致S-IBU_1损伤,水分子辅助羟自由基抽α-H致S-IBU_1损伤的逆反应能垒是163.88 kJ/mol ,难以逾越,此过程的损伤产物IBU_1*也难以修复。
从图3还可以看出,S-IBU_1·[(·OH)·H2O]→TS1_1·[(·OH)·H2O]→IBU_1*·2H2O反应在水溶剂环境下的能垒是34.02 kJ/mol ,说明水溶剂效应对羟自由基水分子簇抽α-H致S-IBU_1损伤反应也基本没有影响。IBU_1*·2H2O相对于S-IBU_1·[(·OH)·H2O]的溶剂化能量有所降低,是因为IBU_1*·2H2O的偶极矩是4.249 D,略大于前者的偶极矩3.938 D,导致在极性溶剂水中IBU_1*·2H2O构象相对更稳定。
计算表明,IBU_1*与纸面里的2个水分子形成的氢键络合物,经α-碳12C抽取水分子的氢原子的过渡态,可以形成R-IBU_1。但需要越过的能垒在163.00 kJ/mol 以上,因此,S-IBU_1的消旋也只是在理论上存在。
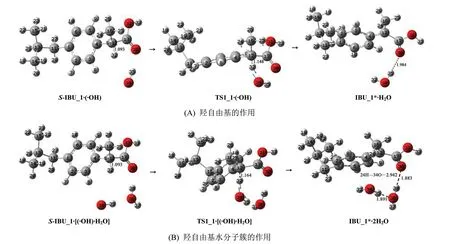
图2 羟自由基(水分子簇)抽α-氢致S-IBU_1损伤的反应历程Fig.2 S-IBU_1 damage mechanism induced by α-H abstraction of hydroxyl radicals(water clusters)
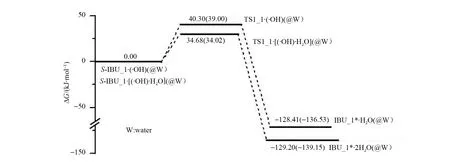
图3 羟自由基(水分子簇)抽α-氢致S-IBU_1损伤的反应势能面Fig.3 Potential energy surfaces of S-IBU_1 damage induced by byα-H abstraction of hydroxyl radicals(water clusters)
从图3可以看出,无论是在水汽相还是在水溶剂相,羟自由基水分子簇抽氢比只是羟自由基抽氢致S-IBU_1损伤都具有优势。
2.1.2 羟自由基(水分子簇)抽氢致S-IBU_2损伤S-IBU_2在羟自由基(水分子簇)作用下的损伤历程,见图4,反应势能剖面见图5(@water线为水溶剂化的势能剖面)。反应机理基本同于2.1节的S-IBU_2在羟自由基和水分子作用下的损伤,为节省篇幅,这里只做一般讨论。
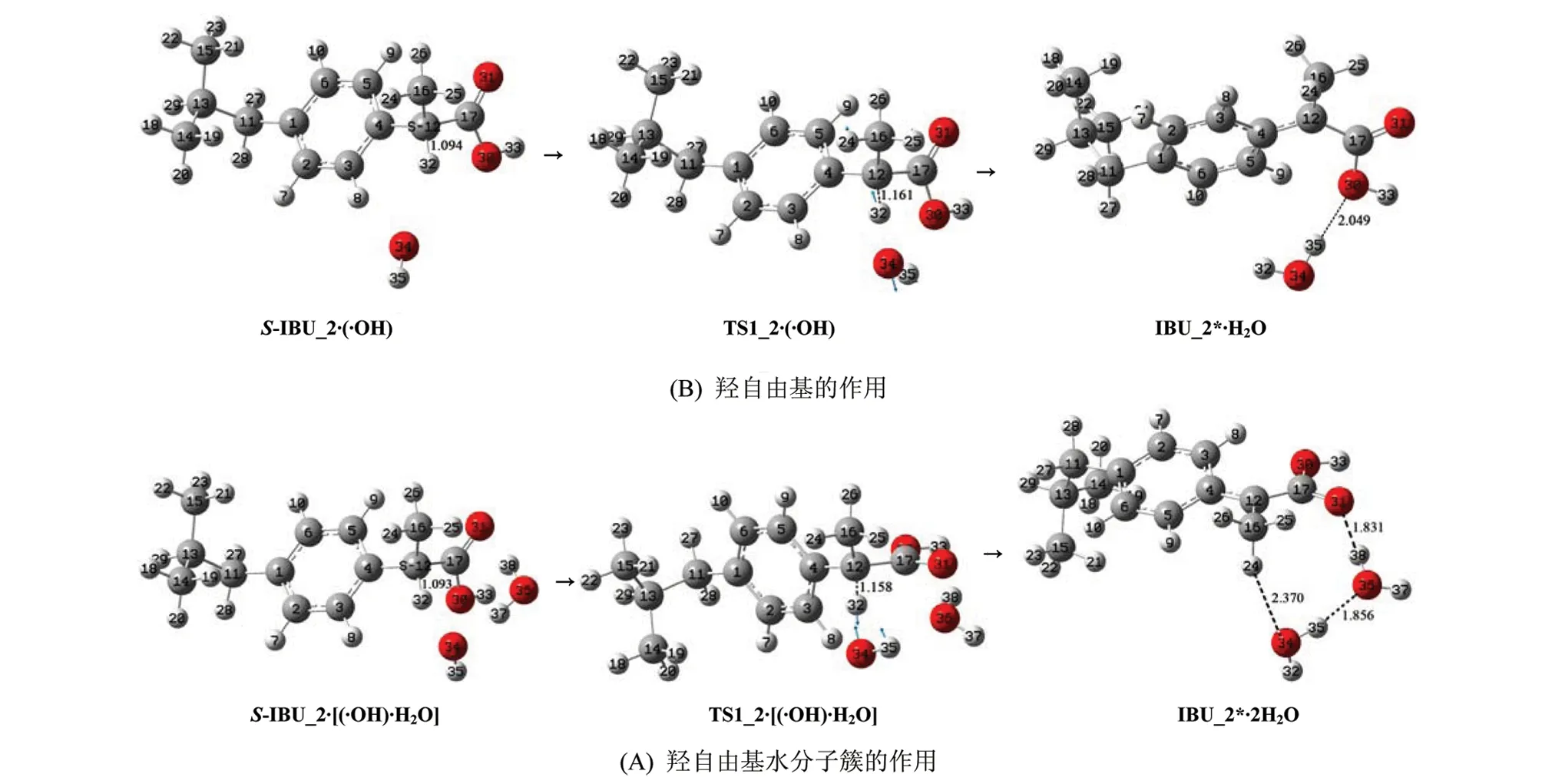
图4 羟自由基(水分子簇)抽α-氢致S-IBU_2损伤的反应历程Fig.4 S-IBU_2 damage mechanism induced by α-H abstraction of hydroxyl radicals(water clusters)
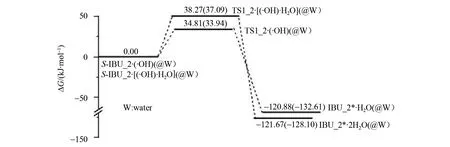
图5 羟自由基(水分子簇)抽α-氢致S-IBU_2损伤的反应的势能面Fig.5 Potential energy surfaces of S-IBU_2 damage induced by α-H abstraction of hydroxyl radicals(water clusters)
1)对于羟自由基抽α-H致S-IBU_2损伤。
S-IBU_2·(·OH)经·OH抽α-H的过渡态TS1_2·(·OH),形成IBU_2*·H2O。IBU_2*是损伤的S-IBU_2。从S-IBU_2·(·OH)到TS1_2·(·OH),键长12C—32H从0.109 4 nm拉伸到0.116 1 nm断裂,拉伸0.006 7 nm;反应活性中心骨架二面角16C—12C—4C—17C从123.28°增加到127.73°,TS1_2·(·OH)产生的能垒是34.81 kJ/mol 。此能垒小于TS1_1·(·OH)产生的能垒,原因是TS1_2·(·OH)的键角12C—32H—34O为171.65°,比TS1_2·(·OH)的163.41°大,前者的氢键强;S-IBU_2·(·OH)的34O—32H小于S-IBU_2·(·OH)的34O—32H,前者的·OH对α-H的库仑引力强。结构分析表明,相似于IBU_1*·H2O,IBU_2*·H2O也存在离域的共轭大π键和1个中等强度的分子间氢键,构象极稳定,处在势能面较低的位置。
从图5可以看出,羟自由基抽α-H致S-IBU_2损伤的逆反应能垒是155.69 kJ/mol ,此能垒难以逾越,说明IBU_2*难以修复。从图5还可以看出,S-IBU_2·(·OH)→TS1_2·(·OH)→IBU_2*·H2O反应在水溶剂环境下的能垒是33.94 kJ/mol ,水溶剂效应对此反应基本无影响。
2)对于水分子辅助羟自由基抽α-H致S-IBU_2损伤。
S-IBU_2·[(·OH)·H2O]经羟自由基抽α-氢的过渡态TS1_1·[(·OH)·H2O],形成IBU_2*·2H2O。IBU_2*失去了手性,是损伤的S-IBU_2,键长12C—32H从0.109 3 nm拉伸到0.115 8 nm断裂,拉伸幅度是0.006 5 nm;反应活性中心骨架二面角16C—12C—4C—17C和16C—12C—17C—31O分别从125.66°和-14.25°增加到130.28°和54.99°,TS1_2·[(·OH)·H2O]产生的能垒是38.27 kJ/mol 。TS1_2·[(·OH)·H2O]产生的能垒大于TS1_2·(·OH)产生的能垒,原因是S-IBU_2·[(·OH)·H2O]的羟自由基与α-氢距离比S-IBU_2·(·OH)的羟自由基与α-氢距离远,并且从S-IBU_2·[(·OH)·H2O]到TS1_2·[(·OH)·H2O]过程,羧基旋转了较大的幅度。结构分析表明,相似于IBU_1*·2H2O,IBU_2*·2H2O也存在离域的共轭大π键以及2个较强的和1个中等强度的分子间氢键,构象极其稳定。
从图5可以看出,水分子辅助羟自由基抽α-H致S-IBU_2损伤的逆反应能垒是159.94 kJ/mol ,难以逾越,损伤产物IBU_2*难以修复。从图5还可以看出,水溶剂效应使水分子辅助羟自由基抽α-H致S-IBU_2损伤的能垒微降到37.09 kJ/mol ,水溶剂效应的影响可以不予考虑。
从图5可以看出,无论是在水汽相还是在水溶剂相,羟自由基抽氢比羟自由基水分子簇抽氢致S-IBU_2损伤具有优势。
2.2 羟自由基的加成致S-IBU损伤
羟自由基与S-IBU加成,羟自由基可攻击苯环上的每个碳,为节省篇幅,攻击S-IBU_1选取了一个代表性的位点C3,攻击S-IBU_2,选取了两个代表性的位点C3和C4,下面分别进行讨论。
2.2.1 羟自由基的加成致S-IBU_1损伤 羟自由基攻击S-IBU_1的苯环C3位点的反应历程见图6,反应势能剖面见图7的S-IBU_1线(@water线为水溶剂化的势能剖面)。
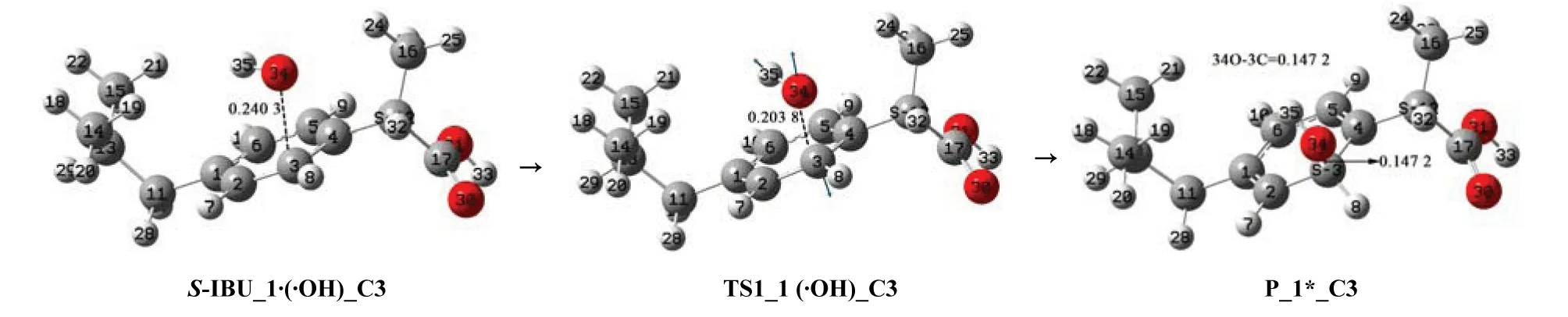
图6 羟自由基攻击S-IBU_1的苯环C3位点的反应历程Fig.6 Reaction mechanism of hydroxyl radicals attacking C3 site of benzene ring in S-IBU_1
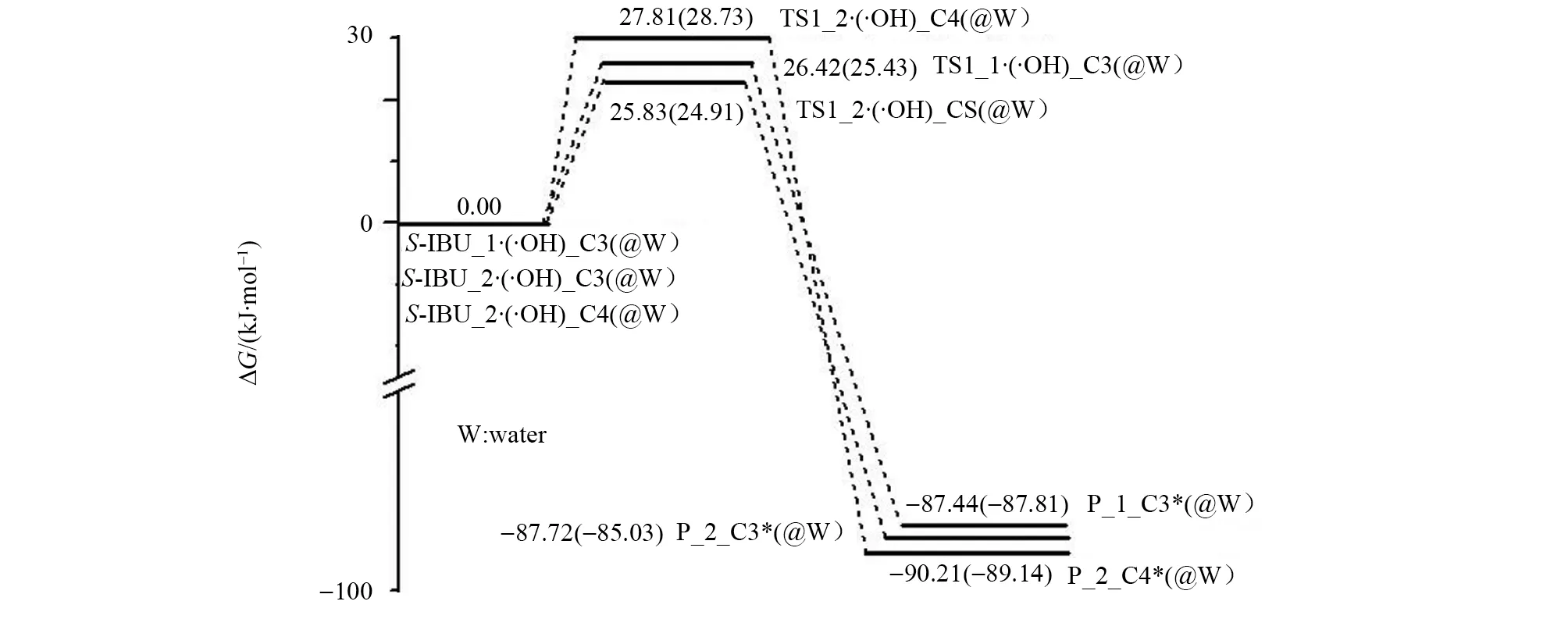
图7 羟自由基攻击S-IBU_1和S-IBU_2的苯环C位点的反应势能面Fig.7 Potential energy surfaces of hydroxyl radicals attacking C site of benzene ring in S-IBU_1 and S-IBU_2
首先,羟自由基在S-IBU_1的苯环C3位点的上方与S-IBU_1通过范德华作用形成前驱配合物S-IBU_1·(·OH)_C3,而后S-IBU_1·(·OH)_C3经·OH攻击C3的过渡态TS1_1 (·OH)_C3,得到加成产物P_1*_C3,P_1*_C3比S-IBU_1多一个手性中心C3,已经不具有S-IBU_1的性质,是损伤的S-IBU_1。
从S-IBU_1·(·OH)_C3到TS1_1 (·OH)_C3过程,二面角6C—5C—4C—3C、5C—4C—3C—2C和2C—3C—4C—12C分别从0.11°、0.09°和-179.50°增加到-1.92°、4.43°和-177.14°,没有键的断裂,只是骨架苯环C和α-C发生了不大的形变,所以TS1_1 (·OH)_C3产生的能垒较低,只有26.42 kJ/mol 。S-IBU_1·(·OH)_C3与P_1*_C3相比较,C3从sp2杂化变成了sp3杂化,34O—35H与C3的距离从0.240 3 nm减小到0.147 2 nm,34O—35H与C3(或说与S-IBU_1)的作用从弱相互作用变为化学键作用,因此,P_1*_C3体系十分稳定。从图7的S-IBU_1线可以看出,S-IBU_1损伤的逆反应能垒是113.86 kJ/mol ,说明羟自由基攻击S-IBU_1的苯环C3位点的损伤产物很难修复。
NBO电荷计算表明,羟自由基34O—35H从孤立状态到其与S-IBU_1络合物成S-IBU_1·(·OH)_C3,再到过渡态TS1_1 (·OH)_C3,最后到P_1*_C3,净电荷从0.000到 -0.159,再到-0.247,最后到 -0.270;34O的电荷从 -0.431到 -0.603,再到 -0.702,最后到 -0.756。·OH在攻击C3的过程中不断地夺取S-IBU_1的负电荷,说明其具有较强的氧化性,诱导了S-IBU_1损伤。
从图7中S-IBU_1的水溶剂效应的势能剖面可以看出,水溶剂环境下羟自由基攻击S-IBU_1的苯环C3位点的能垒是25.43 kJ/mol ,说明水溶剂的助催化作用微弱,可以说基本没有作用;逆反应能垒是113.24 kJ/mol ,说明水溶剂环境下P_1*_C3也难以修复。
2.2.2 羟自由基的加成致S-IBU_2损伤 羟自由基攻击S-IBU_2的苯环C3和C4位点的反应历程,见图8,反应势能剖面见图7的S-IBU_2线(@water线为水溶剂化的势能剖面)。羟自由基攻击S-IBU_2的C3位点的机理相似于2.2.1的羟自由基攻击S-IBU_1的C3位点,这里只做一般讨论。
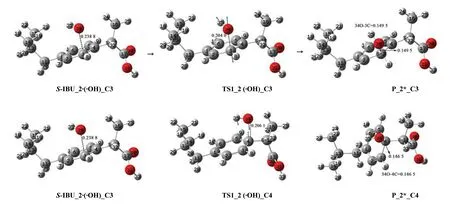
图8 羟自由基攻击S-IBU_2的苯环C3和C4位点的反应历程Fig.8 Reaction mechanism of hydroxyl radicals attacking C3 and C4 sites of benzene ring in S-IBU_2
羟自由基在S-IBU_2的C3位点的上方与C3通过范德华作用形成前驱配合物S-IBU_2·(·OH)_C3,经·OH攻击C3的过渡态TS1_2 (·OH)_C3,得到损伤产物P_2*_C3。结构分析表明,从S-IBU_2·(·OH)_C3到TS1_2 (·OH)_C3过程,也是骨架苯环C和α-C发生了不大的形变,因此TS1_2 (·OH)_C3产生的能垒较低,只有25.83 kJ/mol 。从图7的S-IBU_2线可以看出,此基元逆反应能垒是113.55 kJ/mol ,说明羟自由基攻击S-IBU_1的苯环C3位点的损伤产物很难修复。从图7中S-IBU_2的水溶剂效应的势能剖面可以看出,水溶剂环境下羟自由基攻击S-IBU_2的苯环C3位点的能垒是24.91 kJ/mol ,说明水溶剂的助催化作用极微弱,可以认为没起作用;逆反应能垒是109.94 kJ/mol ,说明水溶剂环境下P_2*_C3也难以修复。
羟自由基攻击S-IBU_2的C4位点时,IRC计算表明,反应的前驱配合物仍然是S-IBU_2·(·OH)_C3,而过渡态则是图8的TS1_2 (·OH)_C4,产物是P_2*_C4。势能面图7的S-IBU_2线说明P_2*_C4也难以修复。
结构分析表明,从S-IBU_2·(·OH)_C3到TS1_2 (·OH)_C4过程,骨架苯环C和α-C的形变略大于从S-IBU_2·(·OH)_C3到TS1_2(·OH)_C3过程,因此TS1_2 (·OH)_C4产生的能垒是27.81 kJ/mol ,略高于TS1_2 (·OH)_C3产生的能垒。图7 中S-IBU_2的溶剂效应势能面表明,溶剂环境下此基元反应的能垒是28.73 kJ/mol ,升高的幅度微小,可以认为没变;溶剂环境下的损伤产物P_2*_C4也难以修复。
3 结 论
1)羟自由基致布洛芬损伤有羟自由基(水分子簇)抽氢和羟自由基加成到苯环两种机理。
2)羟自由基(水分子簇)抽氢反应:对于S-IBU_1,水分子辅助羟自由基抽α-H的反应通道具有优势,抽氢反应能垒是34.68 kJ/mol ;对于S-IBU_2,羟自由基抽α-H的反应通道具有优势,抽氢反应能垒是34.81 kJ/mol 。羟自由基加成到苯环的反应:对于S-IBU_1,加成到C3位点的能垒是26.42 kJ/mol ;对于S-IBU_2,加成到C3位点的能垒是25.83 kJ/mol ,加成到C4位点的能垒是27.81 kJ/mol ,后者略具优势。在抽氢和加成两种反应的竞争中,后者具有优势。
3)水溶剂化效应对羟自由基(水分子簇)抽氢和加成到苯环致布洛芬损伤反应基本没有影响。
4)羟自由基(水分子簇)抽氢和羟自由基加成导致的布洛芬损伤难以修复。
