喹诺酮化合物的抗乙型肝炎病毒和丙型肝炎病毒活性
2019-10-12张姝李红冯连顺刘明亮郭慧元
张姝,李红,冯连顺,刘明亮,郭慧元,*
(1 武汉谱尼科技有限公司,武汉 430014;2 中国医学科学院北京协和医学院医药生物技术研究所,北京 100050)
1 前言
慢性乙型肝炎(简称乙肝)和丙型病毒性肝炎(简称丙肝)分别是由于感染乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)引起的病毒性肝炎,乙肝和丙肝患者及HBV和HCV携带者是主要传染源[1,2]。HBV可通过母婴、血和血液制品、破损的皮肤黏膜及性接触传播,而HCV主要经输血、针刺和吸毒等途径传播[3,4]。据世界卫生组织统计,全球约有3.25亿人感染了HBV或HCV,二者合在一起是发生肝硬化和肝癌的最常见原因[5]。病毒性肝炎是全球第七大死亡原因,每年因此丧命的患者超过100万,与结核病和艾滋病毒导致的死亡人数相当。我国约有9000万HBV和4500万HCV携带者,2000万乙肝和1000万丙肝患者,肝癌病例占全球一半[5]。世界卫生组织预计,2015至2030年间,中国将有约1000万人因肝硬化和肝癌死亡。显然,乙肝和丙肝已成为严重的社会和公共卫生问题。因此,对乙肝和丙肝的防治显得尤为重要。
目前,抗乙肝和丙肝药物主要有干扰素和核苷类似物等[6]。然而,干扰素和核苷类似物有诸多缺点,如干扰素需注射使得患者的依从性不高,而核苷类似物停药后复发率较高[7,8]。不仅如此,随着抗病毒药物的广泛使用,HBV和HCV对药物的敏感性呈逐年下降之势。多个抗乙肝和丙肝药物正处于临床评价阶段,但仍不能满足患者的需求[9]。因此,有必要研发新型抗乙肝和丙肝药物。
喹诺酮可分为2-喹诺酮和4-喹诺酮,其衍生物具有抗菌[10,11]、抗结核[12,13]、抗肿瘤[14,15]、抗疟疾[16-18]、抗人类免疫缺陷病毒(HIV)[19,20]、抗HBV和HCV[21-23]等多种生物活性,且药代动力学性质和安全性良好,在临床上有着广泛的应用。不仅如此,喹诺酮结构骨架可供修饰的位点较多,在发现全新结构骨架愈发困难的今天,喹诺酮类化合物已成为研究人员竞相开发的热点[24-26]。
近年来,研究人员对喹诺酮进行了系统而广泛的结构修饰,喹诺酮的生物活性谱不断拓展,构-效关系(SAR)不断完善。本文将着重介绍近年来喹诺酮类化合物在抗HBV和HCV领域的最新研究进展,并归纳此类药物的SAR,以启迪科学家设计活性更高的候选物。
2 2-喹诺酮衍生物
与4-喹诺酮相比,2-喹诺酮研究的相对较少[27]。然而,2-喹诺酮衍生物也具有多种生物活性,且某些2-喹诺酮类化合物如viridicatin、viridicatol和tipifarnib目前正处于临床评价阶段,有望于不久的将来为人类健康服务[28]。Guo等评价了2-喹诺酮化合物1及其C-3位取代衍生物2~4在HBV感染HepG2.2.15细胞中的体外抗HBV e抗原(HBeAg)、抗HBV表面抗原(HBsAg)和抗HBV复制脱氧核糖核酸(DNA)活性,发现所有化合物对HBsAg均具有潜在的抑制活性,半数抑制浓度(IC50)为0.056~2.84 mmol/L,但多数化合物对HBeAg的活性不高(IC50: 0.079~>6.00 mmol/L)[29,30]。SAR研究结果表明,化合物2(IC50: 0.074~0.950 mmol/L)和4(IC50:0.079~1.87 mmol/L)对HBsAg和HBeAg均具有较高的活性,而化合物1(IC50: ≥2.22 mmol/L)和3(IC50: >3.61 mmol/L)对HBeAg的活性较弱,提示2-喹诺酮母核C-3位取代基对活性有显著影响且羟乙基和乙酰胺基对活性有利,游离氨基则对活性不利。细胞毒性研究结果显示,与无取代(1, 细胞半数毒性浓度/CC50:1.25~>5.46 mmol/L)和羟乙基(2, CC50: 1.72~>4.91 mmol/L)衍生物相比,向C-3位引入氨基或乙酰胺基可提高对HepG2.2.15细胞的毒性(化合物3和4的CC50: 0.044~0.767 mmol/L)[29]。其中,代表物2c对HBsAg (IC50: 70.2 μmol/Lμmol/L)、HBeAg (IC50: 340.5μmol/L)和HBV复制DNA(IC50: 72.1μmol/Lol/L)具有良好的活性,抗HBsAg和HBeAg活性优于对照药替诺福韦(IC50: 1450.1和1160.2 μmol/L)[30]。
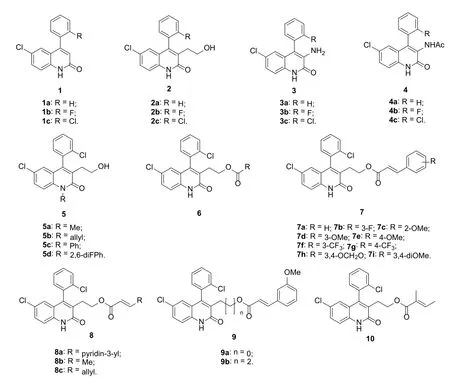
图1 2-喹诺酮衍生物1~10的化学结构
进一步研究表明,向化合物2c的N-1位引入甲基(5a, IC50: 22和34μmol/L)、烯丙基(5b, IC50: 10和12μmol/L)和苯基(5c, IC50: 12和12μmol/L)可提高抗HBsAg和HBeAg活性,但2,6-二氟苯基(5d, IC50: 87和>2300μmol/L)的引入对活性不利[31,32]。遗憾的是,化合物5a~c(CC50: 34, 23和26 μmol/L)对HepG2.2.15细胞的毒性显著提高。用烷基或芳基羧酸将C-3位的羟乙基酯化(6)可增强活性,但对HepG2.2.15细胞的毒性也随之提高。含有不饱和双键的酯7~10普遍具有良好的体外抗HBsAg和HBeAg活性,绝大多数衍生物的IC50<60μmol/L,且SI>21,选择性良好[32]。SAR显示,含有苯基的不饱和酯7和9的活性优于吡啶基和烷基衍生物8和10。苯环上甲氧基的位置与活性息息相关,且间位>邻位>对位,而第二个甲氧基的引入并不能显著提高活性。连接子的长度对抗HBsAg和HBeAg活性有一定影响,如对化合物7d (IC50: 10和26μmol/L)、9a (IC50: 11和18μmol/L)和9b (IC50: 20和28μmol/L)而言,短链连接子对抗HBeAg活性有利。代表物7d对HBsAg (SI>135)、HBeAg (SI>51)和HBV复制DNA (IC50: 45μmol/L)具有良好的活性和选择性,抗HBsAg和HBeAg活性是对照拉米夫定(IC50:27000和30000μmol/L)的2700和1153倍,极具进一步开发前景[32]。
HCV NS5B蛋白编码RNA依赖的RNA聚合酶(RdRp)是HCV复制酶复合体的关键催化酶,是潜在的抗HCV药物作用靶点[33]。2-喹诺酮-4H-苯并[e][1,2,4]噻二嗪1,1-二氧化物具有良好的抗HCVRdRp活性,引起了药物化学家的关注[34]。绝大多数2-喹诺酮-4H-苯并[e][1,2,4]噻二嗪1,1-二氧化物11抑RdRp和HCV亚基因组复制子(Huh-7细胞)活性在纳摩尔级[35]。其中,代表物11a~d抑RdRp和HCV亚基因组复制子的IC50和EC50分别为10~47 nmol/L和38~417 nmol/L,被用于进一步研究在小鼠、犬及猴子模型中的药代动力学性质。结果表明,化合物11d在小鼠(静脉注射/iv:1.3 mg/kg, 口服给药/po: 3.4 mg/kg)、犬(iv: 0.8 mg/kg,po: 4.0 mg/kg)及猴子(iv: 0.8 mg/kg, po: 4.0 mg/kg)模型中的药代动力学性质良好:药峰浓度(Cmax)为4141,4455和5437 ng/mL,半衰期(T1/2)为182.2, 103.5和96.9 min,清除率(CL)为1.4, 0.86和0.76 mL/min/kg,稳定分布容积(Vdss)为0.36, 0.15和0.11 L/kg,口服生物利用度(F%)为44%, >35%和>53%。极高的活性加之良好的药代动力学性质,使得化合物11d极具进一步开发前景。
进一步研究显示,将杂合体11(图2)的N-1位烷基换成氮取代的烷基或芳基(12)或把喹诺酮环换为萘啶酮(13)所得的杂合体也具有良好的抑HCV NS5B聚合酶Ia和Ib亚基因活性[36]。大部分目标物的IC50在纳摩尔级,但与杂合体11相比,并未有显著提高。向苯并[e][1,2,4]噻二嗪1,1-二氧化物结构片段引入取代基对活性有显著影响,尤其是杂合体14和15抗HCV NS5B聚合酶Ia和Ib亚基因的抑制活性在纳摩尔水平[37]。总体而言,杂合体15的活性优于14,提示胺基比醚对活性有利。对含氧衍生物14而言,化合物14h (IC50: 46和16 nmol/L )的活性最高,而向酰胺上引入甲基(14f, IC50: 180和80 nmol/L )或二甲基(14e,IC50: 934和70 nmol/L)均会导致活性的降低。对含氮衍生物15而言,所有的磺酰胺衍生物15e~h (IC50:2~41 nmol/L )均显示出具有优秀的抑HCV NS5B聚合酶Ia和Ib亚基因活性。药代动力学性质研究结果表明,杂合体14h (5 mg/kg)的生物利用度为35%、Cmax为180 nmol/L,药-时曲线下面积(AUC)为2.54 mg·h/mL,CL为0.74 L/h/kg,T1/2为2 h。进一步研究发现,该化合物可以在肝部累积,在给药8 h,该化合物在肝部的浓度为血浆的54倍。用苯并[b][1,4]噻嗪1,1-二氧化物(16)替换苯并[e][1,2,4]噻二嗪1,1-二氧化物将导致抑HCV NS5B聚合酶Ia和Ib亚基因活性的大幅下降,化合物16的IC50在微摩尔级[38]。进一步研究显示,尽管绝大多数六氢2-喹诺酮衍生物17的抑HCV NS5B聚合酶Ia和Ib亚基因活性也在纳摩尔水平,但药代动力学性质有所降低[39]。

图2 2-喹诺酮衍生物11~18的化学结构
从青花椒树皮中分离出的2-喹诺酮衍生物18抑HBV病毒DNA活性较弱,IC50为30.8 μg/mL,但细胞毒性低(ED50: >200 μg/mL),可作为先导物进一步优化[40]。
3 4-喹诺酮衍生物
4-喹诺酮具有生物活性谱广、药代动力学性质和安全性良好等诸多优点,目前临床上使用的喹诺酮类药物绝大多数属于4-喹诺酮[41,42]。因此,4-喹诺酮一直是该领域研究的热点。4-喹诺酮衍生物如诺氟沙星、环丙沙星、洛美沙星和巴洛沙星等可通过抑制HCV NS3促旋酶抑制HCV复制[43],故从4-喹诺酮衍生物中寻找新型抗HCV和HBV药物引起了药物化学家的极大关注。
氟喹诺酮(诺氟沙星/环丙沙星/洛美沙星/加替沙星)-5-氟靛红-甲氧苄氨嘧啶杂合体19(图3)在浓度为50 μg/mL对HUH-7胞内HCV RNA复制抑制率为89%~100%[44]。SAR显示抑制活性与氟喹诺酮的种类相关,顺序为环丙沙星(100%)>诺氟沙星(95%)>加替沙星(92%)>洛美沙星(89%)。将靛红C-5位的氟替换为甲基(20, 在浓度为50 μg/mL对HUH-7胞内HCVRNA复制抑制率分别为97%, 92%和65%)对活性无显著影响[45]。尽管环丙沙星-5-氟靛红-甲氧苄氨嘧啶杂合体19b的活性最高,但对HUH-7细胞的毒性也最高,CC50<50 μg/mL,仍需进一步优化[44]。

图3 氟喹诺酮-靛红-甲氧苄氨嘧啶杂合体19和20的化学结构
对4-喹诺酮衍生物21(图4)的抑HCV亚基因组复制子(Huh-7)活性评价结果表明,向其C-7位引入取代基将导致活性的消失[46]。N-1位无取代或引入正丙基或苄基衍生物也未显示出任何活性,但引入羟乙基或羟丙基则对活性有利。对C-6位而言,苯并呋喃-2-基和苯并噻吩-2-基最优。活性最高的21a~d对HCV复制子也具有潜在的抑制活性(EC50: 5.8~36 μmol/L),其中化合物21b,c (EC50: 5.9和5.8 μmol/L)抑HCV复制子活性优于利巴韦林(EC50: 14 μmol/L)。进一步与研究发现,这类化合物对NS5B的抑制活性较弱,提示此类化合物可能通过其它途径发挥抗HCV活性。
除化合物22a和22h外,所有衍生物(IC50: 40~154 nmol/L)抑HCV NS5BRdRp均在纳摩尔级别[47]。SAR显示,将C-7位的氯(22a~c, IC50: 154~1410 nmol/L)换成哌嗪基(22d, IC50: 67 nmol/L)、4-甲基哌嗪基(22e,IC50: 40 nmol/L)和4-(2-吡啶基)哌嗪基(22f, IC50: 69 nmol/L)和4-(2-噻唑基)哌嗪基(22d, IC50: 138 nmol/L)对活性有利,但替换为4-(3-三氟甲基苯基)哌嗪基(22h, IC50: 6132nmol/L)则对活性不利。化合物22a和22d~g对HCV复制子(Huh5-2细胞)也具有潜在的抑制活性,EC50为1.5~8.6 μmol/L。其中,化合物22f不仅对HCV复制子的活性良好(EC50: 2.2 μmol/L, EC90:13.5 μmol/L),而且对Huh-9-13细胞未显示出任何毒性(CC50: >163 μmol/L, SI>54),可作为先导物进一步优化。
对化合物23~25的抑HCV聚合酶活性研究结果表明,这些化合物普遍具有良好的活性,且25>>23>24[48]。所有4-喹诺酮衍生物25对HCV聚合酶的抑制活性均极高,IC50为8~60 nmol/L。SAR显示,苯环上甲磺酰基的位置对活性有显著影响,且对位>邻位>间位。其中,代表物25d (IC50: 8 nmol/L)的活性极高,可作为先导物进一步优化。该课题组进一步研究发现,某些C-3位含有噁唑、噁二唑、四氮唑或噁唑啉结构片段的喹诺酮也具有潜在的活性[49]。以喹诺酮-噁二唑杂合体26为例,噁二唑环上的取代基对活性有显著影响,且苄基远优于苯基和苯乙基。其中,噁二唑环上含有苄基的衍生物26b和26d抑HCV聚合酶IC50分别为41和23 nmol/L,远优于苯基和苯乙基衍生物(IC50: >10 μmol/L)。化合物26d的活性优于26b,提示6-氟-7-(4-甲基)哌嗪基优于6,7-二甲氧基。该课题组进一步优化得到了6-氟-7-(4-甲基)哌嗪喹诺酮-噁二唑杂合体27和28并研究了它们的抑HCV聚合酶活性,发现这类杂合体的活性极高,IC50低至14~75 nmol/L[49]。SAR显示,杂合体27的活性优于相应的28。其中,杂合体27d,e抑HCV聚合酶IC50分别为14和15 nmol/L,抑HCV复制子EC50分别为250和230 nmol/L,极具进一步开发前景。

图4 喹诺酮衍生物21~28的化学结构
一般而言,向4-喹诺酮的C-2位引入取代基会影响喹诺酮与拓扑异构酶IV和DNA促旋酶的结合,进而影响抗菌活性[50,51]。然而,研究显示,2-取代-4-喹诺酮衍生物如化合物29(图5)也具有良好的抗HCV活性,提示拓扑异构酶IV和DNA促旋酶可能并非这类化合物抗HCV的结合位点。对4-喹诺酮衍生物29的抑HCV基因分型2a亚型(Huh7.5.1细胞)活性测定结果表明,目标物的EC50为0.4~11.1 μmol/L[52]。SAR显示,向哌嗪的N-4位引入甲基比苄基更优。其中,化合物29f (EC50: 0.4 μmol/L)的活性最高,值得进一步优化。某些C-2位含有对氟苯基的喹诺酮衍生物30也具有潜在的活性,其活性主要取决于N-1位取代基[53]。SAR显示,N-1位为环丙基(30a, EC50: 4.1 μmol/L)或烯丙基(30b, EC50: 9.47 μmol/L)对活性有利,而无取代或异丙基、苄基和环己基取代的衍生物则未显示出任何活性。有趣的是,酯基衍生物的活性远优于相应的羧酸衍生物,这与抗菌活性大相径庭。
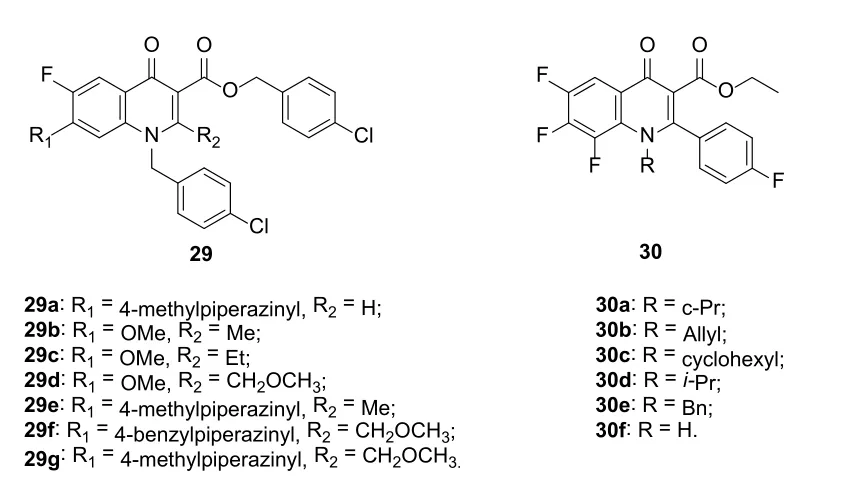
图5 C-2位含有取代基的喹诺酮衍生物29和30的化学结构
从狭叶芸香提取所得的山小橘碱(31)和pseudane IX (32)具有潜在的抗HCV活性(图6),IC50分别为6.4和1.4 μmol/L[54]。进一步研究显示,化合物32可通过降低HCV RNA复制水平和抑制病毒蛋白质的合成而诱导HCV凋亡。化合物33~37也具有潜在的抑制HCV复制活性(Huh-7细胞),EC50为0.96~202.7 μmol/L[55-57]。其中,化合物33e,f (EC50: 0.96和0.98 μmol/L)抑HCV复制活性最高,优于利巴韦林(EC50: 17.6 μmol/L)。值得一提的是,化合物33f对Huh-7细胞未显示出任何毒性,CC50>1000 μmol/L,可作为先导物进一步优化。
4 结束语
病毒性肝炎是全球第七大死亡原因,每年因此死亡的人数与结核病和艾滋病毒导致的死亡人数相当。未来20年内与病毒性肝炎相关的死亡将继续增加,其中乙肝和丙肝对患者的健康和生命危害极大,已成为严重的社会和公共卫生问题。近年来,随着抗病毒药物的广泛使用,HBV和HCV对药物的敏感性不断下降。为克服耐药性,同时降低毒性、提高疗效,亟需研发新型抗乙肝和丙肝药物。
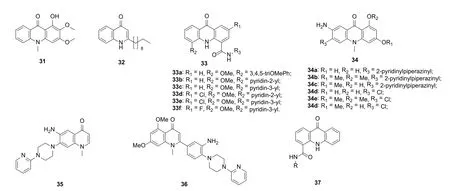
图6 喹诺酮衍生物31~37的化学结构
喹诺酮类化合物具有多种生物活性,且药代动力学性质和安全性良好,在临床上有着广泛的应用。近年来,研究人员对喹诺酮进行了系统而广泛的结构修饰,生物活性谱不断拓展,构-效关系不断完善。研究发现,喹诺酮类化合物是潜在的抗乙肝和丙肝候选物。其中的某些化合物如7d对HBsAg、HBeAg和HBV复制DNA具有良好的活性和选择性,抗HBsAg和HBeAg活性是对照拉米夫定的2700和1153倍,而化合物11d具有极高的体外活性和良好的体内药代动力学性质,极具进一步开发前景。本文着重介绍了近年来喹诺酮类化合物在抗HBV和HCV领域的最新研究进展,并归纳此类药物的SAR,以启迪科学家设计活性更高的候选物。
