RNA干扰PD-L1表达可下调肝癌细胞干性并增强放疗敏感性
2019-10-12戎晓东吴美萍蔡维洵陈炫光戎煜明
戎晓东 吴美萍 蔡维洵 陈炫光 戎煜明
华南国家肿瘤实验室/中山大学附属肿瘤防治中心1放疗科,3综合科(广州 510060);2中山大学孙逸仙纪念医院检验科(广州 510120)
PD-L1(CD274)作为介导肿瘤免疫逃逸过程中的负性调控分子,在多种肿瘤中表达异常,包括胶质母细胞瘤、胰腺癌、卵巢癌、乳腺癌、肾细胞癌、非小细胞肺癌、原发性肝癌等,且其高表达与肿瘤不良预后相关[1-5]。研究[6-7]证实,PD-L1不仅仅在肿瘤细胞上表达,而且在部分肿瘤干细胞(cancer stem cells,CSCs)上也有表达,包括头颈鳞癌CSCs、结直肠CSCs等。PD-L1可通过激活PI3K/AKT通路从而促进乳腺癌CSCs中OCT4、Nanog的表达[8]。然而在胆管细胞癌中,通过RNA干扰技术干扰PD-L1表达后小鼠更容易形成肿瘤,且“干性”增强,表现为ALDH+细胞比例增加,SOX2、OCT4、Nanog表达上调等。PD-L1在不同肿瘤CSCs中表现出相互矛盾的作用,这些证据表明,PD-L1在CSCs干性调节中发挥了不可或缺的作用,然而,其在肝癌CSCs中发挥的作用以及调节机制仍不明确。
CSCs是肿瘤发生的根源,是肿瘤放疗抵抗的根本。放疗在杀伤肿瘤细胞及肿瘤间质细胞的过程中能释放出大量的肿瘤抗原,且放疗后肿瘤中浸润的T淋巴细胞增多,因此,放疗与抗PD-1/PDL1免疫治疗在理论上是可行的。本研究拟初步探讨PD-L1在肝癌CSCs中的表达及其对放疗敏感性的影响,为肿瘤免疫治疗联合放疗提供更多的依据。
1 材料与方法
1.1材料人肝癌细胞株Huh-7细胞来自于南方医科大学南方医院中心实验室;19例新鲜肝癌组织来自于南方医院肝胆外科,患者均签署知情同意书;BALB/c-nu/nu裸鼠20只,4周龄,购自南京大学模式动物研究所;慢病毒PD-L1-shRNA-RFP订购于上海吉玛公司;CD133、EpCAM流式抗体购自R&D公司。
1.2方法
1.2.1PD-L1-shRNA转染Huh-7细胞用含10%胎牛血清、1%青链霉素的DMED培养基培养Huh-7肝癌细胞,于37℃、5%CO2培养箱中培养。待细胞生长至对数期且生长状态良好时,将感染复数为100且携带RFP的PD-L1-shRNA慢病毒感染Huh-7细胞,24~48 h后显微镜下观察转染效率。记为sh-PD-L1组。
1.2.2qRT-PCR检测细胞株及组织中干性基因及PD-L1的表达实时荧光定量PCR(qRT-PCR)试剂SYBR Premix Ex TaqTM购自TaKaRa公司。细胞及组织中RNA的提取按照试剂说明书进行,对提取的RNA进行逆转录,依照试剂盒说明书进行。按照SYBR Premix Ex TaqTM实时荧光定量PCR说明书进行。反应液混合均匀后,放入机器中进行反应,反应条件为:95℃预变性15 s,95℃变性5 s、57℃复性30 s,72℃延伸30 s,42个循环,最后进行熔解曲线扩增。通过相对定量来比较相关基因表达的差异。
1.2.3Western Blot检测感染细胞中PD-L1蛋白的表达水平RIPA裂解液和PMSF蛋白酶抑制剂按照100∶1混合后裂解Huh-7细胞,冰上裂解30 min,超声破碎2 min,4℃下12 000 r/min离心30 min,吸取上清提取蛋白,用BCA法测定蛋白浓度。配制聚丙烯酰胺凝胶,以总蛋白量50 μg/孔进行电泳分离蛋白,恒流300 mA湿转PVDF膜,5%脱脂牛奶封闭,加一抗PD-L1(1∶1 000)、GAPDH(1∶10 000),室温孵育2 h,加HRP 标记的二抗(1∶10 000),室温孵育1 h,ECL化学发光显影。
1.2.4肿瘤成球实验选取对数生长期的肿瘤细胞,胰酶消化后收集细胞,计数后用肿瘤球培养基将细胞浓度调整至(1~2)×106/mL,再取9 000个细胞铺在100 mm低黏附皿中培养,于37℃、5%CO2孵育箱中培养5~7 d后计数肿瘤球、拍照。
1.2.5CCK8实验检测放疗对肝癌细胞的抑制率取对数生长期的肿瘤细胞,胰酶消化后收集细胞,计数后将不同分组肝癌细胞接种至96孔板中,待细胞贴壁后行细胞照射(2 Gy),之后按照试剂盒说明书不同天数检测OD值计算抑瘤率。
1.2.6小鼠实验分别将转染sh-PD-L1及空白对照的Huh-7细胞制成5×107/mL的单细胞悬液,分别接种至小鼠左侧及右侧皮下,每日观察小鼠饮食、精神状况及体重等的变化,待7 d成瘤后行皮下瘤放疗,2 Gy/次,隔天1次,共行3次放疗。每2天测量瘤体的最大长径(a)以及与之垂直方向的最大横径(b),肿瘤体积按照公式:V(mm3)=a×b2/2。14 d后采用脱颈法处死小鼠,摘取肝癌瘤体,称重。
1.3统计学方法采用SPSS 13.0统计软件,两个独立组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1PD-L1在肝癌CSCs中表达上调已有研究表明CD133及EpCAM可作为肝癌CSCs的标记,利用流式分别分选出CD133、EpCAM阳性的肝癌细胞,利用qRT-CT检测其PD-L1的表达,结果表明,PD-L1在CD133、EpCAM阳性为代表的肝癌CSCs中表达显著上调(P<0.01,图1A)。进而利用qRT-PCR检测新鲜的肝癌组织中PD-L1及CD133、EpCAM基因的表达,结果表明PD-L1的表达与CD133、EpCAM表达呈正相关(r=0.7936、0.8604)。见图1B、C。以上结果表明,PD-L1在肝癌CSCs中表达上调,提示PD-L1在对肝癌干性调节可能发挥一定的作用。
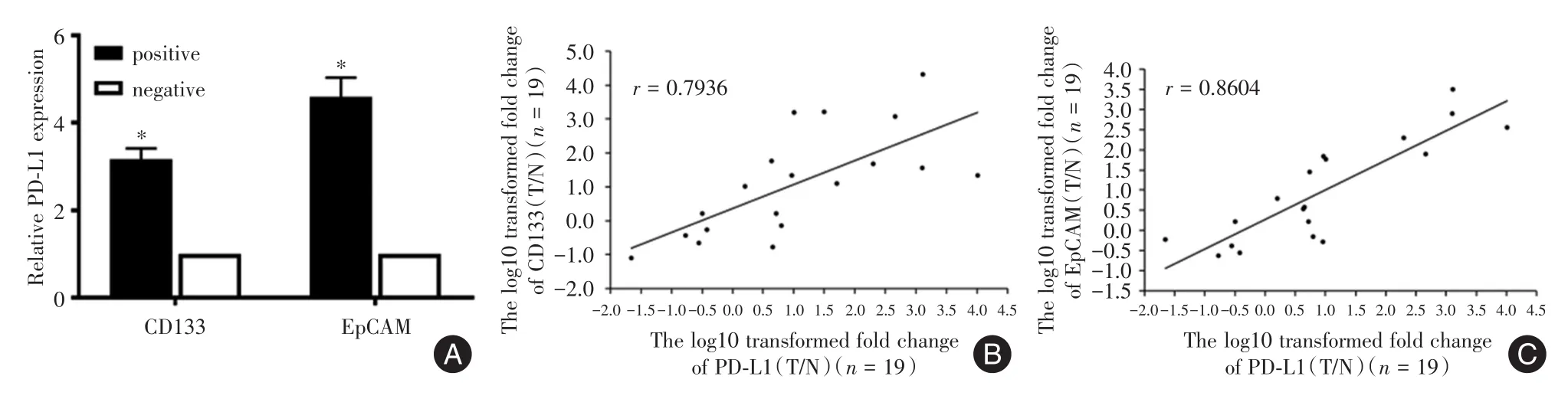
图1 PD-L1在肝癌CSCs中表达上调Fig.1 PD-L1 expression is up-regulated in hepatocellular carcinomacells
2.2利用RNA干扰技术构建PD-L1表达下调的肝癌细胞株为了进一步探讨PD-L1在肝癌CSCs中发挥的作用,利用RNA干扰技术下调肝癌细胞Huh-7中PD-L1的表达,qRT-PCR(图2A)及Western Blot(图2B)证实PD-L1在sh-PD-L1组Huh-7肝癌细胞中表达下调。
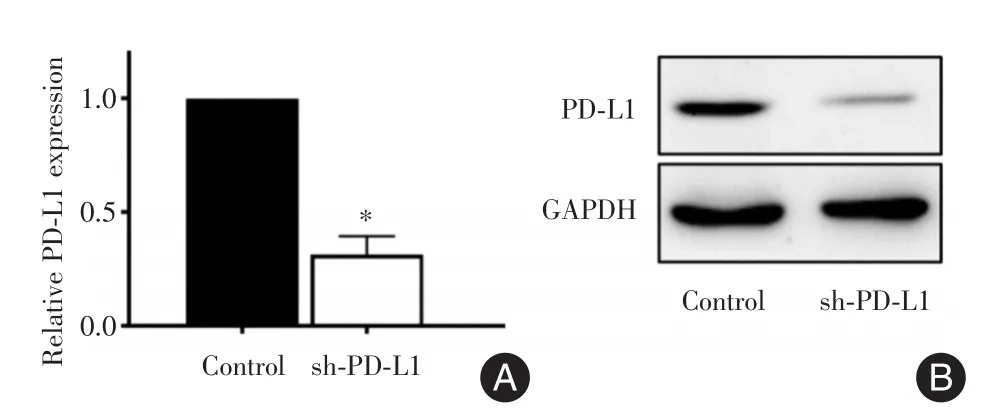
图2 PD-L1在肝癌细胞中表达下调Fig.2 PD-L1 expression is down-regulated in hepatocellular carcinoma cells
2.3干扰PD-L1表达后下调肝癌肿瘤细胞干性通过qRT-PCR检测干性基因表达的情况发现,干扰PD-L1表达后,肝癌干性基因CD133、EpCAM、Nanog均有不同程度下调(图3A)。结果表明,干扰PD-L1表达后,肿瘤成球能力下降(图3B、C)。
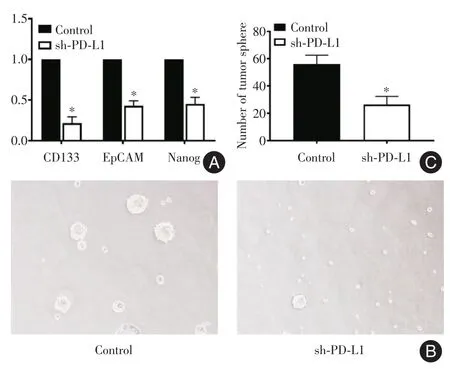
图3 干扰PD-L1表达后下调肝癌肿瘤细胞干性Fig.3 PD-L1 down-regulation led to inhibition of HCC stemness
2.4干扰PD-L1增强肝癌细胞的放疗敏感性CCK8检测提示PD-L1表达下调组与对照组增殖能力没有差异(图4A),利用上述细胞检测PD-L1表达下调对放疗敏感性的影响。PD-L1下调后肝癌细胞在体外对放疗更敏感(图4B)。小鼠体内实验表明,PD-L1下调可显著提高放疗的疗效,sh-PD-L1组小鼠肿瘤体积(图4C)、瘤质量均较对照组显著下降(P<0.05,图4D、E)。
3 讨论
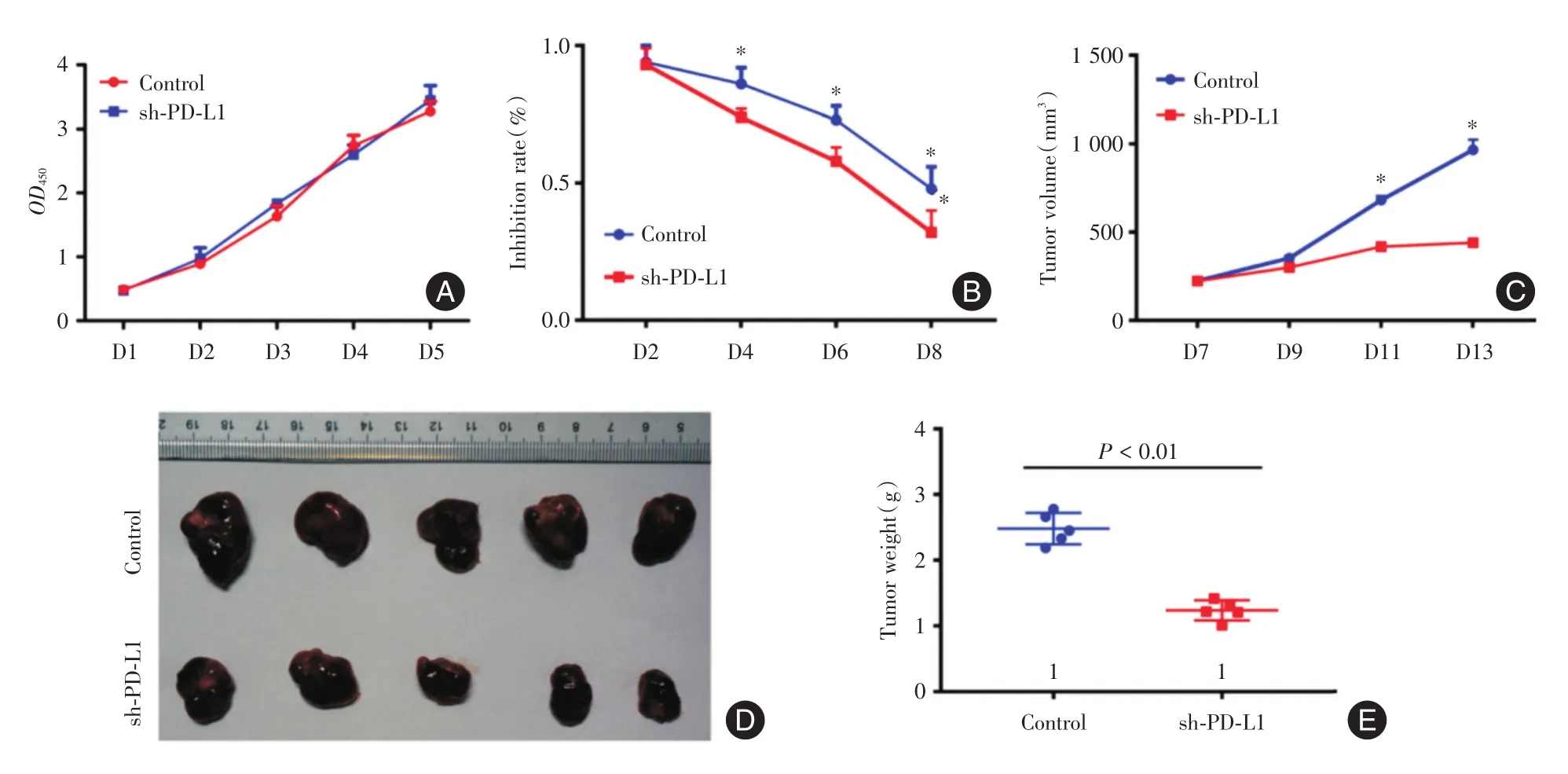
图4 干扰PD-L1可增强肝癌细胞的放疗敏感性Fig.4 PD-L1 down-regulation led toincreased radiation sensitivity
CSCs是一类具有自我更新能力、无限增殖能力以及多向分化潜能的原始细胞[9]。目前认为,CSCs的肿瘤发生的根源,是肿瘤复发、转移与放化疗抵抗的根本[14]。因此,为获得理想的抗癌效果,有效清除CSCs至为重要。既往研究表明,PD-L1在肿瘤CSCs中发挥了重要的调控功能[6-7],然而,其在肝癌CSCs中的表达及功能目前尚未见明确的报道,本研究首次证实,在肝癌CSCs中PD-L1表达上调,而通过RNA干扰技术下调PD-L1表达后肝癌的“干性”下降,提示PD-L1有可能作为一个针对肿瘤干细胞的治疗靶点。PD-1/PD-L1单抗为代表的免疫检查点抑制剂在多种肿瘤治疗中均有报道[15]。如何在现有的基础上进一步提高PD-1/PD-L1单抗的疗效是目前研究的重点。
近年研究发现,放疗也可激活抗肿瘤免疫反应[10-13]。研究表明放疗可通过增强抗原递呈作用促进免疫应答,促进树突状细胞的活化、成熟[10-11]。此外,放疗可通过诱导T细胞应答提高肿瘤淋巴引流区T细胞的增殖活化,增强CD8+T细胞介导的抗肿瘤效应[12]。CHAKRABORTY等[13]研究表明放疗后肿瘤组织中浸润的淋巴细胞增多,提示放疗可以改造肿瘤免疫微环境,实现“冷肿瘤”到“热肿瘤”的免疫微环境改造,基于此,放疗联合PD-1/PD-L1单抗免疫治疗理论上是可行的,有希望能达到1+1>2的疗效。本研究中发现,干扰PD-L1的表达后,肿瘤细胞不管在体外细胞水平,或是在小鼠体内水平,对放疗射线的敏感性均有不同程度的提高,进一步支持放疗与PD-1/PD-L1单抗的联用。
综上所述,本研究初次探讨了PD-L1在肝癌CSCs中的表达,同时发现PD-L1表达下调后肝癌放疗敏感性提高,为后续PD-1/PD-L1单抗联合放疗理论提供依据。
