MTNR1Brs10830962和CDKAL1rs7754840基因多态性与妊娠期糖尿病发病的关系
2019-10-12郭绮棱王瑞李伟玲索冬梅
郭绮棱 王瑞 李伟玲 索冬梅
佛山市妇幼保健院产科(广东佛山528000)
妊娠期糖尿病(gestational diabetes mellitus,GDM)被定义为葡萄糖耐受不良疾病,研究[1]表明全球约14%的孕妇在妊娠期合并葡萄糖耐受不良。GDM与孕妇不良妊娠结局风险及胎儿合并慢性代谢疾病的风险密切相关。研究[2]表明,遗传易感性是GDM发病的重要风险因素。rs10830962是褪黑激素受体1B(melatonin receptor 1B,MTNR1B)基因的多态性位点之一,MTNR1B是影响代谢控制并增加患糖尿病风险的重要基因[3]。褪黑素受体2(melatonin receptor 1B,MT2)由MTNR1B基因编码,在人的胰岛β细胞上表达,且影响胰岛β细胞的功能[4]。既往研究[5]发现韩国人群中rs10830962和rs7754840两个单核苷酸多态性(SNPs)在全基因组关联分析(Genome-wide association study,GWAS)目录被确认为GDM主要的相关基因。而rs7754840是CDK5调节亚单位相关蛋白1类似物1(CDK5 regulatory subunit associated protein 1-like 1,CDKAL1)基因的多态性位点,同时CDKAL1基因能抑制胰腺β细胞CDK5的活性,能预防糖毒性引起的胰岛素基因的下降[6]。韩国的研究[7]队列确认rs7754840与韩国人GDM的胰岛素分泌能力密切相关。而rs7754840在埃及和俄罗斯人口中没有观察到显著的相关性[8]。目前对于rs10830962和rs7754840鉴于不同的遗传背景具有差异,且这两个基因位点在我国的孕妇人群中与GDM的关系仍未明确。本研究拟探讨孕妇rs10830962和rs7754840基因位点多态性与GDM发病的关系。
1 资料与方法
1.1一般资料选取2016年7月至2019年2月于佛山市妇幼保健院接受孕期检查确认为GDM的孕妇共473例作为GDM组,纳入标准:(1)符合GDM的诊断标准[9]:75 g口服葡萄糖耐量试验(OGTT)后空腹血糖≥5.5 mmol/L,餐后1 h血糖≥10.0 mmol/L或餐后2 h血糖≥ 8.0 mmol/L;(2)年龄为18~40岁;(3)获得患者知情同意。排除标准:(1)怀孕前合并糖尿病;(2)合并机体免疫性疾病;(3)合并其他遗传或代谢性疾病。选取同期年龄项匹配的孕检健康孕妇516例作为对照组;对照组孕妇的纳入标准为18~40岁,排除妊娠糖尿病或糖耐量受损、妊娠高血压,排除恶性肿瘤、心脑血管疾病、肝、肺、肾、胰疾病,排除自身免疫性疾病,以及合并甲状腺相关疾病的孕妇。本研究获得医院伦理委员会审核通过。通过病历和随访中收集了本研究两组孕妇的一般资料,包括孕妇年龄、孕前体重指数、胎次、异常妊娠史和糖尿病家族史。
1.2检测方法MTNR1B基因rs10830962位点和CDKAL1基因rs7754840位点的多态性检测:对所有纳入研究的孕妇清晨空腹抽取静脉全血,采用抗凝保存,采用使用DNA纯化试剂盒(Tiangen Biotech Co.Ltd.,北京,中国),对所采集的全血外周血样品中提取基因组DNA并纯化后,采用PCR法对扩增相应的基因位点,具体的引物为:rs10830962:F:5′-TACTAGATATTAGCTGTGTGCTAGTGACT-3′;R:5′-TCTGGGCAACTCAGTGAAACC-3′;rs7754840:F:5′-AATTAATATTCCCCCCTGTATTTTAGT-3′;R:5′-GCTCATTGCTACATAACTGTAGAT-3′。扩增条件:95 ℃,7 min;95 ℃,30 s;60 ℃,30 s;72 ℃,60 s,35次循环;72℃,10 min,PCR操作由本院检验科进行。将每份样本PCR获得的产物送广州金域医学检验中心进行测序序列分析。
1.3统计学方法采用SPSS 23.0软件进行数据统计分析。计量资料采用s表示,计数资料采用百分比表示。通过卡方检验(分类变量)或t检验(连续变量)计算GDM组和对照组之间的人口统计特征分布的差异。等位基因和基因型分布是否符合平衡采用Hardy-Weinberg检验。Logistic回归分析计算优势比(OR值)和95%置信区间评价基因多态性与GDM临床特征的关联强度。P<0.05被认为差异具有统计学意义。
2 结果
2.1两组孕妇一般资料比较所纳入研究的两组孕妇的平均年龄和孕前体质量指数对比差异无统计学意义(P>0.05),GDM组的经产妇比例、异常妊娠史和合并糖尿病家族史的孕妇比例显著高于对照组,差异具有统计学意义(P<0.05)。见表1。
表1 两组孕妇的一般资料比较Tab.1 Comparison of general data between two groups of pregnant women ± s

表1 两组孕妇的一般资料比较Tab.1 Comparison of general data between two groups of pregnant women ± s
项目GDM组(n=473)对照组(n=516)t/χ2值P值年龄(岁)孕前体重指数(kg/m2)胎次(初产/经产,例)异常妊娠史[例(%)]糖尿病家族史[例(%)]29.8±3.8 22.5±1.9 396/77 37(7.8)51(10.8)30.1±3.6 22.4±2.1 463/53 22(4.3)35(6.8)1.275 0.783 7.802 5.572 4.972 0.203 0.434 0.005 0.018 0.026
2.2rs10830962和rs7754840位点多态性与GDM的关系GDM组和对照组孕妇的基因型分布如表2所示,处于Hardy-Weinberg平衡(P>0.05)。GDM组和对照组MTNR1B的rs10830962位点其等位基因分布对比差异具有统计学意义(χ2=6.472,P=0.039),调整年龄相关因素后,隐GDM组GG型基因携带比例高于对照组(OR=1.37),95%CI:1.07~1.74,P=0.021)。GDM组rs10830962位点风险等位基因(G)的频率为47.0%,而对照组为41.8%,GDM组s10830962位点的风险等位基因(G)的频率显著高于对照组(χ2=5.570,P=0.018)。而GDM组和对照组孕妇CDKAL1的rs7754840位点基因分布对比差异无统计学意义(χ2=0.631,P=0.729)。见表2。

表2 rs10830962和rs7754840位点多态性与GDM发生的关系Tab.2 Relationship between rs10830962 and rs7754840 polymorphisms and GDM 例(%)
2.3rs10830962基因型与GDM孕妇临床特征的分层分析rs10830962基因型与GDM孕妇的年龄、孕前体重指数、胎次没有显著的相关性(P>0.05),而与异常妊娠史和糖尿病家族史呈显著的相关性(P<0.05),随着GG基因型频率的增加,其异常妊娠史和糖尿病家族史比例增加。rs10830962位点GG基因型频率与GDM孕妇的异常妊娠史(OR=1.68,95%CI:1.22~ 2.13)和糖尿病家族史风险均呈显著的相关性(OR=1.46,95%CI:1.19~1.97)。见表3。

表3 rs10830962基因型与GDM孕妇临床特征的分层分析Tab.3 Hierarchical analysis of clinical characteristics of rs10830962 genotype and GDM pregnant women
2.4rs10830962位点多态性与GDM发生的多元Logistic回归分析多元Logistic回归分析显示异常妊娠史(OR=1.75,95%CI:1.36 ~ 2.43,P=0.019)、糖尿病家族史(OR=1.64,95%CI:1.21~ 2.06,P=0.038)以及rs10830962基因型(OR=1.33,95%CI:1.09~1.84,P=0.041)均为GDM发生的风险因素。见表4。
3 讨论
遗传因素是GDM发病的重要因素,虽然既往研究[6-7]表明了MTNR1B和CDKAL1基因与糖尿病密切相关,但该基因与GDM发生的关系,特别在国内人群中并未明确。同时,MTNR1B基因的rs10830962位点和CDKAL1基因的rs7754840位点目前已经被GWAS目录被确认为GDM主要的相关基因位点。因此,本研究首次探讨了我国人群中rs10830962和rs7754840位点多态性与GDM发生的关系。本研究结果表明,rs10830962(C>G)会增加患GDM的风险。进一步分析rs10830962多态性与临床特征的关系发现,rs10830962多态性与GDM孕妇的异常妊娠史和糖尿病家族史均呈显著的相关性,表明了rs10830962多态性可能参与GDM的发病机制。
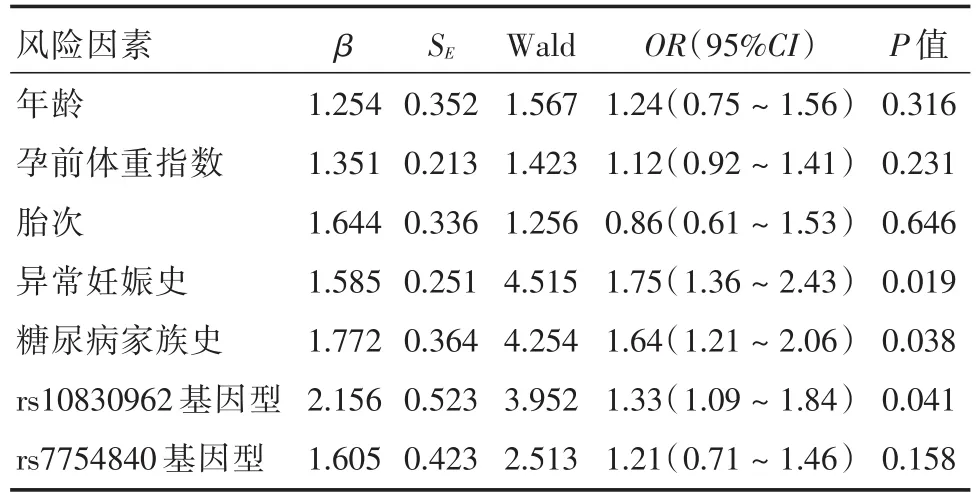
表4 rs10830962位点多态性与GDM发生的多元Logistic回归分析Tab.4 Multivariate logistic regression analysis of rs10830962 polymorphism and GDM
本研究结果证实,rs10830962的次要等位基因增加了中国人群的GDM风险,本研究结果与韩国人群的结果一致,表明了rs10830962在亚洲人种中具有普遍性,本研究也初步揭示了rs10830962在中国人群中与GDM发生的关系。既往研究[6]中,rs10830962的次要等位基因与GDM女性空腹胰岛素浓度降低有关,这种多态性也决定了葡萄糖刺激胰岛素分泌和血浆葡萄糖的浓度,从而增加了欧洲人群的2型糖尿病发生的风险[10]。由于降低的β细胞胰岛素分泌功能在GDM和2型糖尿病中起重要作用,因此rs10830962其具体可能影响了β细胞功能从而导致GDM的发生。rs10830962位于MTNR1B上游4.4 kb处[11]。生物信息学分析显示rs10830962位于胰岛的功能元件中并改变基序结合。在改变的基序中,肝细胞核因子1(hepatocyte nuclear factor 1,HNF1)是肝脏或胰腺β细胞的主要反式作用因子,靶向参与碳水化合物代谢的多个基因[12]。HNF1基序的结合可以直接激活β细胞基因并直接影响胰腺β细胞中葡萄糖刺激的胰岛素分泌[13],因此rs10830962的C至G碱基变化可能会干扰HNF1结合,调节β细胞基因表达,从而对β细胞功能产生有害影响。因此,rs10830962如何通过调节β细胞影响GDM的发病机制仍值得进一步深入研究。
此外,在本研究中,CDKAL1基因的rs7754840位点多态性与GDM发生的风险之间没有显著的相关性。本研究结果与国外人群结果相一致[14],虽然韩国、高加索人和南印度人群的研究显示rs7754840与GDM风险之间存在显著关联[15-16]。这种差异可能是由于种族、样本量和GDM诊断标准导致的差异。本研究进一步分析MTNR1B基因rs10830962多态性与GDM孕妇临床特征的关系,rs10830962基因型与GDM孕妇的年龄、孕前体质量指数、胎次没有显著的相关性,而与GDM孕妇的异常妊娠史和糖尿病家族史风险均呈显著的相关性。随着rs10830962位点GG基因型频率的显著增加,异常妊娠史增加,且糖尿病家族史比例增加。虽然既往有报道[17]显示高龄、肥胖、喜欢吃甜食、糖尿病家族史是GDM发生的高危因素,但本研究结果也进一步通过多元Logistic回归分析发现,rs10830962基因型与GDM孕妇的异常妊娠史和糖尿病家族史风险均呈显著的相关性,同时进一步采用多元Logistic回归分析确认了rs10830962基因型是GDM发生的风险因素。这些结果提示,rs10830962位点具有GG基因型孕妇的异常妊娠概率更高,且具有遗传性,从而影响妊娠期间糖尿病的发生。因此,对于妊娠期妇女,孕前进行rs10830962位点多态性的筛查,将有助于评估GDM的发生风险,以进行提前积极干预和预防。
本研究也存在一定的局限性,由于纳入的样本量比较少,而且具有地区局限性,仍需要进一步增加不同地区的样本量以评估综合rs10830962基因型与GDM发生风险的关系。综合上述,MTNR1B基因的rs10830962多态性与GDM发生风险密切相关,具有GG基因型的孕妇其GDM发生风险显著增加。
