体外冲击波结合骨髓间充质干细胞移植治疗兔骨不连的疗效
2019-10-12樊涛郭荣郑彭
樊涛 郭荣 郑彭
南方医科大学珠江医院康复医学科(广州 510282)
骨不连是临床上的常见难题,保守治疗效果差,目前治疗骨不连的主要手段是自体骨移植手术,但手术创伤较大,风险较高,容易发生取骨区感染、感觉障碍、血肿等并发症[1],寻求一种安全有效的治疗方法已成为研究的方向和热点。大量研究表明体外冲击波(extracorporeal shock waves,ESW)促进骨折愈合疗效确切,但目前还不清楚ESW促进骨折愈合的确切机制[2]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)可在特定诱导条件下分化为成骨细胞等,促进骨折愈合[3];但BMSCs在骨髓中只占0.001% ~0.01%,含量极少,因此,提高BMSCs的含量在治疗骨不连中非常重要。BMSCs在增殖与分化过程中需要力学因素的刺激,冲击波是一种力学机械刺激,可促进局部 BMSCs的增殖[4]。BMSCs移植治疗骨不连取得了一定的治疗效果,但是将ESW结合BMSCs移植治疗骨不连却鲜有报道,本课题通过动物实验,观察ESW结合BMSCs治疗兔骨不连的疗效,并探讨其机制。
1 材料与方法
1.1实验动物的分组选用健康成年中国家兔54只,体质量2.5~3.1 kg,由南方医科大学实验动物中心提供,采用随机数字表方法分3组。A组:ESW(翔宇医疗设备有限责任公司,XY-K-SHOCKMASTER 500标准款)结合BMSCs组;B组:ESW组;C组:完全对照组。
1.2骨不连模型的制作实验动物采用速眠新与氯氨酮1∶1比例0.25 mL/kg肌注麻醉后,常规消毒铺巾,在右前臂桡侧沿桡骨作一长2 cm切口,显露桡骨,在距桡骨远端2 cm处截骨,制作1 cm骨缺损(包括骨膜)。术后12周拍X线片明确为桡骨骨不连(骨缺损间距未见缩小,未见到骨痂形成,明确为桡骨骨不连)。
1.3兔BMSCs的分离、培养、鉴定[5]取A组的兔子,抽取股骨中下1/3肝素化骨髓血3 mL,通过Percoll分离液梯度离心,获取兔BMSCs,加入DMEM培养液进行培养;培养48 h后进行第1次换液,以后每3天换1次液,在倒置显微镜下观察细胞生长情况,2周后基本长满培养瓶。当细胞生长至90%融合时,进行传代培养。计P3、P4代BMSCs细胞数,达到1×106/mL即可用于移植。
1.4兔骨不连治疗实验对A组兔子进行无菌麻醉,在透视下,用l mL的注射器取调整好的0.5 mL自体BMSCs细胞悬液注射到骨不连断端处约4 mm深。A组兔子在自体BMSCs移植治疗后2~3 d,无不良反应,进行ESW治疗;B组兔子骨不连断端采用ESW治疗。冲击波参数:电压:8.5 kV,频率:60次/min,能流密度为0.30 mJ/mm2,分别对准骨不连近、远端边缘相对应部位,每端击打1 000次,每隔3~5 d治疗1次,共治疗3次。
1.5观察指标
1.5.1一般观察结果观察术后及治疗后兔的进食、活动及精神状况。
1.5.2X线拍片观察骨不连模型12周后行X线拍片(X线摄片机,型号BFG-400,南京医疗设备制造厂),并分别于治疗后4、8、12周重复拍片,均拍麻醉后侧卧位片,由同一位医生使用同一台X线机拍片。X线评分标准参考Lane-Sandhu法[6],评价指标为骨形成情况、骨连接情况及骨髓腔改建程度,判断骨不连愈合情况。见表1。
1.5.3组织学检查分别在骨不连治疗后4、8、12周拍片后各组随机处死6只兔子,均取原骨不连部位修复组织进行脱钙、固定、石蜡包埋、切片,H-E染色后光镜检查组织情况。根据KHADRA等[7]和PRETEL等[8]的研究,制定组织学评分标准(表2)。
1.6统计学方法应用SPSS 19.0统计软件,计量资料以s表示,两组间均数比较采用t检验,多组间均数比较采用单因素方差分析。P<0.05为差异有统计学意义。
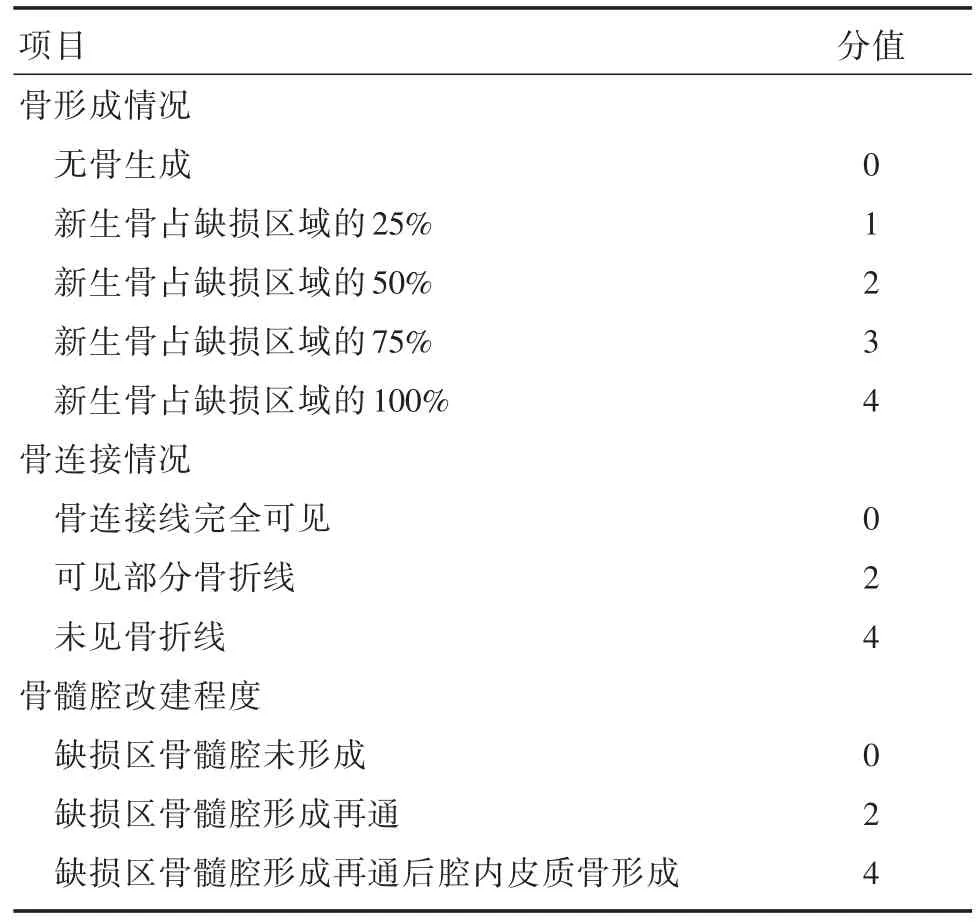
表1 Lane-Sandhu法X线评分标准Tab.1 Lane-Sandhu method X-ray scoring standard

表2 骨组织的形成和质量评定标准Tab.2 Bone tissue formation and quality assessment criteria
2 结果
2.1一般观察结果A组兔子自体BMSCs移植后,未出现不良反应。2只兔子麻醉意外死亡,重新纳入2只兔子,总数不变。在ESW治疗后24 h,A、B组兔骨不连处均可见不同程度的皮下瘀血,但未明显影响兔子饮食和活动。
2.2X线检查及放射学评分
2.2.1X线检查治疗后4周时,A、B组骨不连处略见模糊骨痂形成,影像呈薄云雾状;C组未见骨痂形成。治疗后8周时,A组骨痂逐渐增多,骨髓腔基本通畅,但骨纹理较乱;B组骨不连区两端可见明显新生骨痂;C组未见明显变化。治疗后12周时,A组整个骨不连区均可见新生骨痂,形成骨不连区的桥接,骨不连区骨髓腔形成再通后腔内皮质骨形成;B组整个骨不连区均可见新生骨痂,骨髓腔未形成;C组未见明显新生骨痂形成。
2.2.2放射学评分见表3。治疗后4周时,A组和B组评分均增加,C组评分未见明显增加,A组与B组比较差异无统计学意义(P>0.05),与C组比较差异均有统计学意义(P<0.05);治疗后8周时,A组评分较B、C组均明显增加,A组与B、C组比较差异均有统计学意义(P<0.05),B组评分增加,C组评分未见明显增加,B组与C组比较差异有统计学意义(P<0.05);治疗后12周时,A组评分较B、C组均明显增加,A组与B、C组比较差异均有统计学意义(P<0.05),B组评分明显增加,C组评分稍有增加,B、C组比较差异有统计学意义(P< 0.05)。
表3 各组治疗后4、8、12周Lane-Sandhu法X线评分比较Tab.3 Comparison of Lane-Sandhu X-ray scores at 4,8,and 12 weeks after treatment in each group(n=18) ±s
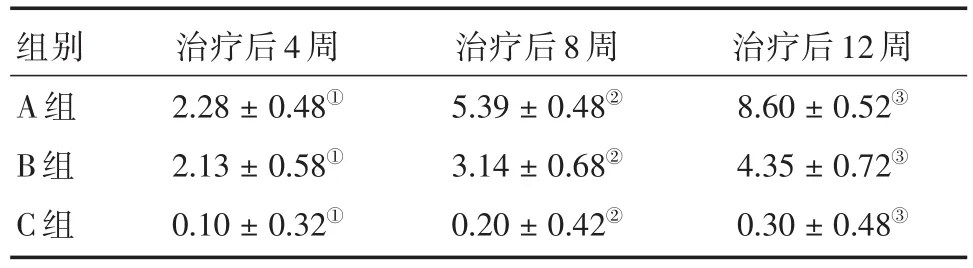
表3 各组治疗后4、8、12周Lane-Sandhu法X线评分比较Tab.3 Comparison of Lane-Sandhu X-ray scores at 4,8,and 12 weeks after treatment in each group(n=18) ±s
注:①A组与B组比较,P>0.05;A、B组分别与C组比较,P<0.05;②A组分别与B、C组比较,P<0.05;B组与C组比较,P<0.05;③A组分别与B、C组比较,P<0.05;B组与C组比较,P<0.05
组别A组B组C组治疗后4周2.28±0.48①2.13±0.58①0.10±0.32①治疗后8周5.39±0.48②3.14±0.68②0.20±0.42②治疗后12周8.60±0.52③4.35±0.72③0.30±0.48③
2.3组织学观察及评分结果
2.3.1组织学观察A组:治疗后4周时骨不连区周围有少量的纤维组织包绕,中等软骨痂量,少量炎症细胞侵入;治疗后8周时骨不连区骨痂量明显增加,可见散在骨小梁形成;治疗后12周时骨不连区大量成熟骨痂形成,可见骨小梁形成。B组:治疗后4周时空腔内血管纤维组织长入,可见少量成骨细胞;治疗后8周时骨不连区有软骨痂形成;治疗后12周时骨不连区少量成熟骨痂形成,骨小梁结构不明显。C组:纤维组织长满骨不连区,未见明显骨痂形成。
2.3.2组织学评分治疗后4周时,A组评分增加,B、C组评分未见明显增加,A组与B、C组比较差异均有统计学意义(P<0.05),B组与C组比较差异无统计学意义(P>0.05);治疗后8周时,A组评分明显增加,B组评分增加,C组评分稍增加,A组与B、C组比较差异均有统计学意义(P<0.05),B组与C组比较差异有统计学意义(P<0.05);治疗后12周时,A组评分明显增加,B组评分增加,C组评分稍增加,A组与B、C组比较差异均有统计学意义(P<0.05),B组与C组比较差异有统计学意义(P<0.05)。见表4。
3 讨论
ESW利用液电转化及传递原理,造成不同密度组织之间产生能量梯度差及扭拉力,以达到治疗疾病的目的[9]。ESW在以往常被用来治疗骨科疾病,如肌腱末端病,慢性足底筋膜炎、肱骨外上髁炎和骨不连等[10-12]。ALVAREZ 等[13]运用 ESW治疗跖骨近端骨不愈合或骨不连时,1年后达到90%的成功治愈率。ESW治疗骨不连的作用机制,目前尚未完全清楚。实验研究表明,ESW对骨组织直接作用后可以造成骨膜下点状出血,产生微骨折和大量细小的骨碎片,造成局部微损伤,并可能有骨折血肿形成,从而刺激骨痂形成,促进骨折愈合[14]。国内外大量动物实验和临床研究发现ESW作用于骨组织后,能够改善局部微循环,激活处于静止状态的对骨折愈合具有重要意义的成骨细胞和原始成纤维细胞等细胞,增强其成骨活性,促使骨形态生成蛋白(BMP)、转化生长因子β(TGF-β)等诱导成骨的介质释放增加[15]。BMP、TGF-β等具有诱导间充质细胞迁徙、增殖、分化,最终导致软骨、骨形成的作用[16],可重新启动骨折愈合过程。
表4 各组治疗后4、8、12周修复区组织学评分比较Tab.4 Comparison of histological scores in repaired areas at 4,8,and 12 weeks after treatment(n=18) ±s
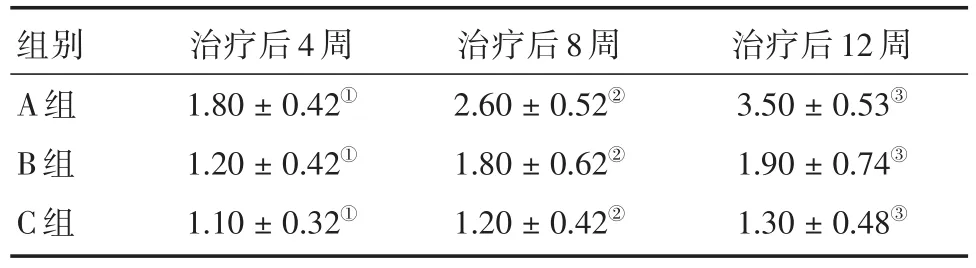
表4 各组治疗后4、8、12周修复区组织学评分比较Tab.4 Comparison of histological scores in repaired areas at 4,8,and 12 weeks after treatment(n=18) ±s
注:①A组分别与B、C组比较,P<0.05;B组与C组比较,P>0.05;②A组分别与B、C组比较,P<0.05;B组与C组比较,P<0.05;③A组分别与B、C组比较,P<0.05;B组与C组比较,P<0.05
组别A组B组C组治疗后4周1.80±0.42①1.20±0.42①1.10±0.32①治疗后8周2.60±0.52②1.80±0.62②1.20±0.42②治疗后12周3.50± 0.53③1.90± 0.74③1.30± 0.48③
骨不连为骨折愈合修复过程停止。依据组织微损伤理论,在骨不连组织的局部创造一个新的微损伤环境,可重新启动骨折修复,其释放的生物活性因子不但会激活组织自身的修复能力,还能促进移植或者迁移到局部的BMSCs在损伤局部微环境刺激下趋化、生长,启动BMSCs的定向分化,从而促进组织的再生与修复[17]。
研究表明,骨折的修复过程存在软骨成骨和膜内成骨两种骨化形式,无论哪种形式,都需要骨折部位聚集足够数量的BMSCs,再由BMSCs分化成软骨或成骨细胞。因此BMSCs就成为治疗骨不连的理想种子细胞,向骨不连部位引入足够的干细胞是促进骨修复的前提条件[18],但BMSCs在骨髓中只占0.001%~0.01%,笔者利用这一原理,将BMSCs移植和ESW治疗相结合进行本实验。笔者参考Lane-Sandhu法,以骨形成情况、骨连接情况、骨髓腔改建程度为评价指标,进行放射学评分,判断骨不连愈合情况,其信度及效度已得到检验,能够客观反映骨不连的愈合情况。本实验结果提示,ESW结合BMSCs移植治疗骨不连和单纯的ESW治疗均有效,ESW结合BMSCs移植治疗骨不连较单纯的ESW治疗效果更好。BMSCs具有自我更新及多向分化的能力,能通过增殖与分化维持自身细胞的数量,并可在适当的条件下分化成骨细胞、神经细胞、脂肪细胞、神经胶质细胞和内皮细胞等[9],满足骨不连区域的修复需要。BMSCs不仅可直接迁移、分化为成骨细胞,还可以通过分泌各种生物活性分子及细胞外膜泡等调节损伤区域的血管形成、抑制成骨纤维化、抗细胞凋亡及调节成骨分化等[19],这些作用对骨不连治疗均有重要意义。BMSCs在增殖与分化过程中需要力学因素的刺激,冲击波是一种力学机械刺激,通过力-化学信号转换将这种刺激转化成生物应答,促进局部BMSCs的增殖,提高BMSCs的数量,以满足组织修复或重建,从而加速骨缺损修复[4]。ESW干预BMSCs成骨作用存在剂量效应依赖关系。MARTINI等[20]研究不同剂量ESW对羊初级母细胞的作用效应,结果发现能量<0.31 mJ/mm2时对骨细胞的生长有明显的促进作用,大于此值时可引起骨细胞的损伤,故本实验使用的ESW能量为0.30 mJ/mm2。
综上所述,ESW结合BMSCs移植治疗兔骨不连和单纯的ESW治疗均有效,ESW结合BMSCs移植治疗兔骨不连较单纯的ESW治疗效果更好。关于ESW促进BMSCs的增殖及分化为成骨细胞的机制已有一些研究,但仍未完全清楚。因此,研究ESW如何促进BMSCs的增殖及分化为成骨细胞的机制将是下一步研究的方向。
