低场核磁共振及成像技术分析天花粉干燥过程中水分变化规律
2019-10-11任永申郑尧雷蕾艾娇梁帅邓鑫汪兰
任永申,郑尧,雷蕾,艾娇,梁帅,邓鑫,汪兰
(1中南民族大学 药学院,武汉 430074;2 湖北省农业科学院 农产品加工与核农技术研究所,武汉 430064)
中药干燥过程是中药加工的重要环节,干燥工艺及终点控制将直接影响产品的品质和疗效.目前《中国药典》收录品种中90%以上的中药饮片是干制饮片,然而长期以来对中药干制过程及工艺条件设定不够重视,对干燥过程多仅以“阴干/晒干”描述,对工艺条件无具体要求,对干燥终点无准确判定指标,严重影响中药饮片质量的一致性、稳定性,给中药安全有效用药带来较大的挑战.鉴于当前中药材供应来源分散、产地加工条件参差不齐、水分控制模糊等因素,深入开展干制过程中水分变化规律研究,对规范中药加工过程、科学界定干制工艺终点、保障中药材质量等具有重要意义.
低场核磁共振(LF-NMR)和磁共振成像(MRI)是利用氢原子核在磁场中的自旋弛豫特性,通过弛豫时间的变化从微观的角度解释样品中水分的分布变化和迁移情况[1,2].由核磁共振原理可知,样品中氢质子(H)横向弛豫时间(T2)因化学环境而不同,T2的大小反映样品中水分自由度的大小,T2越长说明样品与水分的结合度越小,流动性越大,可用以表征样品干燥过程中水分的迁移规律.LF-NMR被公认为是调查各种食物中水的状态、流动性和分布的有力工具,并可为水迁移提供直接信息,由于可以准确表征样品中自由水、半结合水、结合水的水分分布状态,现已成为水分探测领域的重要新兴手段[3-6].
天花粉为葫芦科植物栝楼TrichosantheskirilowiiMaxim或双边括楼TrichosanthesrosthorniiHarms的干燥根,甘、微苦,微寒,归肺、胃经,具有清热泻火,生津止渴,消肿排脓的功效,用于热病烦渴,肺热燥咳,内热消渴,疮疡肿毒[7].天花粉为常用根类药材,常鲜用或干燥使用;鲜品含水量高,干燥周期长,受干燥条件影响大,自然干燥过程中易发生复杂的成分转化或变质,但目前尚缺乏对天花粉干燥过程中水分的状态和含量变化的研究.由此,以天花粉为例,采用低场核磁技术,考察在不同干燥温度、不同干燥时间下天花粉水分含量及状态(自由水、束缚水分布)的变化规律,从而为优化干燥工艺及准确界定干燥终点提供科学依据.
1 材料与方法
1.1 药材、试剂与仪器
新鲜天花粉(栝楼)采集于湖北巴东,经鉴定为葫芦科植物栝楼TrichosantheskirilowiiMaxim的根.
核磁共振成像分析仪(NMI20-025V-1,苏州纽迈分析公司),共振频率21.3 MHz,磁体强度0.55 T,线圈直径25 mm,磁体温度32 ℃;干燥箱(WGL-2308,天津泰斯特公司).
1.2 天花粉干燥条件
将新鲜天花粉洗净,剖为四瓣,切成5 mm厚片,每组设置3个平行样本,置于干燥箱中,分别选择 40、50、60 ℃进行干燥.隔一定时间取样,称定,低场核磁检测、MRI成像检测(表1).

表1 天花粉干燥工艺及取样时间
1.3 低场核磁法测定样品横向弛豫时间
取样后,将样品降至室温后称量,然后放入永久磁场中心位置的直径为25 mm的玻璃管中,利用硬脉冲自由感应衰减(FID)序列获得样品中心频率,再利用CPMG (carr-purcell- meiboom-gillsquence)脉冲序列测样品横向弛豫时间(T2),连续测量3次,取平均值.采用多脉冲回波序列CPMG扫描采集核磁信号,通过调整MSE 序列中的选层梯度、相位编码梯度和频率编码梯度,分别获取样品俯视和侧视成像数据,然后利用sirt算法,迭代次数为10万次进行反演得到T2谱图.T2试验主要参数:主频 SF=20 MHz,偏移频率 O1=638 KHz,90 度脉冲时间P1=8.52 ms,180 度脉冲时间 P2=16 ms,累加采样次数 NS=4,回波时间TE=1 ms,回波个数 NECH=1500,信号接收带宽SW=100 KHz.
1.4 低场核磁共振成像(MRI)检测
采用多层自旋回波序列(MSE)采集样品横断面的质子H质子密度图像,采用MRI成像软件进行核磁共振成像实验.MRI 成像参数:选层层厚2 mm,层间隙 1.5 mm,重复时间300 ms,回波时间20 ms,频率编码方向视野80 mm,相位编码方向视野80 mm,采集次数20,频率方向256,编码步数192.
2 结果与分析
2.1 在50 ℃干燥过程中天花粉水分状态变化
通过连续分布的CPMG弛豫曲线的多指数拟合获得的T2弛豫时间的分布如图所示.每条曲线是3个样本的9次独立测量的平均值.按照水分与底物结合的状态,最短弛豫时间在0.1~10 ms之间的质子池T21代表束缚水,弛豫时间在10~1000 ms之间的质子池T22代表自由水,峰积分面积代表其相对含量[8].样品的干燥过程中,横向弛豫时间T2的大小反映了不同状态的水分分布与变化情况,T2越小,水分自由度越小,表明水与所处环境中的大分子等的结合越紧密;T2越大,表明水分自由度越大,越容易除去.天花粉50 ℃干燥过程中弛豫时间T2和峰面积的变化见表2.
从表中可以得出,天花粉在干燥过程中束缚水(T21)和自由水(T22)随着干燥时间的延长,水的流动性变差,峰面积逐渐变小,说明在干燥过程中天花粉内部水分的状态和含量都发生了变化.通过不同的横向弛豫时间T2对应的峰面积可以得知天花粉在干燥过程中自由水和束缚水的相对含量.在干燥初始时,天花粉中水分含量为64.96%(自由水占比77.79%);0~0.5 h,自由水的峰面积下降,束缚水的含量基本不变,说明此时主要干燥的是自由水;0.5~3.5 h,A21和A22都在减小,提示自由水和束缚水的含量都下降;3.5~7.5 h,自由水的含量下降,束缚水的含量上升,提示在干燥过程中,自由水逐渐向束缚水转换,水分与组织的结合变紧密.7.5~12.5 h,两种水的含量再次下降,提示在干燥过程中药材组织逐渐被破坏,组织对水分的束缚减少,组织中束缚水和自由水逐渐减少,T2向左移动.干燥结束时,水分大部分为束缚水(A21),少部分为自由水(A22),水分与组织的结合变得更加紧密.

表2 天花粉50 ℃干燥过程中弛豫时间T2和峰面积的变化
2.2 不同干燥温度的干燥过程中水分含量与形态变化
干燥温度和干燥时间是药材炮制的重要参数,对药材的品质和外观的形成均有影响.图1表明,在不同干燥温度条件下,天花粉的水分状态变化规律相似,横向驰豫时间T2逐渐缩短,水分由低熵、低序状态的自由水向高能级、有序状态的束缚水移动,且干燥温度越高,天花粉失水越快.干燥12.5 h,40 ℃下天花粉未干燥彻底;50 ℃和60 ℃下,天花粉已接近干燥终点.
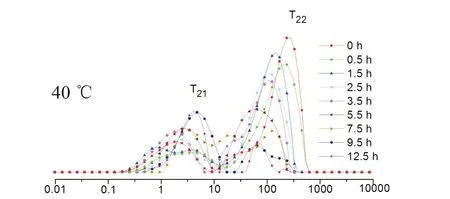
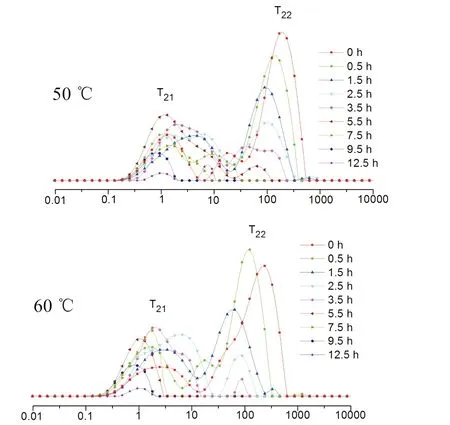
图1 不同干燥温度下天花粉横向弛豫时间T2的变化
2.3 天花粉干燥过程中的 MRI 图像变化
利用 MRI成像技术获得的天花粉在干燥过程中H质子密度图像变化,图中红色代表的水分含量高,黄色代表水分含量较低,绿色代表水分含量最少(图2).图2显示,在干燥开始时,天花粉外层先开始失水;随着干燥时间的延长,水分减失开始向内层延伸;干燥后期,水分仅残存于内层且含量很低,在MRI图中几乎不能检识.MRI图中的变化和横向弛豫时间T2的变化一致,温度越高,药材失水越快.
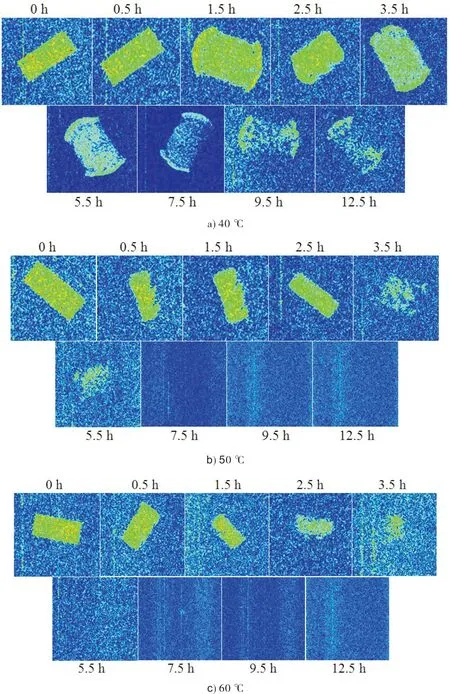
图2 不同干燥温度下天花粉的MRI图
3 结语
在天花粉干燥过程中,水的流动性变差,峰面积逐渐变小,水分由低熵、低序状态的自由水向高能级、有序状态的束缚水移动;随着干燥的进行,药材组织逐渐被破坏,组织对水分的束缚减少,组织中束缚水和自由水逐渐减少;干燥后期,自由水基本消失,只剩下少量的束缚水且束缚水与组织的结合更加紧密.在实验条件下,50 ℃和60 ℃能使天花粉较快达到干燥终点,40 ℃在12.5 h内难以达到干燥状态,表明温度对干燥过程具有较大影响,提示需要对传统使用的药材“阴干/晒干”模式进行研究以确定更为标准的干燥模式.在干燥过程中低场核磁成像(MRI)给出了更加直观的水分变化规律,结果也显示了饮片由外而内的干燥失水过程.两者都揭示了干燥温度不同时,水分的状态变化相似,温度越高,药材失水越快.本研究初步揭示了天花粉干燥过程中水分的变化规律.低场核磁共振及成像技术作为近年来新兴的一种研究方法,在水分测定研究中显示出独特的优越性,与传统的与差式扫描量热法(DSC)、卡尔·费休法、动态热机械分析(DM-TA)、烘箱干燥等常规水分分析方法相比[9],其能够提供样品内部水分状态信息而不会对样品造成干扰,研究结果更加直观、数据更加准确、检测更加快捷.该方法的建立为根类药材炮制方法的优化提供了更为直观的评价方法和技术支撑.
