双氢青蒿素对肺纤维化大鼠ERK和CTGF表达的影响
2019-10-10王保兰王立新朱蓉
王保兰,王立新,朱蓉
(南京医科大学附属淮安第一医院呼吸科,江苏 淮安 223000)
肺纤维化是一种弥漫性肺炎性疾病,病死率高。结缔组织生长因子为促纤维化生长因子参与多种增生性或纤维化疾病的发生发展,但具体致病机制尚不明确[1]。肺纤维化传统治疗以使用激素和免疫抑制剂为主,但效果并不理想。研究[2-4]证实,阻断ERK信号通路可以抑制CTGF表达,从而干预组织纤维化。双氢青蒿素是青蒿素的一种提取物,其对炎症和炎症相关性疾病具有治疗作用[5];另有实验研究[6]证实,双氢青蒿素还可抑制纤维化大鼠肺组织炎症因子聚集、成纤维细胞增生及胶原蛋白沉积,提示其可能为肺纤维化的药物治疗提供新思路。袁晓梅等[7]研究发现,双氢青蒿素可干预博莱霉素诱导的大鼠肺纤维化模型,然其具体作用机制尚不明确。作者此前研究也发现,双氢青蒿素可通过抑制TGFβ1和SMAD2/3的表达干预肺纤维化[8]。本实验旨在进一步研究双氢青蒿素对博莱霉素诱导大鼠肺纤维中ERK和CTGF表达的干预作用。
1 材料与方法
1.1 材料
1.1.1 药品与主要试剂 药物注射用盐酸博莱霉素购自日本化药株式会社(批号:140372),双氢青蒿素购自成都欧康植化有限公司(批号:AB140901),醋酸泼尼松片购自广东华南药业有限公司。TRNZOL总RNA提取试剂购自北京天根生物技术有限公司(编号:DP405-02),TIANScriPt cDNA第一链合成试剂盒购自北京天根生物技术有限公司(编号:KR104-02),SYBR Premix Ex Taq购自Takara生物有限公司(编号:RR420A);col1(a2)引物(108bp),上游:5′-GAGGGCAACAGCAGATTCAC-3′,下游:5′-GCGAGATGGCTTATTCGTTT-3′;ERK1引物(110bp),上游:5′-CCCTTGACCTGAGTGATGAG-3′,下游:5′-CATAGCCCTTCCATTCCAGA′3′;ERK2引物(136bp),上游:5′-CACATCCTGGGTATTCTTGGA-3′,下游:5′-AGTCAGCGTTTGGGAACAAC,
内参β-actin(132bp),上游5′-CCACGAAACTACCTTCAACTCC-3′,下游5′-GTGATCTCCTTCTGCATCCTGT-3′,各引物由上海生工公司合成。浓缩型DAB试剂盒购自北京中杉金桥生物有限公司(编号:ZLI-9017),超敏二步法免疫组化检测试剂购自北京中杉金桥生物有限公司(编号:PV-9001),兔抗鼠pERK1/2单克隆抗体购自CST公司,兔抗鼠ERK1/2单克隆抗体购自CST公司,兔抗鼠CTGF多克隆抗体购自博士德生物公司。
1.1.2 实验动物与分组 SPF级SD大鼠,雄性,体重为180~220 g,由徐州医学院动物中心提供。75只随机分成假手术对照组、模型对照组、溶剂对照组、阳性对照组、和双氢青蒿素治疗组5组,每组15只;每组再按处死时间点分为7 d、14 d、28 d三个亚组,每个亚组5只。除假手术对照组外,所有动物气管内注入博来霉素5 mg/kg。造模后第一天起,相应予生理盐水、生理盐水、5%羧甲基纤维素钠、泼尼松5 mg/kg、双氢青蒿素75 mg/kg,1次/d,持续至处死当天。于末次给药8 h后处死动物,取血分离血清或血浆冷藏备用,取左肺用4%多聚甲醛固定,留取右肺冷藏备用。
1.2 方法
1.2.1 模型验证 用HE染色法观察肺组织病理形态变化,验证肺纤维化模型是否成功。
1.2.2 荧光定量PCR法检测ERK1、ERK2、Col-1基因的表达量 (1)提取RNA:取30 mg肺组织放入液氮研钵磨成粉末,将粉末移入1.5 mL EP管,加入1 mL TRIZOL,充分摇匀,室温静置5 min,加入200 μL氯仿,剧烈震荡15 s,室温静置5 min;4 ℃,12 000 rpm离心15 min;取上层水相400 μL转移至另一1.5 mL EP管中,加入等体积异丙醇,轻轻混匀。室温静置10 min;4 ℃,12 000 rpm离心10 min;弃上清,加入预冷的75%乙醇1 mL(无核酶双蒸水配置),洗涤沉淀,轻轻混匀;4 ℃,7 500 rpm离心5 min;重复洗涤沉淀;弃上清液,室温干燥5 min,50 μL无核酶双蒸水充分溶解;取2 μLRNA原液加入98 μL无核酶双蒸水中,充分混匀,测定RNA浓度;(2)逆转录:在冰浴无核酶离心管中加入2 μL RNA原液(5 μgRNA)、2 μL Oligo(dT)、2 μL Super Pure dvip,补无核酶双蒸水定容至14.5 μL;70 ℃加热5 min后迅速在冰上冷却2 min,简短离心后加入4 μL 5xFirst-strumd buffer(含DTT)、0.5 μL Rvasin、1 μL IIAScript m-MLV,轻轻用移液器混匀;42 ℃温浴50 min;95 ℃加热5 min终止反应,冷冻保存于-20 ℃冰箱。(3)荧光定量PCR:按照Takara SYBR Premix试剂盒说明书配制扩增反应体系,上机,94 ℃ 3 min,(94 ℃30 s 56 ℃30 s 72 ℃30 s 72 ℃ 10 min)共36cycle,测定CP值,用双delta法计算,结果用2^(-△△Ct)表示。
1.2.3 免疫组化法检测CTGF、ERK1/2、pERK1/2蛋白的表达量 石蜡切片常规脱蜡、冲洗,用柠檬酸缓冲液行高压抗原修复,3% H2O2去离子水(终50 μL)37 ℃孵育15 min,以灭活内源性过氧化物酶活性;滴加试剂A室温孵育10 min,顷去,滴加CTGF(1∶100)、ERK1/2(1∶400)、pERK1/2(1∶400)稀释一抗,4 ℃冰箱过夜,滴加试剂B37 ℃孵育10 min,滴加试剂C 37 ℃孵育10 min,显微镜下控制DAB显色时间,自来水冲洗,终止显色,苏木素复染5 min,水洗1 min,盐酸分化3 s,水洗1 min,碳酸锂返蓝1 min,水洗1 min;梯度酒精脱水,二甲苯透明后,中性树脂封片,光镜下拍摄下免疫组化染色图片,每张切片随机选择五个视野各采集一张,用Image-Pro Plus6.0进行图像分析,选定染色阳性区域,记录IOD和Area,计算IOD/Area,并取五张的平均值。
1.3 统计学分析
2 结果
2.1 病理形态改变
显微镜下观察假手术对照组大鼠肺组织结构清晰,各时间点肺泡结构正常,无明显病理改变;模型对照组大鼠7 d时肺组织呈急性炎症反应,肺泡间质有大量炎症细胞浸润,伴有水肿出血,14 d时肺泡壁增厚,肺泡结构破坏,成纤维细胞增生,可见较多胶原沉积,28 d时肺泡结构大量破坏,肺泡壁显著增厚,肺纤维化瘢痕形成,胶原纤维大量沉积;与模型对照组相比,阳性对照组前期肺泡炎症轻,后期肺泡间隔增宽、肺泡结构破坏及胶原沉积程度轻;与阳性对照组比较,双氢青蒿素治疗组前期肺泡炎症程度与之相似,后期肺泡结构完整性较好,胶原沉积量少。见图1。

2.2 荧光定量PCR法检测各组肺组织中Col1(a2)、ERK1、ERK2基因相对表达量
模型对照组大鼠肺组织Col1(a2)、ERK1、ERK2基因相对表达量均比假手术对照组高(P<0.01),模型对照组与溶剂对照组组间各基因相对表达量差异无统计学意义(P>0.05)。与模型对照组比较,双氢青蒿素治疗组Col1(a2)、ERK1、ERK2基因相对表达量均低(P<0.01);与阳性对照组比较,7 d、14 d双氢青蒿素治疗组大鼠肺组织Col1(a2)、ERK1、ERK2基因相对表达量差异无统计学意义(P>0.05),28 d双氢青蒿素治疗组大鼠肺组织 Col1(a2)、ERK1、ERK2基因相对表达量低(P<0.01),实验结果见表1。
2.3 免疫组化法测大鼠肺组织CTGF、ERK1/2、pERK1/2表达量
与假手术对照组比较,模型对照组CTGF、ERK1/2、pERK1/2蛋白表达量高(P<0.01),模型对照组与溶剂对照组组间CTGF、ERK1/2、pERK1/2蛋白表达差异无统计学意义(P>0.05)。与模型对照组比较,双氢青蒿素治疗组CTGF、ERK1/2、pERK1/2蛋白表达量少(P<0.01); 7 d、14 d双氢青蒿素治疗组CTGF、ERK1/2、pERK1/2蛋白表达量与阳性对照组比较,差异无统计学意义(P>0.05);28 d时双氢青蒿素治疗组CTGF、ERK1/2、pERK1/2蛋白表达少于阳性对照组(P<0.05)。见图2-图4及表2。
表1各组不同时间点肺组织Col1(a2)、ERK1、ERK2基因相对表达量测定结果(2^(-△△Ct)值,n=5)
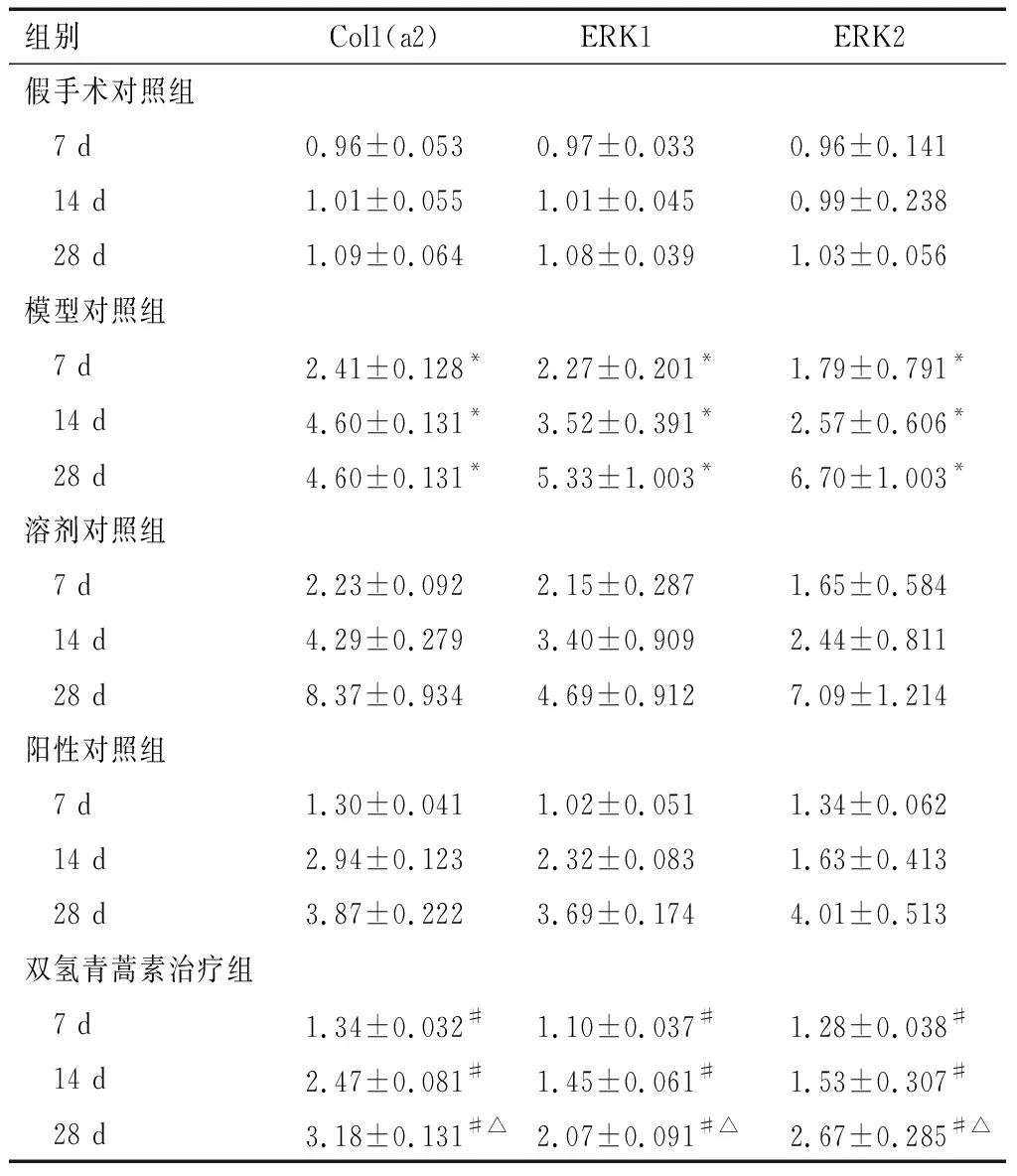
组别Col1(a2)ERK1ERK2假手术对照组 7 d0.96±0.0530.97±0.0330.96±0.141 14 d1.01±0.0551.01±0.0450.99±0.238 28 d1.09±0.0641.08±0.0391.03±0.056模型对照组 7 d2.41±0.128*2.27±0.201*1.79±0.791* 14 d4.60±0.131*3.52±0.391*2.57±0.606* 28 d4.60±0.131*5.33±1.003*6.70±1.003*溶剂对照组 7 d2.23±0.0922.15±0.2871.65±0.584 14 d4.29±0.2793.40±0.9092.44±0.811 28 d8.37±0.9344.69±0.9127.09±1.214阳性对照组 7 d1.30±0.0411.02±0.0511.34±0.062 14 d2.94±0.1232.32±0.0831.63±0.413 28 d3.87±0.2223.69±0.1744.01±0.513双氢青蒿素治疗组 7 d1.34±0.032#1.10±0.037#1.28±0.038# 14 d2.47±0.081#1.45±0.061#1.53±0.307# 28 d3.18±0.131#△2.07±0.091#△2.67±0.285#△
*P<0.01,与假手术组和双氢青蒿素治疗组相比;#P<0.01与模型对照组相比;△P<0.01,与阳性对照组相比。

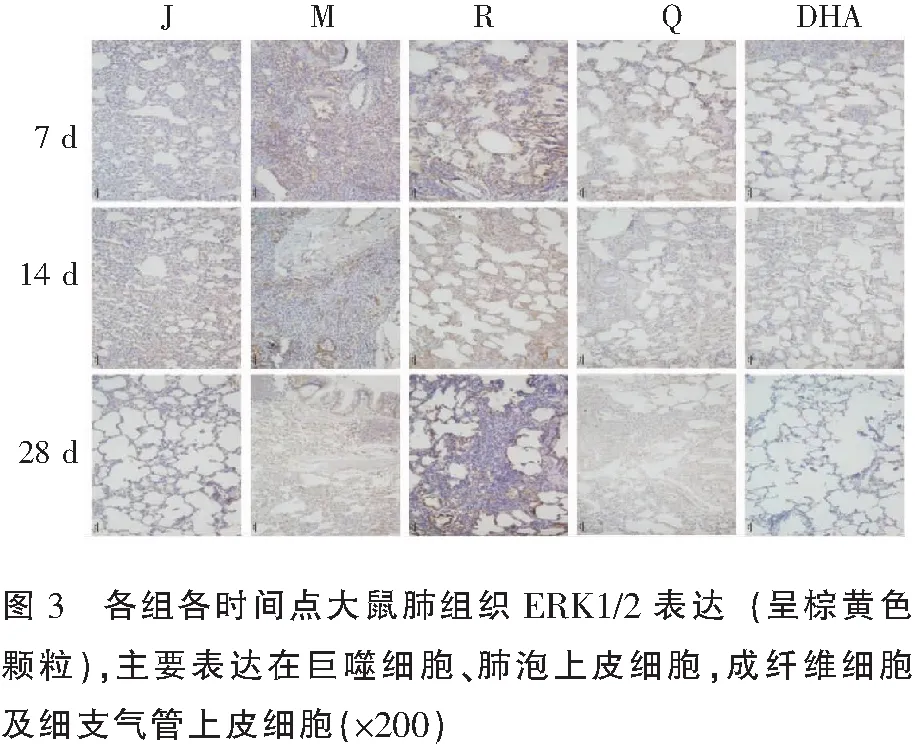

表2各组不同时间点肺组织CTGF、ERK1/2、pERK1/2蛋白表达测定结果(IOD/Area,n=5)

组别CTGFERK1/2PERK1/2假手术对照组 7 d0.11±0.0710.08±0.0830.06±0.067 14 d0.12±0.1030.10±0.0780.09±0.071 28 d0.09±0.0800.11±0.0520.10±0.043模型对照组 7 d0.27±0.132*0.23±0.105*0.21±0.121* 14 d0.31±0.201*0.29±0.153*0.28±0.146* 28 d0.23±0.164*0.31±0.141*0.30±0.134*溶剂对照组 7 d0.26±0.1840.24±0.1100.21±0.109 14 d0.32±0.2320.27±0.1710.24±0.143 28 d0.22±0.1750.30±0.1520.29±0.118阳性对照组 7 d0.18±0.1100.16±0.0860.14±0.105 14 d0.21±0.0930.17±0.0990.15±0.094 28 d0.16±0.0740.22±0.1010.18±0.075双氢青蒿素治疗组 7 d0.17±0.097#0.14±0.079#0.13±0.082# 14 d0.19±0.102#0.15±0.085#0.15±0.077# 28 d0.13±0.081#△0.16±0.063#△0.13±0.083#△
*P<0.01,与假手术组和双氢青蒿素治疗组相比;#P<0.01与模型对照组相比;△P<0.05,与阳性对照组相比。
3 讨论
肺纤维化是进展性、致死率极高的疾病,随着对肺纤维化发病机制的深入研究,国内外的研究热点集中于寻找新的抗纤维化药物,并尽可能在疾病的早期进行干预治疗[9]。研究[10]发现,肺纤维化是多种细胞因子、生长因子调节失衡的结果,成纤维细胞增殖分化,细胞外基质大量沉积为其特征性表现。双氢青蒿素类药物除了抗疟作用外,还具有抗炎、抗纤维化的[11]药理作用。
ERK蛋白是MAPK家族的一员,所介导的信号传递途径是涉及调节细胞生长、发育及分裂的信号网络的核心,在多种细胞异常增殖类疾病(如肿瘤,纤维化疾病等)中起到了重要的作用[12-13]。研究[14-15]证实,ERK信号通路与肺纤维化发生关系密切,可介导靶细胞的分化、增殖、合成、分泌细胞外基质以及诱导细胞凋亡及其炎性反应等多种细胞生物学效应。ERK通路是调节CTGF表达的重要信号通路,实验证实阻断ERK通路可抑制血管紧张素II诱导细胞的CTGF表达[16]。另有研究[17-19]证实,肺成纤维细胞过表达CTGF与肺纤维化关系密切,抑制CTGF的表达对肺纤维化进展有干预作用。本研究对双氢青蒿素对肺纤维化模型大鼠肺组织中CTGF、ERK1/2基因和蛋白表达的影响进行探讨。
由本研究病理学结果可知,模型组大鼠肺泡结构完整性破坏严重,肺泡间隔厚,肺组织中有大量疤痕组织形成,假手术对照组大鼠肺泡结构未见明显异常,证实博来霉素诱导的大鼠肺纤维化模型构建成功。与模型对照组比较,双青蒿素治疗组大鼠肺组织可见少许纤维疤痕组织,然肺泡结构的完整性较好,肺泡间隔较薄,说明双氢青蒿素可改善模型大鼠的肺纤维化破坏程度。从荧光定量PCR结果可知双氢青蒿素治疗组大鼠肺组织Col1(a2)基因表达量少于模型对照组大鼠。细胞间质胶原纤维大量沉积是肺纤维化的显著特征,Col1(a2)为胶原纤维的主要组成成分之一,双氢青蒿素抑制Col1(a2)基因的表达,可减轻肺纤维化程度,袁晓梅等人关于双氢青蒿素干预肺纤维化的研究结果支持作者研究结果。从荧光定量PCR及免疫组化结果可知双氢青蒿素治疗组大鼠肺组织ERK1、ERK2的基因表达及CTGF、ERK1/2、pERK1/2蛋白表达量均少于模型对照组大鼠,说明双氢青蒿素对CTGF、ERK基因及蛋白的表达具有一定的抑制作用。CTGF可介导肺成纤维细胞增生、迁移和分化,CTGF是肺组织损伤和纤维化的必须生长因子[15]。ERK信号通路是除SAMD2/3信号通路外调节CTGF表达的重要信号通路,作者将CTGF基因及蛋白表达与ERK基因及蛋白表达的相关性进行比较,得出两者各时间点均呈正相关。有研究[20]证实,ERK1/2磷酸化可干预人成纤维细胞CTGF的表达,这也支持本研究结论。
综上,ERK和CTGF的表达与肺纤维化关系密切,双氢青蒿素对博莱霉素诱导的大鼠肺纤维化模型中ERK和CTGF基因和蛋白的表达有干预作用,这为肺纤维化的新药研究及肺纤维化的靶向治疗提供新思路。
