银杏种子发育过程中胚乳内含物的变化
2019-10-10沈永宝史锋厚郭聪聪
冯 景,沈永宝,史锋厚,郭聪聪
(1.南京林业大学风景园林学院,江苏 南京 210037;2.南京林业大学南方现代林业协同创新中心,江苏 南京 210037;3.南京林业大学林学院,江苏 南京 210037;4.国家林业局南方林木种子检验中心,江苏 南京 210037)
银杏,原产中国,世界著名的孑遗树种,被誉为“活化石”植物[1,2]。银杏的果实俗称白果,其种仁含有丰富的营养成分和多种药用化学成分,如淀粉、蛋白质、氨基酸、黄酮类、内酯类、酚类、白果酸、多糖类、生物碱等[3]。银杏种仁具有镇咳、平喘、抗菌、抗衰老、抗癌、抗疲劳等作用,在我国又是珍贵的药材和传统的保健食品。植物胚胎发育过程中的细胞分化、器官形态建成的生理生化变化是研究植物胚胎发育的重要方面。银杏作为裸子植物的远祖,在传粉受精及胚胎方面表现出了许多的原始特性,具有极高的理论研究价值,长期以来引起了国内外许多学者的浓厚兴趣。1896年,Hirase 首先发现了银杏的游动精子具有鞭毛,在植物学界引起了轰动。此后人们对银杏种子发育及其受精过程的研究从未间断。在胚胎发育过程中,碳水化合物代谢与胚胎本身分化发育密切相关[4],而胚乳又是胚生长发育所需碳水化合物的主要供体,胚乳本身可能积极参与动员胚胎生长所需的贮藏物质[5]。对银杏幼胚进行离体培养证明胚乳提取液具有促进胚生长的作用[6-8]。许多研究者从形态学、解剖学、发育生物学和遗传学等方而对银杏受精过程及胚乳发育特点进行了大量研究[9-16]。在其他裸子植物胚胎学的研究中,一些作者曾零星地提到胚胎发育期间某些物质的存在或消失以及它们同胚胎发育的关系[17,18]。油松胚胎发育过程中,胚乳淀粉区经常包围着幼胚并随幼胚的发育不断向胚乳合点端推移,说明淀粉区是提供油松胚胎发育所需碳水化合物的主要场所[19];杉木胚胎发育过程中蛋白质含量在胚分化完成前显著下降[20]。
银杏在4月下旬花粉成熟并开始传粉,花粉传到雌球花后不会立即受精,从传粉到受精在暖温带地区大约需要112 d 左右[22]。迄今为止关于银杏胚胎发育的大多研究集中在采后生理方面,结合种胚在树体上的发育过程的研究尚未见报道。许多关于银杏胚胎发育过程中尤其是胚发育过程中胚乳的物质代谢,以及胚乳与胚发育的相互关系等问题仍然没有得到答复。银杏胚乳在受精前已经形成,其作为种子的养分贮藏组织,对胚的发育十分重要,因此本研究旨在探索从种子发育开始直到胚发育完成自然脱落过程中胚乳主要内含物质的消长及胚乳发育过程中的代谢变化,这对了解银杏胚胎的分化发育过程有着重要意义,同时也可为其他裸子植物的研究提供一定的理论参考。
1 材料与方法
1.1 试验材料
银杏果实采集于江苏农牧职业技术学院校园内的3株成年母树(32°27′38.43″N 119°56′15.64″E),品种名‘家佛指’。从2015年5月31日,即银杏盛花期后40 d 第一次取样。取样时自树冠东南西北四面随机采集3×50 粒果实,迅速放入冰盒内带回;此后每隔10 d 取样一次,直到种子成熟自然脱落为止。每次取样后,取3×30 粒剥出胚乳,纵切后去除种胚,将胚乳组织切片混匀,称取0.3 g,每个待测生理指标重复3 次,放入-70 ℃的超低温冰箱保存,用于后续的测定。
1.2 研究方法
1.2.1 胚长的变化
每次取回样品后,随机抽取3×30 粒,解剖观察种胚的生长发育状况并用0.01 mm 游标卡尺测量胚长度。
1.2.2 种子含水量的测定
每次取样后,参照国际种子检验规程[21],采用高恒温烘干法测定种子的含水量。
1.2.3 胚乳内含物及相关酶活性的测定
可溶性蛋白含量的测定采用考马斯亮蓝法,可溶性糖、淀粉的含量测定采用蒽酮法[23],a-淀粉酶及β-淀粉酶活性测定采用3,5-二硝基水杨酸(DNS)法[23]。磷酸己糖异构酶(PGI)、G-6-PDH 和6-PGDH 联合酶的活性测定参照Wary 和Brown 的方法[24],苹果酸脱氢酶活性测定参照朱广廉法[25]。
1.3 数据处理
采用Excel 软件处理数据、制表,SPSS23.0软件进行方差分析和相关性分析。
2 结果与分析
2.1 银杏胚发育动态
8月中下旬银杏受精作用发生,合子迅速进行连续的有丝分裂,历经游离核和细胞化时期形成胚胎。银杏胚分化大约经历了一个月的时间。从9月18日即花后150 d,胚才肉眼可见,胚长2.5 mm,随后,胚快速长大,至花后210 d,胚长为16.5 mm,之后,胚长增长缓慢,直至花后230 d(12月7日)种子自然脱落时,胚长可达17.1 mm(表1),基本充满整个胚腔。
2.2 银杏种子发育过程营养物质代谢
在花后40 d,胚乳内可溶性糖含量为1.841%,花后50~80 d 可溶性糖含量减少,由3.93%减少到2.56%,且花后80 d 可溶性糖含量(2.56%)显著低于花后50 d(P<0.05)(图1),花后80~120 d 是代谢旺盛期,光合产物和能量正源源不断地向种子运输,可溶性糖含量持续上升到4.84%。随后,可溶性糖的含量呈现迅速下降的趋势,到花后140 d 时,下降到最低值2.18%。花后140 d可溶性糖含量显著低于花后120 d,之后可溶性糖含量持续波动上升,至花后230 d 时达到7.05%。
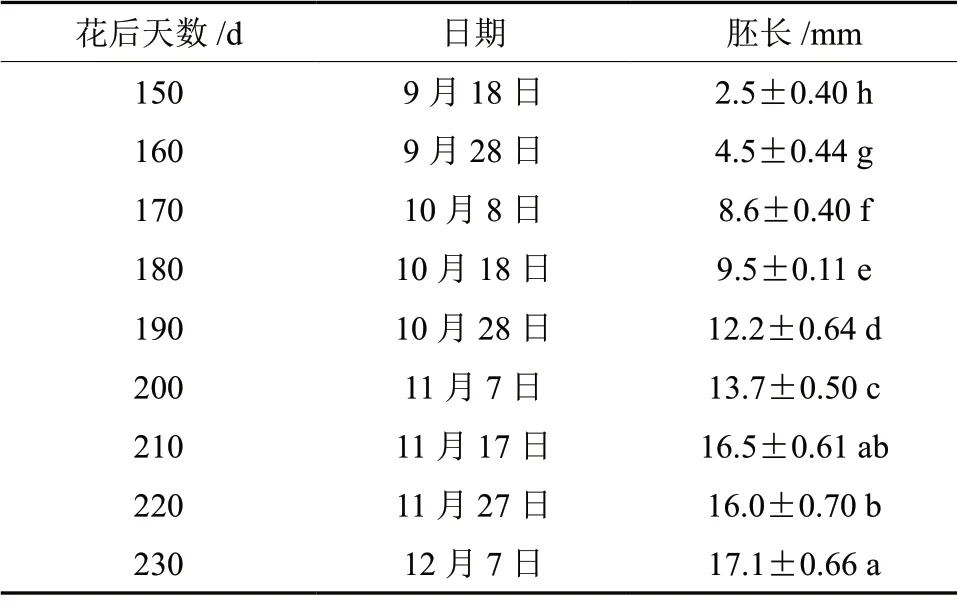
表1 银杏‘家佛指’种子发育过程中胚长的变化†Table1 Changes of embryo length during seed development of Ginkgo biloba ‘Jiafozhi’
可溶性蛋白含量整体呈上升趋势,花后40 d可溶性蛋白含量快速增加(图2),至130 d,可溶性蛋白由1.06 mg·g-1增加至7.67 mg·g-1,随后至170 d 可溶性蛋白有一个下降过程,这一过程正是胚发育阶段,结合图1可知,可溶性糖含量在此时期也存在一个下降过程,这可能与此时期银杏种胚发育需要蛋白质和糖类等营养物质支持有关。在170 d 后,可溶性蛋白又不断增加,至花后230 d 时达到9.28 mg·g-1。
胚乳内淀粉的含量从花后50 d 开始就呈现快速上升的趋势(图3),从花后50 d 的4.37%持续上升,到花后160 d 达到峰值82.5%;其中在花后120~130 d,淀粉含量短暂下降,而此时受精作用发生,这表明淀粉很可能参与了银杏的受精过程,结合图1和图2可知,此期胚乳内可溶性糖含量显著下降而蛋白质的含量显著上升,这种情况进一步说明在受精过程中淀粉可能参与代谢并转化为蛋白质,为胚分化发育提供支持。花后160~200 d,淀粉含量大幅波动,从胚乳内可溶性糖含量与蛋白质含量的消长情况来看,淀粉在后期胚胎发育过程中也起到了重要作用,说明淀粉在胚分化及后期胚发育过程中有明显的积累与消耗的变化规律。自花后220 d 后银杏胚乳内淀粉含量趋于稳定。
2.3 银杏种子发育过程中淀粉酶活性的变化
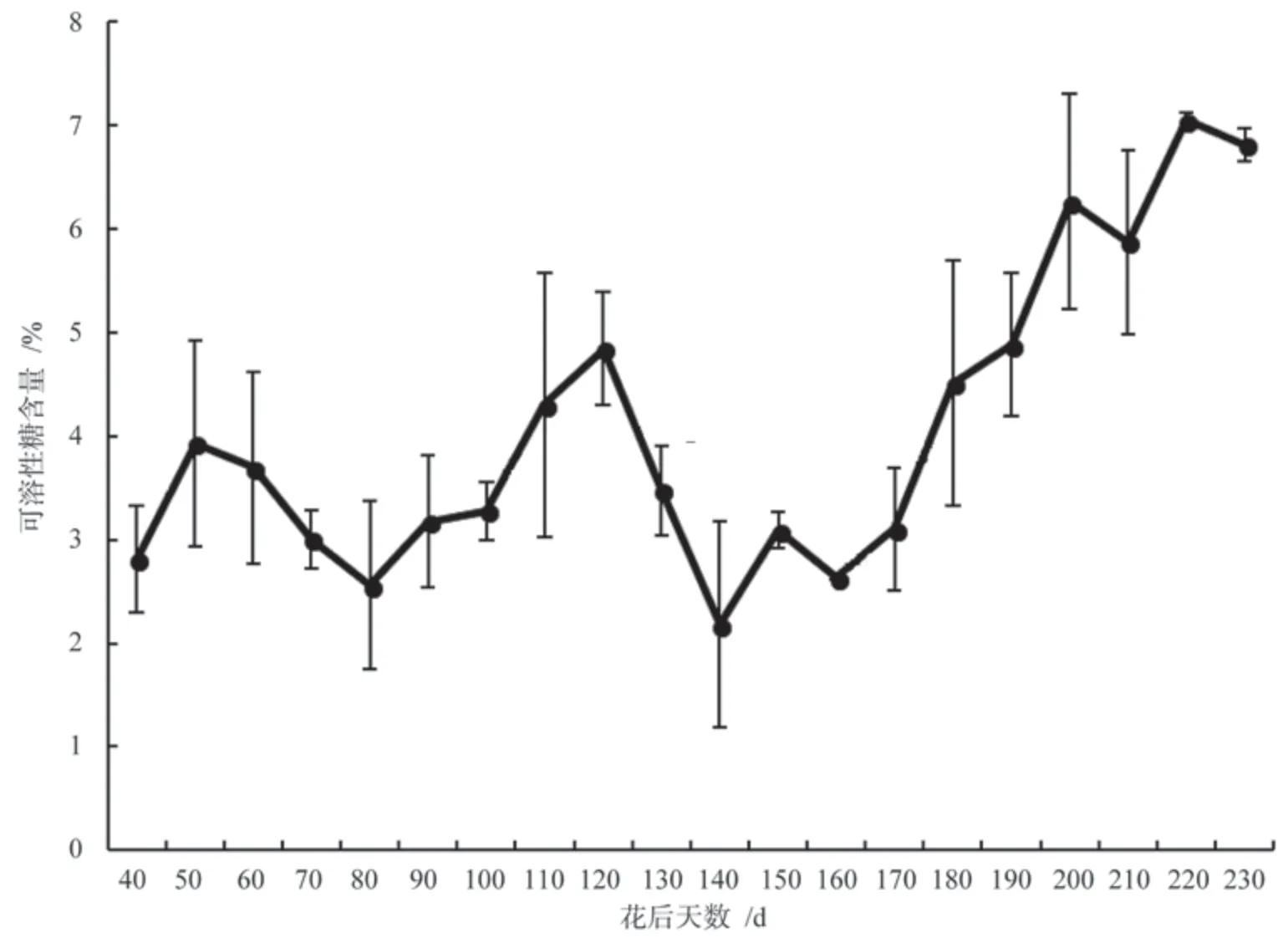
图1 银杏‘家佛指’胚乳内可溶性糖含量的变化Fig.1 Changes of soluble sugar content in endosperm of Ginkgo biloba ‘Jiafozhi’
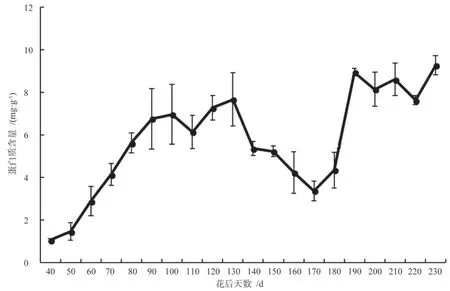
图2 银杏‘家佛指’胚乳内可溶性蛋白含量的变化Fig.2 Changes of soluble protein content in endosperm of Ginkgo biloba ‘Jiafozhi’
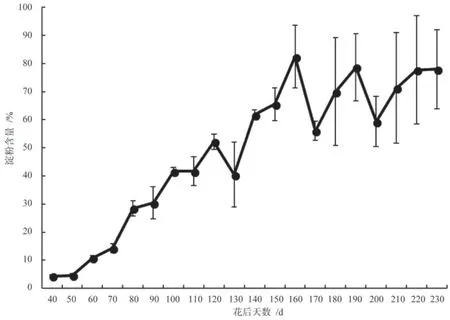
图3 银杏‘家佛指’胚乳内淀粉含量的变化Fig.3 Changes of starch content in endosperm of Ginkgo biloba ‘Jiafozhi’
花后40~50 d 淀粉酶活性短暂上升,由 13.63 mg·g-1·min-1上升到21.44 mg·g-1·min-1(图4)。 结合图1和图3可知,胚乳内淀粉含量在此期保持不变,而可溶性糖含量则显著升高,这可能是由于种子发育初期,代谢较为旺盛,胚乳内淀粉的合成小于分解,淀粉酶活性升高,大量的淀粉被水解为可溶性糖类供给种子发育能量所需;花后50 d 以后,胚乳内淀粉酶活性大幅下降,到花后90 d 时,仅为5.45 mg·g-1·min-1。这与此阶段可溶性糖含量迅速下降、淀粉含量快速上升相对应(图1和图3),胚乳内a-淀粉酶和β-淀粉酶活性与淀粉酶总活性变化相近。从花后90~180 d,胚乳内淀粉酶活性保持稳定,而a-淀粉酶在花后140~190 d 持续升高,这个阶段即胚发育阶段,胚乳内可溶性糖含量也持续升高,说明a-淀粉酶在胚发育过程中起着关键作用。花后190~230 d,淀粉酶活性不断升高,由5.96 mg·g-1·min-1上升到9.06 mg·g-1·min-1,表明种子发育后期,这种变化有利于为种子萌发做好准备。
2.4 银杏种子发育过程中氧化途径关键酶活性的变化
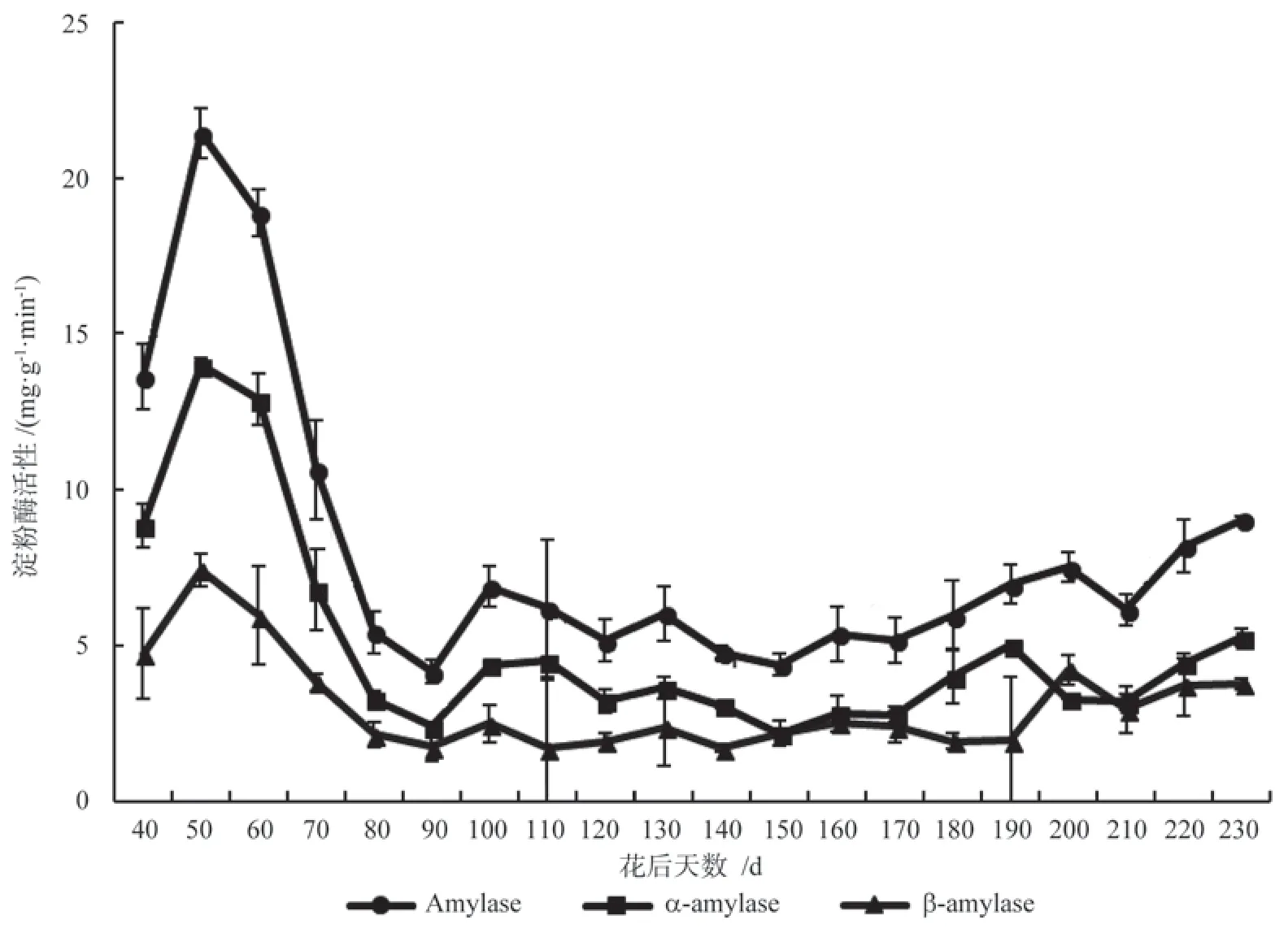
图4 银杏‘家佛指’胚乳内淀粉酶活性的变化Fig.4 Changes of amylase activity of in endosperm of Ginkgo biloba ‘Jiafozhi’
磷酸己糖异构酶(PGI)是糖酵解(EMP)途径中将六碳糖转化为丙酮酸的关键酶,其活性的变化能反应EMP 途径的活化状态。银杏种子发育过程中胚乳PGI 活性变化如图5所示。花后40~50 d,PGI 活性短暂上升,由43.46 U·g-1上升到55.33 U·g-1,此阶段,胚乳生理生化反应旺盛,EMP 途径作为植物有氧呼吸或无氧呼吸的共同途径被激活。花后50~60 d,PGI 活性又迅速下降至20.36 U·g-1,结合图3和图5可溶性糖和淀粉在此期的变化可知,光合作用产生的可溶性糖源源不断地转化为淀粉,导致EMP 途径的底物葡萄糖含量下降,从而使该途径被短暂抑制;花后100 d,PGI 活性回升至46.93 U·g-1,这可能是由于胚乳内物质代谢迅速,此后,PGI 活性显著下降(P<0.05),至花后150 d 时降至最低值17.74 U·g-1,花后150~230 d,随着银杏种胚发育长大,PGI 活性不断升高。

图5 银杏‘家佛指’胚乳内PGI 活性的变化Fig.5 Changes of phosphohexose isomerase activity in endosperm of Ginkgo biloba ‘Jiafozhi’
苹果酸脱氢酶(MDH)是三羧酸循环(TCA)的关键酶,可以反映TCA 循环的活化程度,进而反映银杏胚乳的呼吸代谢特点。如图6所示,花后40~90 d,胚乳中MDH 的活性由0.58 U·g-1·min-1降至0.15 U·g-1·min-1(P<0.05),花后90d~170 d,MDH 的活性不断升高并于花后170 d 达到一个峰值,为0.40 U·g-1·min-1,MDH 活性的这种变化说明银杏种胚发育阶段需要TCA 循环产生的大量能量所支持;花后170~190 d,胚乳中MDH 的活性迅速下降至0.17 U·g-1·min-1,此后基本保持不变,这可能是由于银杏种子发育后期,营养物质代谢相对缓慢,胚长大并充满整个胚腔,胚乳的发育活动逐渐减缓,物质含量积累稳定下来。
银杏胚乳内葡萄糖-6-磷酸脱氢酶(G-6-PDH)和6-磷酸葡萄糖脱氢(6-PGDH)联合酶的活性呈现初期下降后上升并维持稳定的变化趋势(图7)。花后40~70 d,G-6-PDH 和6-PGDH 联合酶的活性由14.24 U·g-1·min-1降低到4.00 U·g-1·min-1,这可能是种子发育早期活化的糖有限,抑制了磷酸戊糖途径的代谢。花后70~100 d,G-6-PDH 和6-PGDH联合酶的活性大幅度提高,磷酸戊糖途径代谢旺盛,推动银杏种子胚乳内糖类合成向高贮能物质合成的转化,这与图7PGI 活性的变化相一致,结合图6MDH 活性在此期的变化可知,银杏种子发育早期胚乳内的呼吸代谢途径以EMP 和PPP 途径为主,而在受精及胚分化发育阶段,TCA 循环发挥重要作用,花后190 d 以后,胚乳内G-6-PDH 和6-PGDH联合酶的活性变化不明显(P>0.05),直至花后230 d 时,联合酶活性为42.83 U·g-1·min-1。
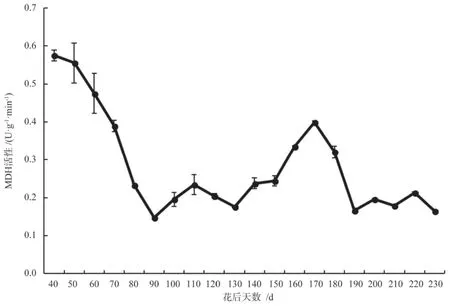
图6 银杏‘家佛指’胚乳内MDH 活性的变化Fig.6 Changes of MDH activity in endosperm of Ginkgo biloba ‘Jiafozhi’
2.5 各指标相关性分析
对银杏种子发育过程中胚长与各项生理指标进行相关性分析,结果表明,银杏种子受精后,随着种胚分化、发育长大,胚乳内的营养物质(糖、蛋白质、淀粉)含量和呼吸代谢关键酶活性均发生相应的改变。胚长与可溶性糖、蛋白质含量、淀粉酶、PGI、G-6-PDH 和6-PGDH 联合酶的活性均呈极显著正相关关系(P<0.01),而与MDH 活性呈极显著负相关关系(P<0.01);表明银杏胚乳内营养物质的变化及多种酶的调节均对胚发育有着极显著的作用。a-淀粉酶与淀粉含量和蛋白质含量存在极显著正相关关系,且相关性系数均高于β-淀粉酶,说明银杏种子发育过程中尤其是胚发育阶段以a-淀粉酶为主催化淀粉水解。此外,PGI 活性与淀粉含量存在显著正相关关系;G-6-PDH 和6-PGDH 联合酶的活性与可溶性糖含量存在极显著正相关关系(R2=0.721**);MDH 活性与蛋白质含量存在极显著负相关关系(R2=-0.911**),这些都表明银杏种子发育过程中多条呼吸代谢途径不是一成不变的,酶活性调节着生理功能,而生理功能的改变在一定程度上又影响酶的活性。
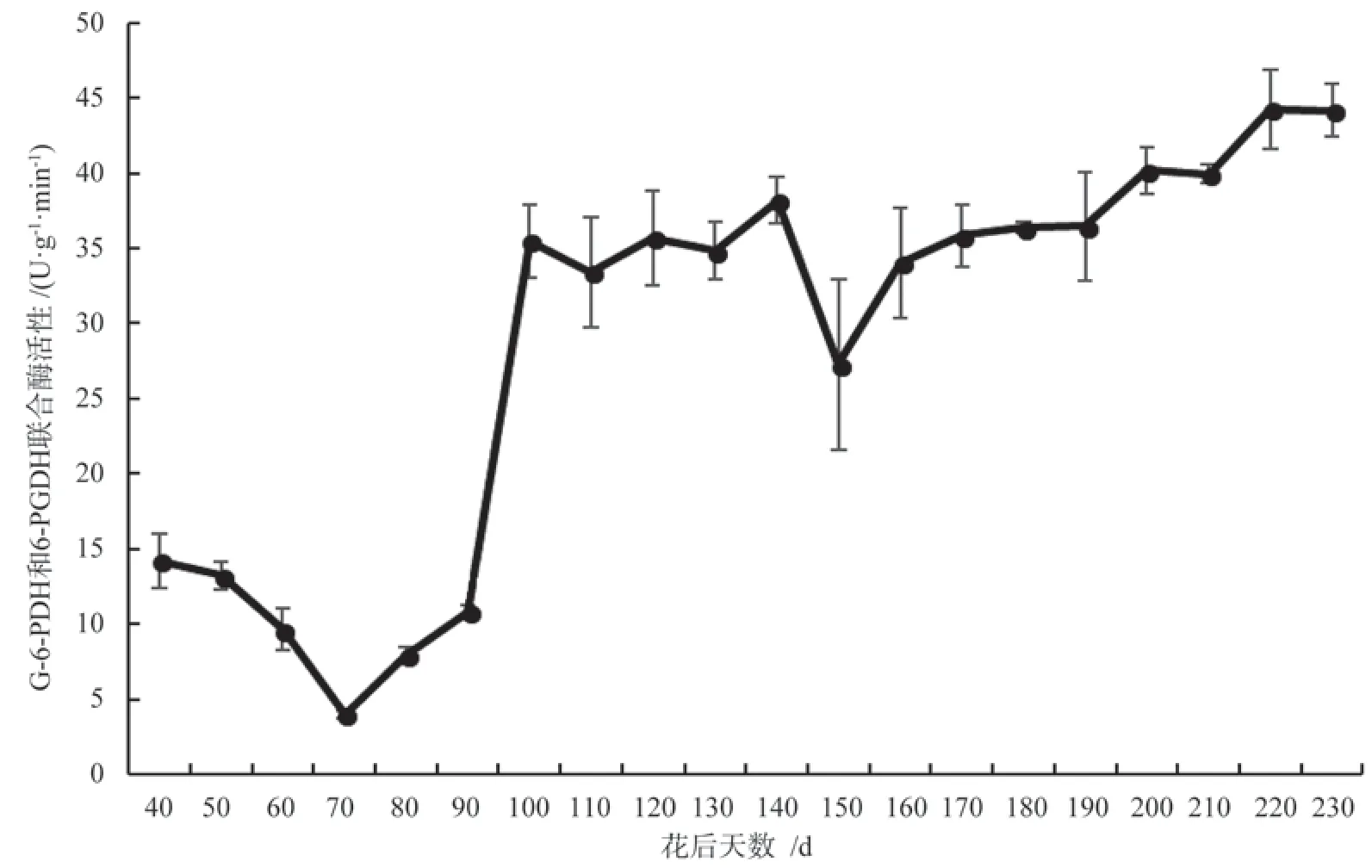
图7 银杏‘家佛指’胚乳内G-6PDH 与6-PGDH 联合酶活性的变化Fig.7 Changes of G-6PDH and 6-PGDH activities in endosperm of Ginkgo biloba ‘Jiafozhi’
3 讨论与结论
3.1 银杏种子发育过程中胚乳内含物及相关酶活性对胚发育的影响
种子的发育过程是一个营养物质不断储存和胚不断发育的过程。胚乳的贮藏物质主要是碳水化合物、蛋白质和脂肪。杨国栋等通过对短丝木犀种子成熟过程中超微结构的观察发现胚乳内含物质转化并积累为种子营养物质而贮藏,是种子成熟的重要过程[26]。银杏种子发育可分为3 个阶段:1)早期发育阶段(花后40~120 d)。光合作用产生可溶性糖类,这些糖类产物运输到种子中。银杏种子发育过程中可溶性糖、蛋白质与淀粉的含量总体呈上升趋势,只是在花后50~80 d,可溶性糖存在一个下降的阶段(P<0.05),表明此时光合作用的产物可溶性糖类转化为淀粉,这也使得淀粉含量上升的幅度明显。2)受精及早期胚胎发育阶段(花后120~160 d)。受精后,细胞分裂活跃,9月中旬原胚极性分化明显,珠孔端细胞形成不发达的胚柄组织,合点端细胞分裂活跃,10月上旬逐渐分化形成子叶、胚芽、胚轴和胚根。银杏种胚分化发育期间,胚乳内可溶性糖与蛋白质含量急剧下降,而淀粉被利用的同时其含量仍在急剧积累,在胚分化完成前(花后120~160 d)的短时期内仍缓慢地增加,虽然中间有一短暂的下降(花后130 d),但在花后160 d 时胚乳内淀粉含量才达到高峰。3)种子成熟及后期胚发育阶段(花后160~230 d)。胚从母体组织中吸收糖类等营养,胚乳获得营养物质的多少,直接影响胚的发育[29]。
在许多植物中发现,种胚发育时,淀粉在胚和胚乳内积累过程中,同时被降解用来作为胚胎组织分化发育所需要的能量,以及合成蛋白质等结构与贮藏物质的骨架[27-35];当生长和发育可用的碳库经历巨大波动时,植物会通过积累和重新调动淀粉作为碳库来缓减碳平衡的变化[36]。银杏种胚在利用淀粉的过程中,淀粉酶活性也在不断增加,种胚分化完成后,胚内淀粉含量急剧下降,这主要是淀粉酶对淀粉降解作用的结果,a-淀粉酶在后期胚发育过程(花后170~190 d)中持续升高,而β-淀粉酶此期变化始终不明显,表明a-淀粉酶在银杏种胚发育后期的调节作用可能有利于胚在相对稳定而且较充分的营养环境下正常发育。银杏胚乳内可溶性糖和蛋白质的积累一直分别持续到花后220 d 和190 d,即它们含量的高峰期分别比淀粉含量高峰期推迟了60 d 和30 d 左右,且胚乳内的淀粉含量在花后160~210 d 处于大幅波动的状态,淀粉不断累积和被利用,表明其可能参与了胚胎发育的代谢过程[37-39],并对胚发育所需营养和贮藏起到“桥梁作用”[40]。这在银杏的相关研究中尚未见报道。
3.2 银杏种子发育过程中胚乳内氧化途径关键酶活性变化
呼吸作用是植物代谢的中心,植物体中存在多条呼吸代谢途径,主要有糖酵解(EMP)途径、三羧酸(TCA)循环、戊糖磷酸(PPP)途径。这些途径的关键酶,在催化糖类物质分解产生能量外,还形成中间产物,为合成脂类、蛋白质等提供原料来源。
糖类在糖酵解(EMP)途径中被代谢是呼吸作用产生能量的第一步[41],通过EMP 的一系列反应,葡萄糖氧化释放能量并形成ATP 和NADH+H+,最终生成丙酮酸(PA)。在银杏种子发育的早期阶段(花后40~120 d),EMP 途径首先被激活,胚乳内PGI 活性波动较大,这与可溶性糖含量的变化相对应,可溶性糖向淀粉转化使EMP 途径底物含量下降,从而导致花后50~60 d PGI 活性短暂下降,同时,PGI 也受到AMP,ADP 和ATP 的调控,当ATP 的需求增加时,糖酵解速率也会加快[42,43]。花后70~100 d,银杏胚乳内物质代谢旺盛,积累较多的ADP 和Pi,PGI 活性快速上升,EMP 速度加快。NADH是TCA 循环的主要负效应物,NADH 积累过多,会抑制MDH 的活性,因此在银杏种子发育的早期阶段,TCA 循环随着EMP 的激活而处于抑制状态。而此期G-6PDH 和6-PGDH 联合酶的活性显著升高,PPP 途径被激活,并在在受精后及早期胚胎发育阶段(花后120~160 d),维持在很高的水平。而EMP/TCA 循环的酶体系在此期被显著抑制,PPP 途径具有一套完全区别于EMP/TCA 循环的酶体系,常与植物生长发育和逆境应答有关,当“干线”的酶体系没有充分活化时,戊糖磷酸途径往往作为替补途径,行使有氧呼吸的职能,保证植物细胞正常生命活动所需能量的供应[44-46]。PPP 途径中的6-PGDH 是胚乳内淀粉积累的关键酶[47],而且,该途径产生大量NADPH,提供还原力,其中间产物核酮糖-5-磷酸还是合成RNA 和DNA的关键原料,受精及胚分化过程也是遗传物质的大量合成的时期,因此这一途径对银杏胚发育的作用之大不言而喻。TCA 循环是有机体获得能量的最主要的途径,同时它也是物质代谢的枢纽,底物彻底氧化产生的能量主要也是通过TCA 循环,每个葡萄糖分子通过TCA 循环产生的ATP 数远远超过EMP 途径产生的ATP 数[41]。番木瓜果实发育后期,以线粒体呼吸占绝对优势,而线粒体外呼吸则变为次要[48]。在油菜籽实形成过程中,呼吸途径由EMP 途径逐渐转为PPP 途径[49,50]。银杏种子成熟及后期胚发育过程中,MDH 的活性不断升高并于花后170 d 达到一个高峰,表明银杏幼胚后期发育长大过程需要大量能量,而胚乳内淀粉含量在花后160~170 d 显著下降,进一步说明在银杏胚后期发育过程中胚乳内淀粉可能起着物质和能量供应的重要作用。银杏种子发育各阶段呼吸途径变化的大致规律可以归纳如下:种子早期发育阶段,EMP 途径首先被激活;PPP 途径随之活化并作用显著,在受精后及胚分化阶段,PPP 途径活化程度不断推进并维持在较高水平;在种子成熟及后期胚胎发育阶段,TCA 循环发挥重要作用。
本文仅探究了胚乳中内含物质的代谢变化,没有探究内源激素含量变化,将来可进一步探究胚中物质代谢,从代谢组学或蛋白质组学等方面深入研究,全面考察其与胚发育的关系。
