TAZ在张应力促进人牙周膜细胞骨向分化中的作用
2019-10-10陆素文胡碧波邓辉
陆素文,胡碧波,邓辉
(温州医科大学附属口腔医院 牙周科,浙江 温州 325027)
牙周膜细胞(periodontal ligament cells,PDLCs)作为牙周膜的主要细胞,在张应力作用下可骨向分化,是牙槽骨改建的重要效应细胞[1-2]。然而,PDLCs如何感知力学信号并转化为生化信号,亟待阐明。核心结合因子α1(core binding factor α1,Cbfα1)是重要的成骨特异性转录因子之一[3],含有RUNT结构域,与DNA上的OSE2序列结合后,启动骨钙素(osteocalcin,OCN)、锌指结构转录因子(osterix,OSX)、I型胶原(collagen type I,COL I)等成骨特异性基因的转录,从而促进骨向分化[4],在骨形成中发挥重要作用[5]。目前对于Cbfα1活化的上游机制还知之甚少。
TAZ(PDZ binding transcriptional activator of transcription)即PDZ结合基序转录共激活因子,是Hippo信号通路下游的关键效应蛋白,在感知及介导机械信号过程中扮演重要角色。未发生磷酸化的TAZ进入细胞核后结合含有Pro-Pro-X-Tyr保守序列的转录因子,调控其转录活性[6]。研究已证实TAZ是Cbfα1的转录共激活因子,且与骨向分化调控有关[7-8]。新近关于TAZ作为细胞外机械信号传感器参与细胞分化的研究已成为研究热点。然而TAZ是否通过调控Cbfα1从而参与应力所促进的PDLCs的骨向分化,目前未见报道。
1 材料和方法
1.1 材料
1.1.1 主要试剂:胎牛血清(杭州四季青生物工程材料有限公司),DMEM培养基(美国Gibco公司),二甲基亚砜、地塞米松、甘油磷酸钠、抗坏血酸(美国Sigma公司),引物(上海捷瑞生物工程有 限公司),TRIzol Reagent(美国Invitrogen公司),反转录试剂盒(日本Takara公司),TAZ、Cbfα1、COL I抗体(美国Santa Cruz公司),OSX抗体(英国Abcam公司),OCN抗体(美国Milipore公司),GAPDH抗体(上海康成生物工程有限公司),波形蛋白、角形蛋白抗体(武汉博士德生物工程有限公司),BCA蛋白浓度试剂盒、Lipofectamine 6 000(上海碧云天公司)。
1.1.2 主要仪器:低温高速离心机(美国Beckman公司),PCR扩增仪、凝胶成像分析仪(美国Bio-Rad公司),Lightcycler480荧光定量PCR仪(美国Roche公司),倒置显微镜(日本Nikon公司),荧光显微镜(德国Leica公司)。
1.2 方法
1.2.1 人牙周膜细胞(human periodontal ligament cells,hPDLCs)的原代培养和鉴定:本研究的原代hPDLCs来自温州医科大学附属口腔医院口腔颌面外科门诊患者拔除的第三磨牙。患者年龄为18~30岁,全身无系统性疾病史,无家族遗传性疾病史,口腔卫生良好,无吸烟史。收集无牙体缺损、无龋坏,无炎症的第三磨牙。本研究通过本院伦理学审查,所有患者均签署知情同意书。PBS反复冲洗,刮取根中1/3 部分的牙周膜组织,用剪刀修剪成约1 mm3,0.3% I型胶原酶100 μL消化,离心,弃上清,PBS吹打,弃上清。加入1 mL完全培养基(含10% FBS),37 ℃,5% CO2培养24 h后补液至3 mL,每3 d换液。采用抗角蛋白和抗波形蛋白染色鉴定细胞来源。
1.2.2 张应力加载:取3~5代hPDLCs以2×105个/mL密度接种到BioFlex加力板中。待细胞长至80%,置于Flexcell 5 000 T装置,12%形变率,频率0.5 Hz,加力时间分别为24 h和48 h。
1.2.3 实时荧光定量PCR:依据TRIzol Reagent试剂盒说明,采用酚-氯仿提取法提取总RNA,取部分用于纯度测定。NanoDrop 2 000超微量分光光度计测定总RNA的浓度以及纯度(OD260nm/OD280nm),若两者比值介于1.8~2.0之间,则可认为纯度合格。依据PrimeScriptTMRT-PCR Kit试剂盒说明书,取20 μL反应体系,用于总量为1 000 ng的总RNA的反转录过程。依据实时荧光定量PCR SYBR Green染料法的要求,设计引物(见表1)。按照试剂盒要求,采用ABI StepOne Plus荧光定量PCR仪扩增cDNA模板。每个样本设3个复孔,取平均值。采用2-ΔΔCt法计算mRNA相对表达水平。

表1 引物序列
1.2.4 Western blot检测:将RIPA裂解液与蛋白酶抑制剂PMSF按照100:1的比例振荡混合;每孔均匀加入100 μL配置好的细胞裂解液,充分裂解20 min,轻柔刮取细胞裂解物;4 ℃,离心,取上清。BCA试剂盒测定蛋白浓度,将各组样本总蛋白调至相同,并在EP管中按样本量:5×loading buffer=4:1的比例加入loading buffer,ddH2O补足至20 μL上样体积;将配制好的样本置于100 ℃煮沸。配置8%分离胶和5%浓缩胶,上样,电泳、转膜和封闭,孵育一抗[兔属抗人TAZ抗体1:500,兔属抗人Cbfα1抗体1:1 000,兔属抗人OSX抗体1:1 000,山羊属抗人COL I抗体1:10 000,小鼠属抗人OCN抗体1:1 000,内参蛋白(兔属抗人抗体β-actin 1:2 000)],孵育二抗(山羊抗兔二抗1:4 000,兔抗山羊二抗1:8 000,山羊抗小鼠二抗1:8 000)。均匀滴加发光液孵育后曝光。
1.2.5 蛋白质免疫共沉淀(co-immunoprecipitation,Co-IP):新鲜配制含1 mmol/L PMSF Western blot及IP细胞裂解液,每孔中加入预冷的细胞裂解液100 μL,4 ℃裂解20 min,刮取裂解产物。4 ℃离心,取上清,取部分样本用作Input样本;BCA法测定蛋白浓度;根据蛋白浓度,取出含300~400 μg蛋白的上清转移到新的EP管中,每管总蛋白中加入0.5~1.0 μg TAZ抗体,缓慢摇晃过夜后,每管加入20 μL Protein A+G agarose,4 ℃离心去上清,收集的琼脂糖珠-抗原抗体复合物以60 μL 1×上样缓冲液重悬;将上样样品煮5 min,离心取上清行Western blot。
1.2.6 小干扰RNA(small interfering RNA,siRNA):在转染前1 d按照以细胞2×105个/mL接种到孔板内;转染前把孔板每孔换成2 mL新鲜DMEM(不含血清及抗生素);取2个无菌EP管,每管加入125 μL不含抗生素和血清的高糖DMEM培养基;一管加入100 pmol TAZ siRNA,轻轻吹打混匀,另一管加入5 μL Lipo 6 000转染试剂,轻轻吹打混匀;2管室温静置5 min,将含有Lipo 6 000转染试剂的培养液用移液枪加入含TAZ siRNA的培养液中,吹打混匀;将250 μL Lipo 6 000 siRNA混合物均匀滴加到整个孔内,随后轻轻混匀;细胞在转染后培养5 h后更换新鲜培养液;继续培养3 d后,Western blot检测TAZ的表达量,筛选合适的siRNA;对于合适的siRNA,转染后培养3 d对细胞加载张应力,收集细胞样本。所选用的siRNA序列为:TAZ siRNA:5’-CCCUAGG AAGGCGAUGAAUTT-3’,5’-AUUCAUCGCCUUCCUAGGGTT-3’;CON siRNA:5’-UUCUCCGAACGUGUCACGUTT-3’,5’-ACGUG ACACGUUCGGAGAATT-3’。
1.3 统计学处理方法 采用SPSS19.0软件进行统计学分析。计量资料以表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 hPDLCs的原代培养与鉴定 原代培养hPDLCs 7 d后,组织块周围有细胞呈放射状爬出,呈长梭型,胞浆饱满、均匀。14 d后,细胞继续生长,排列紧密,形态良好。传代后细胞无规则散在分布。免疫细胞化学染色示细胞波形蛋白染色阳性,角蛋白染色阴性。这证实该细胞为中胚层来源,即该细胞为hPDLCs。
2.2 张应力对hPDLCs骨向分化指标及TAZ表达的影响 应用Flexcell 5 000 T细胞应力加载仪对hPDLCs施加张应力(0.5 Hz,12%),分为对照组、张应力加载24 h组、张应力加载48 h组。随着张应力加载时间的增加,细胞成骨指标上调。实时荧光定量PCR结果示:COL I、OSX mRNA相对表达量随着张应力加载时间增加呈现明显上升;Cbfα1、OCN的相对表达量在24 h时未呈现明显变化,应力加载48 h时则呈现明显上调,差异均有统计学意义(P<0.05),见图1A。Western blot结果示:随着张应力加载时间的增加,Cbfα1、COL I、OCN、OSX蛋白相对表达量明显上升,而OCN的最高值出现在24 h,48 h时表达略有下降,差异均有统计学意义(P<0.05),见图1B。

图1 张应力对hPDLCs骨向分化的影响
2.3 张应力对TAZ表达及与Cbfα1结合的影响 选择24 h作为后续研究的应力加载时间。张应力加载能上调TAZ mRNA和蛋白水平的表达,差异均有统计学意义(P<0.05),见图2A-B。Co-IP检测TAZ与Cbfα1的结合状况,结果示:加载张应力后,在全细胞裂解样本中TAZ与Cbfα1蛋白表达均上升;应用TAZ抗体沉淀样本中的细胞内源性TAZ,比较相同TAZ量所结合的Cbfα1量发现,张应力组中TAZ所结合的Cbfα1蛋白量显著高于对照组(见图2C)。
2.4 TAZ沉默对hPDLCs骨向分化的影响 hPDLCs转染Con siRNA及TAZ siRNA 72 h后,以12%,0.5 Hz张应力作用细胞24 h,Western blot检测蛋白表达水平发现:转染Con siRNA的细胞在张应力加载后,COL I、Cbfα1、OCN的蛋白表达水平明显上升,与前述结果一致;转染TAZ siRNA的细胞,TAZ的蛋白表达水平明显下降,TAZ沉默有效。除OSX表达下降外,COL I、Cbfα1、OCN无明显变化;转染TAZ siRNA可显著下调张应力促进的骨向分化蛋白表达(见图3)。

图2 张应力对TAZ表达及与Cbfα1结合的影响
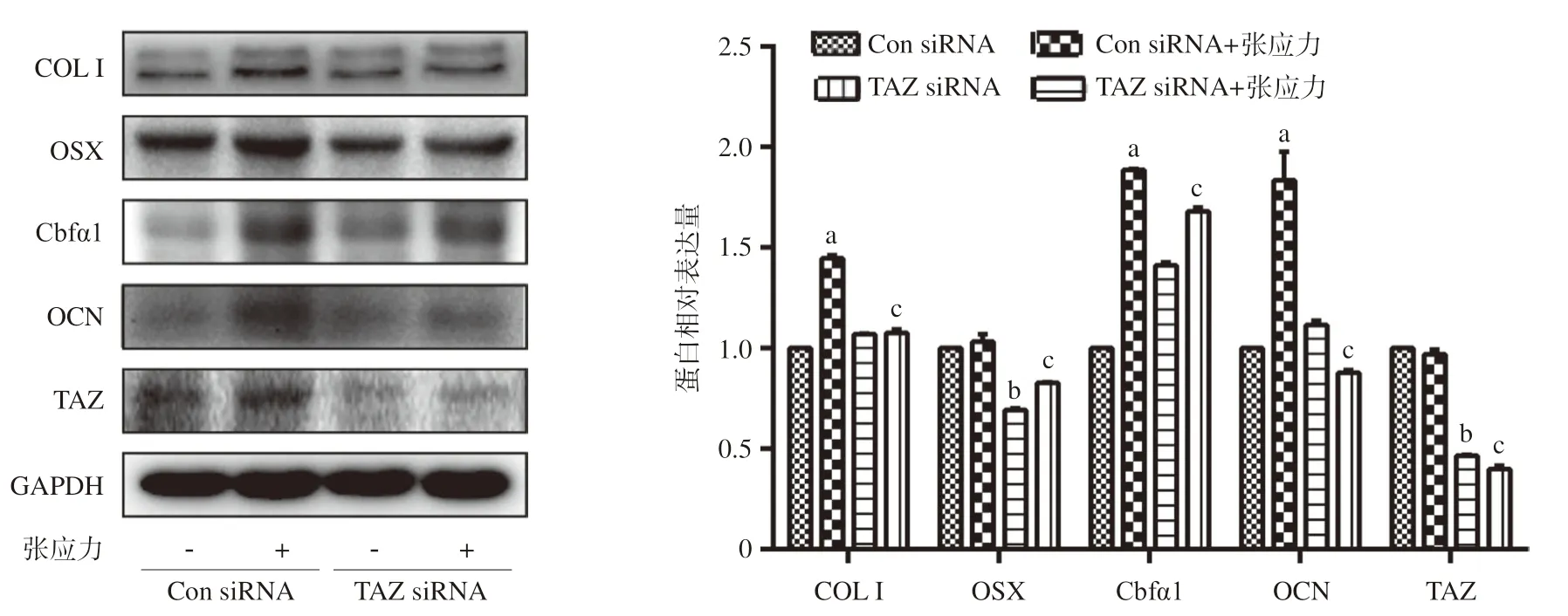
图3 TAZ沉默对张应力作用下TAZ及骨向分化蛋白表达的影响
3 讨论
Cbfα1在应力调控PDLCs骨向分化中发挥核心作用。研究发现Cbfα1基因敲除小鼠的骨骼形态正常,但无成骨细胞及成骨前体细胞,多种细胞外基质表达消失或减弱[9]。ZIROS等[10]研究发现,机械应力上调hPDLCs表达Cbfα1,同时与DNA的结合力也显著增强。宋京等[11]进一步发现张应力通过激活ERK1/2信号通路后上调Cbfα1的表达。Cbfα1在应力调控骨向分化中的上游机制尚未完全阐明。
多项TAZ的研究为阐明张应力调控Cbfα1转录活性从而参与骨向分化的机制提供了新途径。TAZ的分子结构有WW结构域,可与含有Pro-Pro-X-Tyr保守序列的转录因子结合,如Cbfα1等,调控其转录活性,发挥共激活作用;而磷酸化TAZ则与14-3-3结合蛋白连接,位于细胞质处于失活状态[6]。酵母双杂交实验最初发现:TAZ是Cbfα1 的转录共激活因子,与骨向分化密切相关[7];YANG等[12]证实TAZ转基因小鼠高表达Cbfα1和转化生长因子β,其颅骨细胞成骨蛋白表达及骨密度和骨小梁体积均增加;ZHANG等[13]发现TAZ慢病毒转染去势大鼠,可上调Cbfα1的表达,骨质疏松表型受抑制。此外,多囊蛋白1[14]、淫羊藿苷[15]等通过激活TAZ促进细胞的骨向分化。TAZ定位剂TM-25659,可提高TAZ核转移量,上调Cbfα1表达,促进成骨细胞分化。敲除TAZ基因后,成脂分化能力明显增强。此外TM-25659可明显缓解雌激素缺乏引起的骨量丢失[16]。以上均提示,TAZ通过调控Cbfα1在细胞骨向分化中发挥重要作用。
此后,DUPONT等[17]在Nature发文首次报道细胞外基质硬度、几何形态及细胞与基质间的黏着性等机械信号通过调控TAZ的表达以及核定位影响细胞增殖分化。据此推测,TAZ在细胞感知和响应力学信号中也可能发挥重要作用。对此本研究进行了深入探讨,利用国际公认的美国Flexcell系统构建张应力加载模型,探索TAZ在张应力调控hPDLCs骨架变化促进其骨向分化中的作用。结果发现,加载12%,0.5 Hz张应力24 h及48 h时显著促进hPDLCs的TAZ、Cbfα1、COL I、OSX、OCN表达 水平;后续实验发现,张应力作用hPDLCs,24 h时TAZ水平升高,入核增加,与Cbfα1的结合量相应增加;hPDLCs转染TAZ siRNA 72 h,加载12%,0.5 Hz张应力24 h,TAZ蛋白水平及张应力所促进的细胞成骨蛋白表达下降。初步证实TAZ通过调控Cbfα1表达和转录活性影响骨向分化功能,在张应力促进hPDLCs骨向分化中发挥调控作用。对于TAZ如何调控Cbfα1的表达,相关信号通路如何,还需今后进一步研究。
