姜黄素类似物L6H3对帕金森病大鼠脑部纹状体中单胺类神经递质代谢物的影响
2019-10-10邹瑜驰陈珺黄文婷刘欢胡健刘斐王冬雪朱丽云林丽
邹瑜驰,陈珺,黄文婷,刘欢,胡健,刘斐,王冬雪,朱丽云,林丽
(1.温州医科大学附属第一医院 老年医学科,浙江 温州 325015;2.温州医科大学 药学院,浙江温州 325035)
帕金森病(Parkinson’s disease,PD)是一种常见的神经系统退行性疾病[1]。PD的病理改变是脑部黑质致密部纹状体多巴胺(dopamine,DA)能神经元发生进行性变性,造成黑质纹状体内DA及相似酶系统的单胺类神经递质去甲肾上腺素(norepinephrine,NE)、5-羟色胺(5-hydroxytryptamine,5-HT)明显减少。研究报道姜黄素具有神经保护作用[2],姜黄素类似物L6H3[(E)-3-(4-羟基-3-甲氧基苯基)-1-(4-甲氧基苯基)丙-2-烯-1-酮]去除了姜黄素结构中的不稳定的β-二酮基团,具有更好稳定性的同时也能发挥与姜黄素相似的神经保护作用[3],而L6H3对PD及其脑内神经递质的影响鲜见报道。本研究探讨姜黄素类似物L6H3对PD大鼠脑部纹状体细胞外液中7种单胺类神经递质及其代谢物的影响。
1 材料和方法
1.1 材料
1.1.1 实验动物:35只SPF级雄性SD大鼠(6~8周龄),体质量250~300 g,由温州医科大学实验动物中心提供,实验动物许可证号:SCXK(浙)2015-001。
1.1.2 仪器:脑立体定位仪购于德国KOPF公司;微透析系统包括CMA402型微透析泵、CMA/12型微透析探针(透析膜长度2.0 mm,直径0.5 mm)、探针引导管、CMA120型清醒动物活动装置均购于瑞典CMA/Microdialysis公司。Agilent1100型高效液相色谱仪和Aglient C18色谱柱(2.1 mm i.d.×150 mm,5 μm)均购于美国Aglient公司;Decade II SDC电化学分析仪购于荷兰Antec Leyden公司;低温离心机购于美国Thermo Fisher公司;XEVO TQ-S micro质谱仪购于美国Waters公司。
1.1.3 试剂:6-羟基多巴胺(6-OHDA)、肾上腺素(epinephrine,E)、NE、DA、3,4-二羟基苯乙酸(3,4-Dihydroxyphenylaceticacid,DOPAC)、5-羟吲哚乙酸(5-HIAA)、高香草酸(homovanillic acid,HVA)、5-HT均购于美国Sigma-Aldrich公司。
1.2 方法
1.2.1 PD大鼠造模:大鼠腹腔注射10%水合氯醛(3 mL/kg)进行麻醉,使用耳杆将其头部水平固定于立体定位仪上,头部剃毛消毒,在头部做纵向切口,暴露前囟和人字点。参考《大鼠脑立体定位图谱》,选取右侧纹状体作为注射区,定位坐标为前囟0.7 mm、中线右旁3.0 mm、硬膜下5.5 mm,并使用台式牙科钻在颅骨上钻出注射口。微量注射器吸取1.5 μg/μL的6-OHDA溶液10 μL(由含有2.0 g/L维生素C的0.9%氯化钠溶液配制),并使用微量注射泵以10 nL/s的速度进行缓慢注射,且为了使药物充分弥散,每注射5 μL间隔留针5 min,注射完毕后也留针10 min,最后缓慢匀速退出注射器,缝合处理伤口,待其清醒后回笼正常饲养。
1.2.2 分组:手术后1周,对造模大鼠进行行为学检测,连续4周,每周1次,每次腹腔注射阿扑吗啡溶液(0.5 mg/kg)诱发大鼠旋转行为。取动物置于干净的盆地,观察大鼠行为,并记录每分钟大鼠向未损伤一侧旋转的次数以及0.5 h内旋转的总次数。旋转360°记为1圈/转(r),普遍认为30 min内旋转圈数稳定≥7 r/min时,判定该帕金森大鼠模型建立成功[4]。将造模成功的大鼠随机分为PD组,PD+L6H3组,每组10只。PD+L6H3组连续2周给予L6H3(腹腔注射,50 mg/kg)。另作15只假手术组大鼠,按上述同样坐标和操作方法,注射等体积含有2.0 g/L维生素C的0.9%氯化钠溶液。定期观察记录大鼠状态,并按时补充饲料和水分。
1.2.3 色谱条件:色谱柱Aglient C18柱(2.1 mm i.d.×150 mm,5 μm);流动相为pH=3.0的0.1 mol/L H3PO4-NaH2PO4缓冲液与甲醇的混合液(90:10,V/V;缓冲液中含2.0 mmol/L KCl、0.1 mmol/L Na2EDTA和0.74 mmol/L辛烷磺酸钠),流速为0.3 mL/min,柱温恒定37 ℃。电化学检测为三电极系统:以玻碳电极作为工作电极,Ag/AgCl电极为参比电极,并以不锈钢基体为辅助电极。工作电位为0.55 V,进样量为20 μL。
1.2.4 微透析活体取样:在造模后的第4周后开始给药,L6H3给药后第1、2周(即造模后第5、6周)和停药后第1周(即造模后第7周),用给药时已埋入的引导管分别对假手术组、PD组和PD+L6H3组(每组10只)进行脑部纹状体组织活体微透析取得细胞外液。取样时在大鼠轻度麻醉后将探针缓慢地插入引导管定位的纹状体区,而在大鼠清醒自由活动状态下,使用Ringer试剂为灌流液,以1.0 L/min的微透析速率收集样品。为了避免之前外科手术带来的损伤,前60 min的样品将会被弃去,收集的样品被置于-80 ℃冰箱保存备用。
1.2.5 LC-MS/MS检测鼠大脑皮质中L6H3的含量:L6H3给药24 h后,取鼠大脑皮质,称重后置于1.5 mL的EP管中,按比例加入裂解液后匀浆,离心10 min(12 000 r/min,4 ℃),取100 μL上清液转移至新EP管中,加入200 μL乙腈,涡旋1 min,再离心10 min(13 000 r/min,4 ℃),取上清液至内衬管中,放入进样瓶中进行LC-MS/MS检测。
2 结果
2.1 大鼠脑内L6H3含量的检测 给药后在鼠大脑皮层中能够检测到L6H3的存在,表明L6H3能透过大鼠的血脑屏障,见图1。
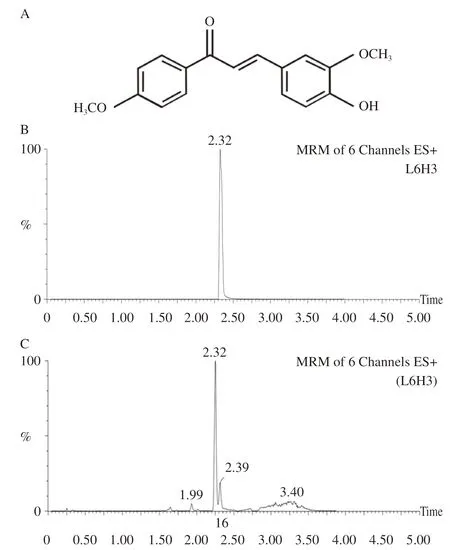
图1 L6H3的结构示意图及LC-MS/MS检测L6H3的色谱图
2.2 PD组大鼠脑部损伤侧纹状体中单胺类神经递质检测 PD组大鼠脑部纹状体细胞外液中单胺类神经递质的色谱分离图,各物质在30 min内能完全分离出来,见图2。
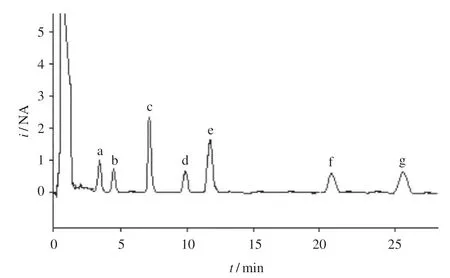
图2 PD组大鼠脑纹状体微透析液中单胺类神经递质的色谱分离图
2.3 3组大鼠脑部纹状体中单胺类神经递质的检测 与假手术组相比,PD组脑部损伤侧纹状体细胞外液中的DA、DOPAC、HVA、NE、E、5-HT和5-HIAA含量在造模4周后均显著降低,差异具有统计学意义(P<0.01)。与PD组相比,PD+L6H3组的DA、NE和E含量于造模第6周(给药第2周)和造模第7周(停药第1周)后明显升高,差异具有统计学意义(P<0.05);与PD组相比,PD+L6H3组的DOPAC、HVA、5-HT和5-HIAA的含量于造模第6周(给药第2周)和造模第7周(停药第1周)显著升高,差异具有统计学意义(P<0.01),见图3。
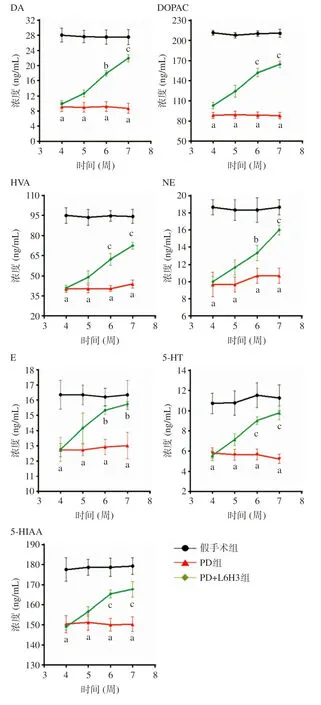
图3 造模后第4周、第5、第6周(给药后第1、第2周)及第7周(停药后第1 周)3 组大鼠纹状体中单胺类神经递质的变化
3 讨论
PD手术治疗费用昂贵,目前还是以药物治疗为主。如临床上较常使用的左旋多巴,只能通过外源性补充脑内DA,缓解PD症状,但其不能改善DA能神经元变性,对疾病的进程没有治疗作用。近年来,PD药物治疗由直接补充DA转向多环节治疗,重点集中于对DA能神经元的保护作用。
姜黄素是一种从姜科植物的根茎中提取的具有α,β-不饱和二酮的化合物[2]。该天然产物表现出降血脂、抗肿瘤、抗炎、抗氧化、保护DA能神经元等功能[5],但姜黄素也具有稳定性差、生物利用度低、不能通过血脑屏障等不能成药的缺点[6]。L6H3是去除姜黄素结构中不稳定的β-二酮基团,同时保留了姜黄素的有效治疗基团的姜黄素类似物。L6H3能顺利通过血脑屏障,具有不受给药途径限制的优点。本研究表明,L6H3能提高PD大鼠脑纹状体中单胺类神经递质及其相关代谢产物的产量,显示其可能具有DA能神经元保护作用,具体的作用机制有待进一步研究。
单胺类神经递质是调控机体生物活动的重要物质,也是中枢神经系统中发挥信息传递的物质。目前研究认为,PD病理表现的DA能神经元变性、死亡,导致脑内多种神经递质失衡,其中在黑质-纹状体通路以DA为代表的单胺类神经递质变化最为显著。NE是由脑内肾上腺素能神经末梢合成及分泌的神经递质,PD患者血清中NE的含量较低[7]。5-HT作为神经递质参与痛觉、睡眠和体温等生理功能调节。有研究显示[8],PD患者脑中5-HT出现轻到中度的降低,而持续性的5-HT降低可增加PD患者抑郁症状的发生。目前已有大量研究通过检测纹状体区域的单胺类神经递质作为PD的病理生理状态的评估[9]。
测定单胺类神经递质常用的方法有荧光法、放射酶学法、毛细血管电泳法和高效液相色谱法等。荧光法存在样品前处理复杂、结果重复性差等缺点。放射酶学法有较高的灵敏度,而操作条件严苛、技术难度高以及检测速度慢等缺点限制其使用与推广;色谱法具有分离效率高、选择性好的特点;电化学检测器具有灵敏度高、重现性好的特点。较HPLC-UV和HPLC-荧光,HPLC-ECD联用后灵敏度更高、检出值更低,更适用于检测脑组织中微量的单胺类神经递质及其代谢产物的含量[10]。目前HPLC-ECD已被广泛应用于检测实验动物脑中以及临床患者脑脊液中神经递质的含量,并且能够同时检测多种单胺类神经递质。
由于单胺类神经递质及其代谢产物在脑中的含量极少,且对光、热均不稳定,有效的样品处理方法同样是测定脑中神经递质的关键。而当前大多检测动物实验样品均是从已死亡的脑组织中提取的组织液,如液氮冻毙后的蜜蜂脑组织匀浆液[9]、大鼠脑组织匀浆液[11]、家兔脑组织匀浆液。动物的麻醉状态及后期样品的收集过程,都会对组织液中神经递质产生变化,因而其结果并不能真实地反映神经递质的变化。微透析活体取样为一种新型生物采样技术,它是通过将一个尖端带有可透过小分子物质的半透膜探针插入活体动物组织进行生物采样,能够在不影响动物正常生理活动的情况下收集生理活性样品,帮助动态研究生物体的某些生化物质的变化[12]。该方法收集的样品已直接排除蛋白质等大分子的干扰,具有处理操作快速简单的优点[13-14],能在最大程度上保留样品中神经递质含量。也有研究报道测量血浆[15]、尿液[16]中单胺类神经递质含量,但这只是通过检测神经递质代谢后的含量来间接反映神经递质释放情况;而纹状体微透析液中的细胞外神经递质主要来自于神经末梢的释放,因此纹状体细胞外液能够直接反映神经递质的释放情况。将微透析活体取样与HPLC-ECD相结合具有灵敏度高、分离有效和所需样品量小等特点。本研究采用微渗透活体取样与HPLC-ECD联用检测大鼠脑部纹状体细胞外液中7种单胺类神经递质及其代谢物,结果显示,6-OHDA造模后脑部纹状体细胞外液中单胺类神经递质及其代谢物的含量显著降低,再次验证了PD脑纹状体中单胺类神经递质的含量降低。给予L6H3 2周后,L6H3能使单胺类神经递质及其代谢物的含量升高。单胺类神经递质的变化是递质代谢疾病PD研究治疗药物的指标。更值得注意的是,在L6H3停药1周后单胺类神经递质及其代谢物的含量没有因为停药而降低,而是保持增加趋势,说明L6H3的治疗作用可能不是单纯的通过给药时上调单胺类神经递质含量,可能是通过发挥其DA能神经元的修复作用,其主要作用机制也值得进一步深入研究。
