过表达miR-26b-5p抑制HMGA1参与卵巢癌细胞上皮间质转化的机制
2019-10-08曹文红
曹文红
卵巢癌是妇科恶性肿瘤之一,发病率位居妇科恶性肿瘤第三位,死亡率位居第一位。其恶性程度高、侵袭转移能力强,极大影响女性生存质量[1]。鉴于其生理学特性,卵巢位于盆腔深部,早期缺乏特异性症状,且缺乏有效筛查途径,多数患者确诊时已是晚期。卵巢癌治疗效果差,生存率低,化疗易产生耐药性和复发,所以对卵巢癌的治疗是临床研究的一个重要问题。近年来,有研究数据提示,上皮间质转化在卵巢癌侵袭转移进程中起关键作用[2],发现miRNA参与多种生物过程,并与人类众多癌症息息相关[3]。miRNA在卵巢癌中具有特异性表达的特征,可作为肿瘤的标志物;且miRNA通过介导靶基因表达在实体肿瘤中发挥重要作用。上皮间质转化相关标志物E-cadherin和Vimentin的表达可提示肿瘤的进展[4,5]。本研究主要对miR-26b-5p介导HMGA1基因参与卵巢癌上皮间质转化的机制进行研究,为卵巢癌上皮间质转化提供分子学作用机制,促进卵巢癌分子靶向治疗。
1 材料与方法
1.1 实验材料 卵巢癌细胞系购于中国科学院上海生命科学研究所;Western blot抗体购于Abcam(Cambridge,UK);反转录试剂盒(Fermentas公司,USA);BCA试剂盒(碧云天,中国)。
1.2 组织样本收集 收集我院病理科40例卵巢癌患者卵巢上皮组织及40例健康人正常卵巢上皮组织。采用HE染色确认标本组织类型。本研究经我院医学伦理委员会批准审核并获组织提供者同意。
1.3 方法
1.3.1 miR-26b-5p靶基因预测 利用disgenet数据库对卵巢癌靶基因进行预测;利用miRDB对靶基因miR进行预测。
1.3.2 卵巢上皮细胞原代培养和卵巢癌细胞培养 以原代培养的正常卵巢上皮细胞作为内参。正常卵巢上皮细胞和卵巢癌细胞系SKOV3均置于常规CO2培养箱内培养。待细胞生长汇合到80%时常规胰酶消化、传代,采用对数生长期的细胞进行后续实验。
1.3.3 qRT-PCR 按照Trizol法提取组织和细胞RNA。取5 μl RNA样品稀释,并测定RNA的浓度和纯度。参照标准PCR检测程序,应用ABI7500定量PCR仪进行qRT-PCR实验。每对引物设3个复孔。以GAPDH为内参。
1.3.4 细胞分组转染 卵巢癌细胞分别进行分组转染,卵巢癌细胞分别改变miR-26b-5p表达(miR-26b-5p mimic)、HMGA1表达(sh-HMGA1)以及共转染实验(miR-26b-5p inhibitor+sh-HMGA1)。初步检测确定miR-26b-5p和MGA1表达后,对细胞进行分组:(1)为探究miR-26b-5p对卵巢癌细胞上皮间质转化的影响,分为miR-26b-5p mimic内参(negative control)组和miR-26b-5p mimic组;(2)为研究HMGA1是miR-26b-5p的功能性靶基因,细胞实验构建组别包括:mimic NC组、miR-26b-5p mimic组、inhibitor NC组、miR-26b-5p inhibitor组;(3)为研究MGA1调控卵巢癌细胞上皮间质转化,将细胞实验构建组别为:sh-HMGA1内参组和sh-HMGA1组;(4)为探究miR-26b-5p靶向HMGA1对卵巢癌细胞上皮间质转化的影响,将进一步构建miR-26b-5p inhibitor内参组及miR-26b-5p inhibitor+sh-HMGA1组。
1.3.5 Western blot实验 RIPA裂解提取待测组织和细胞的总蛋白。使用BCA法测蛋白浓度;上样、电泳、蛋白分离并转膜,随后封闭。加入一抗兔多克隆抗体:HMGA1、E-cadherin、Vimentin和GAPDH;处理后加入加辣根酶标记羊抗兔IgG,室温孵育。TBST洗膜后加入ECL化学发光液进行曝光,图片扫描,应用ImageJ分析软件处理实验数据。
1.3.6 划痕实验和Transwell侵袭实验 (1)取合适细胞接种至6孔板,移液枪小心划线,并测量细胞迁移距离并记录;(2)在Transwell上室中加入稀释Matrigel,37 ℃孵育;(3)消化、计数细胞,调整细胞密度,加入Transwell小室。所有步骤均按划痕和侵袭实验常规操作。
2 结 果
2.1 qRT-PCR检测miR-26b-5p和HMGA1表达 HE染色证实标本组织分别为卵巢癌组织和正常卵巢上皮组织,如图1所示。采用qRT-PCR检测卵巢组织中miR-26b-5p和HMGA1的表达。结果提示:与正常卵巢上皮组织相比,miR-26b-5p在卵巢癌组织中低表达(7.18±0.66vs4.33±0.28),HMGA1在卵巢癌组织中高表达(0.92±0.15vs2.71±0.40;P<0.05)。
进一步检测正常卵巢上皮细胞和卵巢癌细胞系SKOV3中miR-26b-5p和HMGA1的表达。结果提示:与正常卵巢上皮组织相比,卵巢癌细胞SKOV3中miR-26b-5p为低表达(0.85±0.21vs0.33±0.10);HMGA1在癌细胞中高表达(0.46±0.20vs1.44±0.37;P<0.05)。

图1 卵巢组织病理图片(HE,×100)
2.2 miR-26b-5p靶向抑制HMGA1表达 qRT-PCR结果提示:分别与mimic NC组和inhibitor NC组相比,miR-26b-5p在miR-26b-5p mimic组和miR-26b-5p inhibitor组分别呈显著上调和显著下调趋势,而HMGA1的mRNA和蛋白表达分别呈显著下调和显著上调趋势(均P<0.05,表1),而mimic NC组和inhibitor NC组差异无统计学意义。
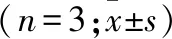
表1 qRT-PCR和Western blot检测转染后卵巢癌细胞中miR-26b-5p和HMGA1的表达
注:与mimic NC组比较,①P<0.05;与inhibitor NC组比较,②P<0.05
2.3 细胞转染对卵巢癌细胞上皮间质转化的影响 qRT-PCR和Western blot检测不同细胞转染处理对E-cadherin和Vimentin的mRNA和蛋白表达的影响(表2)。结果提示:与miR-26b-5p mimic内参组相比,miR-26b-5p mimic组E-cadherin的mRNA和蛋白表达均呈显著上调趋势,Vimentin的mRNA和蛋白表达均呈显著下调趋势(均P<0.05)。且与sh-HMGA1内参组相比,sh-HMGA1组E-cadherin的mRNA和蛋白表达均显著升高,而Vimentin的mRNA和蛋白表达均显著降低(均P<0.05)。
而与miR-26b-5p inhibitor+NC组相比,miR-26b-5p inhibitor+sh-HMGA1组E-cadherin的mRNA和蛋白表达均显著降低,而Vimentin的mRNA和蛋白表达均显著增加(均P<0.05,表2)。
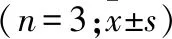
表2 qRT-PCR和Western blot检测细胞转染后卵巢癌细胞中上皮间质转化相关蛋白的表达
注:与miR-26b-5p mimic内参组相比,①P<0.05;与sh-HMGA1内参组比较,②P<0.05;与miR-26b-5p inhibitor+NC组相比,③P<0.05
2.4 细胞转染对卵巢癌细胞侵袭迁移的影响 与miR-26b-5p mimic内参组相比,miR-26b-5p mimic组癌细胞侵袭和迁移均呈显著降低趋势(均P<0.05)。同时,与sh-HMGA1内参组相比,sh-HMGA1组癌细胞侵袭和迁移均显著降低(均P<0.05,表3)。与miR-26b-5p inhibitor+NC组相比,miR-26b-5p inhibitor+sh-HMGA1组癌细胞侵袭和迁移均显著增加(均P<0.05)。
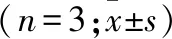
表3 细胞侵袭和划痕实验检测细胞转染后卵巢癌细胞侵袭迁移变化
注:与miR-26b-5p mimic内参组相比,①P<0.05;与sh-HMGA1内参组比较,②P<0.05;与miR-26b-5p inhibitor+NC组相比,③P<0.05
3 讨 论
本研究作为一项分子机制研究,关注miRNA转录后调控靶基因表达的小分子RNA在卵巢癌中的潜在功能。通过采集卵巢癌患者的癌组织及体检人群正常卵巢上皮组织,检测miR-26b-5p和HMGA1的表达情况,并通过细胞系实验进一步验证表达趋势。基于此,本研究进一步通过质粒转染,在细胞系试验中通过不同研究目的和质粒转染构建组别,逐一研究miR-26b-5p和HMGA1分别与上皮间质转化的关联,并在前述研究结果基础上,进一步确认miR-26b-5p靶向调控HMGA1表达进而调控上皮间质转化。
本研究纳入40例卵巢癌组织及40例正常卵巢上皮组织,检测发现miR-26b-5p在卵巢癌组织中低表达,HMGA1在卵巢癌组织中高表达,卵巢癌细胞系SKOV3趋势一致,为后续质粒构建奠定基础。与此同时,为验证生物数据库靶基因预测结果,本研究通过qRT-PCR和Western blot检测进一步验证HMGA1是miR-26b-5p的功能性靶基因。miR-26b-5p在miR-26b-5p mimic组和miR-26b-5p inhibitor组分别呈显著上调和显著下调趋势,而HMGA1分别呈显著下调和显著上调趋势,表明miR-26b-5p能够靶向抑制HMGA1表达。进而,qRT-PCR和Western blot检测miR-26b-5p mimic转染和sh-HMGA1转染后卵巢癌细胞上皮间质转化相关蛋白表达,发现分别上调和抑制miR-26b-5p和HMGA1的表达,E-cadherin的mRNA和蛋白表达均显著升高,Vimentin表达显著降低。此结果提示,miR-26b-5p高表达和沉默HMGA1表达能够抑制上皮间质转化,并抑制细胞侵袭和迁移。
本研究结果基本验证,miR-26b-5p和HMGA1表达的调控可影响卵巢癌上皮间质转化的假设。实验关键在于进一步确认miR-26b-5p是否可靶向调控HMGA1表达,进而调控上皮间质转化。因此,本实验进一步构建miR-26b-5p inhibitor内参组及miR-26b-5p inhibitor+sh-HMGA1组,通过qRT-PCR和Western blot检测E-cadherin和Vimentin表达。结果提示:下调miR-26b-5p表达(即miR-26b-5p inhibitor)能够促进癌细胞上皮间质转化,同时提高细胞侵袭和迁移能力,而共转染miR-26b-5p inhibitor和sh-HMGA1后,下调HMGA1表达对上皮间质转化的抑制作用得到逆转,因此推测下调miR-26b-5p表达能够通过靶向作用促进HMGA1的表达,进而促进上皮间质转化,同时促进卵巢癌细胞的侵袭和迁移。
本研究结果发现,上调miR-26b的表达,可在卵巢癌细胞发挥抑制增殖并诱导凋亡的作用;而HMGA1表达显著上升[6-8],那么抑制其表达,同样可发挥抑癌作用。本文机制探索为肿瘤靶向治疗提供新视角,例如,既往有研究报道,miR-26b-5p模拟物转染肺癌A549细胞可抑制增殖和诱导凋亡,而用miR-26b-5p抑制剂转染槐耳(草本天然菌)处理A549细胞可逆转槐耳抗肿瘤作用,提示可通过探索肿瘤分子机制通路,采用特定药物进行肿瘤靶向治疗[9]。众所周知,上皮间质转化是引发肿瘤细胞增殖侵袭的重要进程[10],可导致细胞极性的丧失,从而促进细胞迁移侵袭和抗凋亡能力。通过本文实验设计,基本可推测miR-26b-5p靶向调控HMGA1表达调控卵巢癌上皮间质转化的作用机制:上调miR-26b-5p表达和沉默HMGA1基因表达,进而促进上皮间质转化标志物E-cadherin的表达且抑制Vimentin表达,进一步抑制细胞侵袭和迁移[11]。本研究结果提示,miR-26b-5p具有逆转卵巢癌细胞上皮间质转化的能力,进一步降低细胞侵袭和迁移能力。与此同时,基于本研究探索可知,miRNA与靶基因关联复杂多样,单个miRNA可靶向多个靶基因且单个靶基因亦可受多个miRNA调控[12];此种复杂的靶向和调控关系,提示卵巢癌上皮间质转化还存在其他机制性靶点[13,14],从而影响卵巢癌细胞的恶性生物学行为,可为卵巢癌及其他肿瘤的分子靶向治疗提供帮助。
综上所述,miR-26b-5p在卵巢癌中低表达,HMGA1高表达;过表达miR-26b-5p抑制卵巢癌细胞中HMGA1和Vimentin表达并促进E-cadherin表达,降低细胞侵袭和迁移,从而抑制卵巢癌细胞上皮间质转化,但其意义是否显著还有待进一步探究。
