定量组织速度成像和应变率显像对重型β-地中海贫血儿童心功能的研究
2019-09-29刘麟欧振恒刘琮李长钢曾少颖王树水
刘麟 欧振恒 刘琮 李长钢 曾少颖 王树水


【摘要】 目的:分别探讨定量组织速度成像技术和应变率显像技术评估重型β-地中海贫血儿童心脏整体和局部功能的价值。方法:选取2010年3月-2017年3月在深圳儿童医院确诊为重型β-地中海貧血且长期输血的儿童42例为地贫组,以年龄、体重相匹配的正常儿童42例为对照组。分别用定量组织速度成像(QTVI)和应变率显像技术(SRI)检测两组心功能。定量组织速度成像测量各心肌节段的收缩期心肌运动峰值速度Sw。应变率显像技术测量各心肌节段的收缩期应变率SRs,行敏感指标与累积输血量相关性分析。结果:常规超声心动图指标中,地贫组LVEF、FS与对照组比较,差异均无统计学意义(P>0.05),地贫组CI高于对照组(P<0.05);QTVI测定的局部收缩功能指标示地贫组左室侧壁基底段心肌运动峰值速度LV-Sw为(5.19±0.36)cm/s显著低于对照组(P<0.05);SRI测定的左室侧壁基底段收缩期应变率LV-SRs为(-1.40±0.35)s-1,绝对值显著低于对照组(P<0.05),LV-SRs与输血累积单位呈负相关(r=-0.672,P<0.05)。结论:重型β-地中海贫血患者心功能损伤以左室侧壁局部收缩障碍为主,QTVI和SRI指标都能定量检测到重型β-地中海贫血患者早期局部收缩功能障碍,左室侧壁基底段收缩期应变率LV-SRs较好反映左室侧壁心肌变形速率,与输血累积量呈负相关,是反映重型
β-地中海贫血患者早期心功能损害的理想指标。
【关键词】 定量组织速度成像; 应变率显像; 超声心动图; β-地中海贫血; 心脏功能
Assessment of Cardiac Function in Children with β-thalassemia Major by Quantitative Tissue Velocity Imaging and Strain Rate Imaging/LIU Lin,OU Zhenheng,LIU Cong,et al.//Medical Innovation of China,2019,16(19):00-005
【Abstract】 Objective:To evaluate global and regional systolic cardiac function by quantitive tissue velocity imaging(QTVI)and strain rate imaging(SRI)in transfusion-dependent β-thalassemia patients,and investige the early diagnostic value of cardiac dysfunction.Method:42 patients of transfusion-dependent β-thalssemia with presevered ejection fraction were enrolled as thalassemia major group from March 2010 to March 2017,the age and weight matched healthy children of 42 cases were enrolled as control group.Conventional echocardiography,QTVI and SRI were performed respectively to evaluate systolic function of all subjects.QTVI measurements included systolic peak velocity(Sw)of all myocardial segments.SRI measurements included systolic strain rates(SRs)of myocardial segments.The correlation analysis was made between sensitive parameters and blood transfusion accumulation doses.Result:The LVEF and FS in the thalassemia major group and control group did not show significant difference(P<0.05),but the CI in thalassemia group was higher than that of control group(P<0.05).The QTVI parameters of the LV-Sw in the basal segments of LV lateral wall of thalassemia major group was(5.19±0.36)cm/s significantly lower than that of the control group(P<0.05).The SRI parameters of the systolic LV-SRs in basal segment of LV lateral wall in thalassemia major group was(-1.40±0.35)s-1 significantly lower than that of the control group(P<0.05).The systolic
LV-SRs in basal segment of LV lateral wall had a good negative correlation with the blood transfusion accumulation dose
(r=-0.672,P<0.05).Conclusion:The regional cardiac dysfunction mainly takes place in the left lateral wall prior to the onset of global cardiac dysfunction in β-thalassemia major patients.QTVI and SRI both can detect regional systolic dysfunction in the early stage.The systolic strain rate in basal segment of LV lateral wall(LV-SRs)has a good correlation with blood transfusion accumulation dose.It is a valuable parameter in early diagnosis of cardiac systolic dysfunction in β-thalassemia major patients.
【Key words】 Quantitative tissue velocity imaging; Strain rate imaging; Echocardiography; β-thalassemia; Cardiac function
First-authors address:Shenzhen Childrens Hospital,Shenzhen 518026,China
doi:10.3969/j.issn.1674-4985.2019.19.001
地中海貧血是我国长江以南发病率最高、影响最大的遗传病之一,因血红蛋白的珠蛋白链合成障碍引起的无效红细胞生成及溶血导致严重的贫血,重型地中海贫血患者需反复输血治疗。由于反复输血,肠道对铁的吸收增加,使重型地贫患者体内铁负荷过重,并发心功能衰竭、肝硬化、垂体功能低下等多脏器损伤[1],其中心功能衰竭是重症地贫患儿死亡的首要原因,强化祛铁治疗能减轻心脏损害,一旦出现心功能衰竭,仅有50%的患者幸存[2]。因此,在患者出现不可逆转的心功能损害前及早诊断、积极祛铁治疗有极为主要的意义。心脏MRI技术能定量评估患者的铁负荷以及心脏功能[3],但其费用高耗时长,应用受到较大限制。本研究拟通过组织多普勒中定量组织速度成像(Quantitative tissue velocity imaging,QTVI)和应变率显像(Strain rate imaging,SRI)技术,定量评估长期依赖输血治疗的重型β-地中海贫血患者的心脏收缩功能,探讨并比较定量组织速度成像(QTVI)和应变率成像(SRI)技术在重型β-地中海贫血患者心脏功能损害中的早期诊断价值,现报道如下。
1 资料与方法
1.1 一般资料 选取2010年3月-2017年3月在深圳儿童医院进行输血治疗并长期随访的重型β-地中海贫血患者42例为地贫组,所有患者均根据临床表现、血红蛋白电泳实验和基因检测确诊为重型β-地中海贫血。研究对象及监护人均知情同意,该研究已经医院伦理学委员会批准。纳入标准:年龄大于6岁,长期高量输血治疗(输血大于12单位/年),输血年限1年以上。排除标准:心衰患者,风心病或先天性心脏病病史者,近期感染或心脏活性药物使用史者。
1.2 仪器与方法 患者组以及对照组均完善常规超声心动图、QTVI以及SRI检测。使用GE Vivid 7 Dimension 彩色多普勒超声诊断仪,探头频率为2.0~4.0 MHz。系统内置QTVI和SRI的图像分析和后处理软件,可自动定量分析8个心肌节段同步组织多普勒曲线的时相、速度和应变率等参数。
1.2.1 常规超声心动图 受检者取左侧卧位,连接心电图,平静呼吸,探头于胸骨旁左心长轴切面使用标准M型模式测量LVEDd(左室舒张末期内径)、LVEDs(左室收缩末期内径),IVSd(室间隔舒张末期最大厚度)和LVPWd(左室后壁舒张末期最大厚度)。以Teich-holtz法计算左室射血分数(LVEF),短轴缩率(FS),心脏指数(CI)。
1.2.2 QTVI测量 在QTVI模式下,取标准心尖四腔切面,运动冻结于舒张早期,在定量分析模式中取样容积分别置于左心室侧壁,右室游离壁和室间隔,分别记录从基底段,中段到心尖段的心肌速度-时间曲线。取3个心动周期的平均值,得到收缩期心肌运动峰值速度(Sw),根据速度-时间曲线记录室壁异常运动。
1.2.3 SRI测量 在SRI模式下,取舒张早期心尖四腔切面,取样容积分别置于左心室侧壁,右室游离壁和室间隔,图片于冻结收缩早期分别记录从基底段和中段的心肌应变率-时间曲线分析各个节段的收缩期应变率SRs。各参数取三个心动周期的平均值,因心尖段SRs受角度影响较大,未对心尖段进行取样。
1.3 统计学处理 使用SPSS 13.0统计软件进行分析,计量资料采用(x±s)表示,比较采用t检验,计数资料采用率(%)表示,比较采用字2检验,采用Pearson相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 两组基线资料比较 地贫组男24例,女18例;年龄6~17岁,平均(10.9±2.9)岁,平均体重(25.0±4.9)kg,其中18例患者未正规祛铁治疗。选取与患者在年龄、体重匹配的正常儿童42例作为对照组,经病史、超声心动图初筛排除心肺疾患,其中男21例,女19例,平均年龄(11.1±3.2)岁,平均体重(30.1±4.3)kg。两组年龄、性别、体重比较,差异均无统计学意义(P=0.61),具有可比性。
2.2 常规超声心动图指标的比较 患者组反映心脏整体收缩功能的LVEF、FS都在正常范围内,与对照组相比差异无统计学意义(P>0.05)。地贫组CI明显高于对照组,差异有统计学意义(P<0.01)。
见表1。
2.3 QTVI指标的比较
2.3.1 QTVI中反映局部心肌功能的指标Sw的比较 地贫组患者左室侧壁基底段Sw低于对照组,差异有统计学意义(t=5.50,P<0.05);地贫组患者右室游离壁基底段Sw高于对照组,差异有统计学意义(t=1.70,P<0.05)。见表2。
2.3.2 两组收缩期局部室壁运动异常检出率的比
较 QTVI速度-时间曲线显示室壁运动规律为心肌的运动速度同一室壁从基底段到心尖段逐渐减低,患者组与正常对照组有相近的变化规律,见图1。
将QTVI的速度-时间曲线收缩相观察到以下现象定义为收缩期局部室壁运动异常:(1)QTVI速度-时间曲线丧失正常收缩时心底到心尖呈逐渐降低规律;(2)波形延迟出现;(3)波形方向与正常相反或呈正负双向,见图2。地贫组收缩期局部室壁运动异常检出率为28.57%(12/42),對照组收缩期局部室壁运动异常检出率为2.38%(1/42),两组比较差异有统计学意义(P<0.05)。
注:室壁心肌速度-时间曲线示心肌运动规律从基底段到心尖段速度递减,收缩期基底段速度a(7.5 cm/s)>中段速度b(2.8 cm/s)>心尖段速度c(0.2 cm/s)。
注:收缩早期中段速度d(6 cm/s)>基底段速度e(5.4 cm/s)>心尖段速度f(-0.6 cm/s),收缩早期心肌局部运动失去正常递减规律;g基底段探及正负双向异常波形
2.4 两组应变率显像SRI测量指标的比较 地贫组中左室侧壁基底段、中段SRs绝对值明显小于对照组,差异有统计学意义(P<0.05);地贫组右室游离壁基底段和中段的收缩期应变率SRs绝对值高于对照组,差异有统计学意义(P<0.05)。见表3。
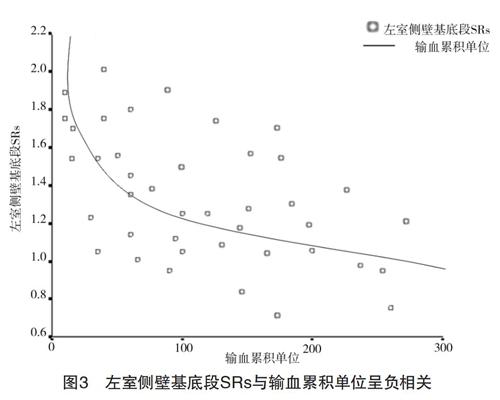
2.5 QTVI以及SRI指标与输血累积单位的相关性比较 地贫患者组的祛铁治疗不规律,故输血累积单位能间接反映出患者体内铁负荷状态。将QTVI以及SRI测值中最敏感的指标左室侧壁基底段LV-Sw、左室侧壁基底段LV-SRs分别与输血累积单位进行相关性分析:左室侧壁基底段LV-Sw与输血累积单位无相关性(r=0.100,P=0.640);左室侧壁基底段LV-SRs与输血累积单位呈负相关(r=-0.672,P<0.01)。见图3。
3 讨论
心脏病变是影响重型地中海贫血患者生存质量的重要因素,约1/3的重型地中海贫血患者在35岁前死于心脏病变。心肌铁负荷过重是重症地中海贫血患者心脏病变的主导因素[4],此外自身免疫性心肌炎、贫血性心脏病和继发于肺含铁血黄素沉着的肺动脉高压等多种病理因素综合作用[5-6],致使心脏功能损害,最终出现难治性心力衰竭,这也是患者死亡的首要原因。尽管心力衰竭的发生时间较晚,一旦发生,往往预后不良[7]。在重症地中海贫血患者中,当体内铁沉积超过20 g这个界限后[2],很可能出现明显的心功能不全,且这种损害往往是不可逆转的,因此在出现不可逆转的心脏病变之前及早诊断,早期积极强化祛铁疗法具有非常重要的意义。
重症地中海贫血的铁负荷累积和心脏功能损害是缓慢渐进的过程,由于发展至心力衰竭的时间相对较长,临床上可以长期无心功能不全和运动耐量降低的表现,因此对其心脏病变的早期诊断也很困难。心脏MRI是近年来以无创手段评估地贫患者心脏病变的可靠方法[8],其不仅能直接测量心脏功能,还能定量检测心脏铁负荷,但其费用高耗时长,实际运用受较大限制。常规超声心动图中LVEF、FS等指标虽然对地贫患者心脏整体收缩功能的监测有一定价值,但敏感性欠佳,限制了其早期诊断的价值。多个研究证实,重型地中海贫血患者在疾病最后阶段才出现整体的收缩功能降低[5,9]。本研究显示,地贫组的CI较对照组增加明显(P<0.05),提示慢性贫血导致机体通过增加心率和心搏量来增加心排血量,表现为高动力循环状态。但与贫血性心肌病患者的高动力循环状态所不同的是,地贫组反映整体收缩功能的LVEF和FS与对照组相比,差异无统计学意义(P>0.05),这与文献[9]相符合。Fiorillo等[10]对地贫患者长期随访研究显示重症地中海贫血患者的心肌重塑过程中,早中期以局部心肌功能障碍为主,而心脏整体收缩功能可长时间维持正常,直到最终才发展到整体收缩功能降低,这也为以QTVI和SRI技术检测地贫患者的局限心肌功能障碍来进行早期诊断提供了依据。
QTVI是一种直接定量分析检测心肌运动的手段,能将统一切面上不同区域心肌节段的速度显示在同一时间轴上,同步测定不同心肌节段收缩和舒张的速度和时间,在评估局部的心功能变化上相对只能整体评估心脏功能的常规超声技术有较多的优势[11]。本研究显示,与对照组比较,地贫组左室侧壁基底段的收缩期峰值速度LV-Sw显著降低(P<0.05),因基底段是左室壁心肌运动速度最大的节段,其降低提示QTVI能敏感检查早期心肌局部收缩功能的降低。地贫组右室游离壁基底段的收缩期心肌运动峰值速度RV-Sw高于对照组(P<0.05),提示地贫组右室游离壁基底段运动速度增加,这可能与右室容量负荷增多和心肌运动不协调有关。Vogel等[12]报道在重型地中海贫血患者地贫患者存在局部收缩功能异常,以左室收缩功能的损害为主,与本研究结果相符。推测其原因可能为左室作为主心泵,承担体循环的前后负荷,同时其肌纤维较多,在左室心肌中的铁沉积物较多,因此对左室收缩功能的损害会较右室显著。同时本研究发现QTVI能较好地客观检出局部室壁运动异常,地贫组收缩期局部室壁运动异常检出率为28.57%,而对照组收缩期局部室壁运动异常检出率为2.38%,差异有统计学意义(P<0.05),出现局部室壁运动异常的患者心脏整体收缩功能正常,也支持其可能是地贫患者局部心肌病变的早期征兆,这与Vogel等[12]报道一致。
SRI技术是近年来逐渐发展的成熟起来的新技术,能够定量分析局部心肌的变形,由于应变率成像的时间和空间分辨率都很高,可以精确地识别不同节段之间心肌变形的细微差别[13]。应变率因不受邻近心肌牵拉效应和心脏整体运动的影响,而更加准确地评估局部心功能,在定量评估局部心肌运上比定量组织速度成像技术更准确可靠[14]。本研究显示地贫组中左室侧壁基底段、中段SRs绝对值明显小于正常对照组(P<0.05),其中以左室侧壁基底段SRs降低更为显著,说明地贫患者的上述节段的心肌变形能力降低,顺应性降低,收缩功能降低,这与QTVI测得的左室侧壁基底段Sw降低相一致[15]。同时地贫组右室游离壁基底段和中段的收缩期应变率SRs绝对值高于正常对照(P<0.05),提示右室游离壁的变形程度增大,也与QTVI测得的右室游离壁基底段RV-Sw增加相一致。因此,SRI技术能敏感检出早期心肌局部收缩功能的异常,左室侧壁基底段LV-SRs可以定量反映重症地中海贫血患者心肌局部收缩功能的改变。
本研究显示QTVI成像和SRI成像测定得到一致的结果,即左室侧壁基底段LV-Sw和LV-SRs明显降低,提示左室侧壁基底段有心肌运动速度减弱和心肌变形速度減弱,提示地贫患者局部收缩功能降低主要体现在左室侧壁基底段,左室侧壁基底段LV-Sw和LV-SRs在早期诊断心肌的局部收缩功能异常上有一定价值。将左室侧壁基底段LV-Sw和LV-SRs分别与输血单位累积量进行相关性分析,发现左室侧壁基底段LV-Sw与输血单位的相关性不佳(r=0.100,P=0.640);而左室侧壁基底段LV-SRs与输血单位呈负相关(r=-0.672,P<0.01)。说明左室侧壁基底段LV-SRs较LV-Sw能较好地反映左室局限收缩功能的降低,更有早期诊断价值。
综上所述,重型β-地中海贫血患者,局部心脏功能损害早于整体心脏功能的损害。重型β-地中海贫血患者早期局部心脏收缩功能损害以左室侧壁基底段为主,QTVI和SRI指标都能在心脏整体收缩功能尚正常的阶段定量检测到重型β-地中海贫血患者心脏早期局部收缩功能障碍并及早做出诊断。左室侧壁基底段收缩期应变率LV-SRs反映左室侧壁心肌变形速率,与患者输血累积量呈负相关,是反映重型β-地中海贫血患者早期心脏局部收缩功能损害的理想指标。
参考文献
[1] Thuret I,Pondarré C,Loundou A,et al.Complications and treatment of patients with β-thalassemia in France:results of the National Registry[J].Haematologica,2010,95(5):724-729.
[2] Gardenghi S,Ramos P,Follenzi A,et al.Hepcidin and Hfe in iron overload in β-thalassemia[J].Annals of the New York Academy of Sciences,2010,1202(1):221-225.
[3] Mavrogeni S I,Markussis V,Kaklamanis L,et al.A comparison of magnetic resonance imaging and cardiac biopsy in the evaluation of heart iron overload in patients with beta-thalassemia major[J].European Journal of Haematology,2015,75(3):241-247.
[4] Modell B,Khan M,Darlison M,et al.Improved survival of thalassaemia major in the UK and relation to T2* cardiovascular magnetic resonance[J].J Cardiovasc Magn Reson,2008,10:42.
[5] Aessopos A,Kati M,Farmakis D.Heart disease in thalassemia intermedia:a review of the underlying pathophysiology[J].Haematologica,2007,92(5):658-665.
[6] Derchi G,Lai M E,Marcaccini P,et al.Human immunodeficiency virus and beta-thalassemia major:A “competition of guilt” for pulmonary arterial hypertension.Report of a case and a review of the literature[J].Hemoglobin,2010,34(1):61-66.
[7] Hajipour M,Soltani M,Najafifar R,et al.Complications of Beta-Thalassemia Patients and Their Related Factors in Iran[J].International Journal of Development Research,2015,5(7):5009-5014.
[8] Marsella M,Borgna-Pignatti C,Meloni A,et al.Cardiac iron and cardiac disease in males and females with transfusion-dependent thalassemia major:a T2* magnetic resonance imaging study[J].Haematologica,2011,96(4):515-520.
[9] Ozdogan O,Alp A,Turker M,et al.Determination of early cardiac deterioration in beta-thalassaemia major by echocardiography[J].Acta Cardiologica,2013,68(3):299.
[10] Fiorillo A,Farina V.Longitudinal assessment of cardiac status by echocardiographic evaluation of left ventricular diastolic function in thalassaemic children[J].J Acta paediatrc,2000,89:436-441.
[11] Weidemann F,Kowalski M,Dhooge J,et al.Doppler myocardial imaging.A new tool to assess regional inhomogeneity in cardiac function[J].Basic Res Cardiol,2001,96(6):595-605.
[12] Vogel M,Anderson L J,Holden S,et al.Tissue Doppler echocardiography in patients with thalassemia detects early myocardial dysfunction related to myocardial iron overload[J].Eur Heart J,2003,24(1):113-119.
[13] Liu W,Huang C L.Clinical Application and Development of Left Atrial Function Evaulation in Essential Hypertensive Patients by Using Strain Rate Imaging[J].Medical Recapitulate,2011,17(4):613-615.
[14] Abraham T P,Nishimura R A,Holmes D R,et al.Strain rate imaging for assessment of regional myocardial function:results from a clinical model of septal ablation[J].Circulation,2002,105:1403-1406.
[15] Hamdy A M.Use of strain and tissue velocity imaging for early detection of regional myocardial dysfunction in patients with beta thalassemia[J].European Journal of Echocardiography,2007,8(2):102-109.
