肾毒血清肾炎动物模型的造模方法及其免疫机制评述
2019-09-27吕晶晶黄岩杰郭庆寅吴光华杨晓青
吕晶晶,黄岩杰*,郭庆寅,吴光华,杨晓青
(1.河南中医药大学第一附属医院儿科,郑州 450000; 2.河南中医药大学,郑州 450046)
新月体肾炎是一个病理学诊断,指有新月体形成的肾小球超过全部肾小球的50%,新月体超过肾小囊面积的50%,诊断需依靠肾活检[1]。根据其免疫荧光表现不同分为三型[2]:Ⅰ型为抗肾小球基底膜(glomerular basement membrane,GBM)抗体型,代表性的动物模型为实验性自体免疫肾小球肾炎模型,属于主动诱导模型,多用于研究原发性抗GBM抗体型肾小球肾炎(不伴肺出血)和Goodpasture综合征(伴肺出血);Ⅱ型为免疫复合物型,其代表性的动物模型为肾毒血清肾炎(nephrotoxic serum nephritis,NTSN)模型,主要用于研究免疫复合物介导的新月体肾炎;Ⅲ型为寡免疫复合物型,针对这一型尚无理想的动物模型,目前多使用实验性自体免疫脉管炎模型。三种动物模型分别用于研究不同的疾病,其中NTSN模型病变典型、应用广泛,造模方法繁琐、免疫机制复杂,下面主要针对NTSN模型的造模方法、免疫机制进行评述。
1 概述
NTSN动物模型是将肾毒血清经静脉一次性注射免疫动物制备而成,临床表现多为蛋白尿、肾功能下降等,肾组织病理可见固有细胞增生、炎性细胞浸润、GBM断裂、包曼氏囊有新月体形成等,免疫荧光可见GBM外侧有颗粒团块状免疫复合物(主要为IgG、C3)沉积,是具有典型的人类新月体肾炎病理变化的动物模型。该模型可用于研究循环免疫复合物介导的有新月体形成的原发性和继发性肾病的发病机制、免疫机制、治疗方案等,如原发性IgA肾病,狼疮性肾炎(Ⅲ、Ⅳ)、紫癜性肾炎等。
2 溯源及改良过程
2.1 溯源
1900年,Lindeman[3]创建了NTSN模型,用兔肾免疫豚鼠,然后将豚鼠的血清注射给健康家兔,家兔出现了蛋白尿和尿毒症,这是该模型的雏形。
2.2 改良后的Masugi肾炎和加速型NTSN模型
1932年,Masugi对该模型进行了改良,他将大鼠的肾皮质匀浆后反复免疫家兔,然后用兔抗大鼠肾皮质的肾毒血清免疫大鼠制备NTSN,因此该模型又称为Masugi肾炎。Masugi肾炎具有与人类新月体肾炎类似的表现,如肾固有细胞增生、炎性细胞浸润、基底膜断裂、新月体形成等,但制备时间长,免疫反应弱,不利于研究[2]。
1965年,Unanue等[4]对该模型进一步改进,他们用兔IgG对Sprague Dawley(SD)大鼠进行预免疫后再注射肾毒血清来进行造模,结果经预免疫的大鼠提前出现了肾组织学改变,造模过程明显缩短,学者将其称为加速型NTSN。1994年,任国辉等[5]也使用该方法成功建立了SD大鼠的加速型NTSN模型。脂多糖(lipopolysaccharide, LPS)作为免疫增强剂,可以替代IgG进行预免疫建立加速型NTSN[6]。
目前,不论是改良后的加速型NTSN模型[7-8]还是非加速的NTSN模型[9-12]都在沿用,但加速型模型使用最广泛。
3 造模
NTSN模型的建立,包含选择易感的实验动物、制备纯化的肾毒血清、造模(加速型、非加速型),其关键在于实验动物的选择和血清的制备。
3.1 选择易感动物
建立动物模型,选择易感动物是造模成功关键的第一步。目前大鼠造模方法成熟,在国内外研究中广泛使用。国外使用Wistar-Kyoto(WKY)大鼠者居多,其模型具有典型的新月体形成的组织病理表现,如肾固有细胞增生、炎细胞浸润、基底膜断裂、新月体形成等[13-14]。Takabatake等[9]使用WKY大鼠建立非加速型的NTSN模型,在第8天模型组大鼠60%的肾小球有新月体产生。WKY大鼠对肾毒血清敏感,新月体产生所需时间短。有研究表明WKY大鼠含有易感基因Crgn1和Crgn2,分别位于13和16号染色体上[15]。
WKY大鼠敏感性好、病变典型,但价格昂贵,约为普通SD大鼠的4~5倍。SD大鼠也可用于该模型的建立,Unanue等[4]在创建加速型NTSN模型时使用的就是SD大鼠,目前国内外新月体肾炎研究中也均有使用[16-19]。王坤等[16]选取体重190~205 g的雄性SD大鼠,建立加速型NTSN模型,2周后正常对照组未见新月体形成,模型组新月体形成率超过50%,以细胞性新月体为主,部分为纤维细胞性新月体。Karavana等[20]也用180~200 g的雄性SD大鼠建立了加速型NTSN模型,14 d观察模型组蛋白尿明显高于对照组,且肾组织中发现小球和球旁有巨噬细胞和单核细胞浸润,并可见纤维细胞性新月体。由此可见,SD大鼠虽可用于NTSN的造模,但是较WKY大鼠产生新月体的时间长,加速型模型一般大于2周,而WKY非加速型模型约1周左右[9]。
除了WKY大鼠、SD大鼠外,Wistar大鼠也可用于造模[21-22]。但并不是所有的大鼠都适于该模型的建立,如从Wistar品系繁育而成的Lewis(LEW)大鼠被注射肾毒血清后就不会产生新月体,常用于阴性对照。那么把WKY的易感基因转染给LEW大鼠会不会产生新月体呢?Zelpha等[23]将WKY大鼠的易感基因Crgn1、Crgn2转染给LEW大鼠得到LEW.WCrgn1、LEW.WCrgn2、LEW.WCrgn1,2三种转基因大鼠,然后对8周龄的雄性WKY、LEW、LEW.WCrgn1、LEW.WCrgn2、LEW.WCrgn1,2大鼠均静脉注射等量的肾毒血清,9 d后检测24 h尿蛋白含量发现LEW.WCrgn1,2组低于WKY组,但是明显高于其他三组;同时含有WKY大鼠易感基因Crgn1和Crgn2的LEW.WCrgn1,2大鼠有新月体产生,但是少于WKY组,而LEW大鼠和含单一易感基因的LEW.WCrgn1、LEW.WCrgn2大鼠均无新月体产生。因此Crgn1和Crgn2为WKY大鼠的易感基因,且需同时存在。LEW.WCrgn1,2大鼠新月体产生较少,易感性较差,且转基因LEW.WCrgn1,2需要一定的技术支持,因此少用。
除了大鼠外,小鼠转基因种类丰富、技术成熟,也可用于该模型的建立,如C57BL/6[24-26]、pod-EGFP[27]、CD1小鼠[11,24]等。李向阳等[6]使用小鼠建立加速型模型,第14天模型组光镜下可见肾小球壁层上皮细胞增生,新月体形成,肾小囊囊腔缩小闭塞,尿蛋白达到高峰,但21 d尿蛋白开始下降,这可能与小鼠模型的微血栓较多、肾小囊囊腔缩小闭塞有关。小鼠模型与人类新月体肾炎的病情发展、病理变化不太相符,这可能是目前使用大鼠者居多的原因之一。
除了鼠系外,兔子、羊[28]也可以用来造模,但是耗材相对较贵,较少使用。因此在NTSN模型建立过程中,WKY大鼠可能更适于NTSN模型的建立,SD大鼠次之。不同种属、不同性别的动物所产生的病变是否存在差异呢?Ougaard等[24]使用CD1和C57BL/6小鼠建立NTSN模型,发现两种雌性小鼠模型疾病发展过程相似,且较雄性小鼠对肾毒血清更敏感。Kaneko等[29]发现不同年龄的C57BL/6 J鼠之间存在差异,分别用12周龄和18月龄的C57BL/6 J鼠经羊血清预免疫后建立加速型NTSN模型,结果发现二者结合在GBM上的羊IgG、鼠抗羊IgG和血清中的鼠抗羊IgG滴度相似,但是18月龄的C57BL/6 J老年鼠肾损伤较轻,这可能与肾小球的单核巨噬细胞浸润减少,细胞表面的C-C趋化因子受体1、C-C趋化因子受体2、Fcγ受体的表达下调有关。
3.2 肾毒血清制备
除了选择合适的易感动物,肾毒血清的制备是建立该模型的另一个关键。经典的NTSN模型制备方法是将A种动物的GBM成分多次免疫B种动物,B种动物就会产生抗A种动物GBM的抗体,等达到一定滴度后留取血清(即肾毒血清),再一次性静脉注射给A种动物,建立NTSN模型。
制备肾毒血清的第一步是提取纯化的GBM成分,Lindeman[3]创建NTSN模型时直接用兔肾,成分复杂,特异性差;目前使用的主要有三种方法:①皮质匀浆:将肾皮质用组织匀浆机进行匀浆获得,该方法操作简便,但是皮质匀浆得到的GBM成分复杂,特异性较差;②相对纯化的GBM成分:将肾皮质研磨、过筛后得到肾小球,减少肾小管成分污染,纯度越高越好,一般需大于95%;离心、洗涤将肾小球破碎,得到相对纯化的GBM成分,目前多用此法;③单克隆抗体:GBM的主要成分为Ⅳ型胶原,因此也可以用抗α3(Ⅳ)NCl单克隆抗体或抗α3(Ⅳ)NCI肾毒血清来制备NTSN,但是单克隆抗体价格昂贵。因此,有人在第二种方法的前提下,加入胶原酶,提取相对较纯的可溶性的GBM成分。
将上述方法提取的GBM成分用生理盐水稀释后与等量弗氏佐剂乳化后皮下注射或腹腔注射免疫B种动物,用间接免疫荧光、琼脂双向扩散法检测抗体的效价,抗体的滴度直接决定血清的使用剂量及造模成功与否。免疫成功后留取血清,加热(56℃)灭活补体,与A动物红细胞混匀后吸附过夜,离心收集上清,-20℃保存备用。
3.3 造模
3.3.1 造模方法
得到一定滴度的抗体血清后,经一次性静脉注射给A种动物开始造模。目前造模的方法主要有两种:①非加速型:直接将肾毒血清经静脉注射给A种动物;②加速型:在注射肾毒血清前的5~7 d,使用LPS或B种动物的IgG进行预免疫。
除WKY大鼠外,由于非加速型模型造模所需时间较长,因此目前多使用加速型模型。加速的方法是用IgG或LPS进行预免疫,那么两种加速型的方法有什么区别呢?李向阳等[30]使用兔IgG和LPS对两组昆明小鼠进行预免疫,在注射肾毒血清后的第7天,两组尿蛋白、血肌酐和血尿素氮含量均明显升高,高于正常对照组,且兔IgG预免疫组升高更明显;兔IgG预免疫组在第14天可见新月体开始形成,21 d有大量新月体形成,而LPS预免疫组在第21天才有少量新月体形成。由此可见,IgG预免疫加速型模型反应更为剧烈,形成新月体较早,而LPS容易诱发小鼠产生Shwartzman-Sanarelli现象,造成组织损伤坏死,因此目前较少使用。IgG预免疫可以加速造模的时间,但是改变了体液免疫时相,缩短了异体反应时相,不利于免疫机制的精细研究。因此,临床上应根据实验目的选择合适的造模方法。
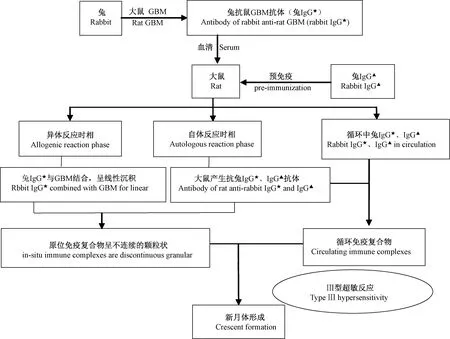
图1 NTSN模型的体液免疫机制Figure 1 The humoral immune mechanisms of NTSN model
3.3.2 最佳血清剂量
不同种属的实验动物,对肾毒血清的敏感性不同,因此最佳血清剂量也不尽相同。早在1965年,Unanue等[4]就提出该模型的建立,取决于两个因素:(1)结合到受体肾小球中异源性抗GBM的抗体量;(2)受体对异源性IgG的免疫反应。经预免疫的动物,亚致肾炎剂量(若无预免疫,不产生蛋白尿)的血清即可诱发典型的新月体形成[5,20],预免疫除了可以加速造模的时间,还可以减少肾毒血清的用量,且不同窝别、年龄、性别的动物对肾毒血清的敏感性可能也存在差异,因此实验中最佳血清剂量须经预实验确定。
4 NTSN造模过程的免疫机制
NTSN的造模过程繁琐,免疫机制相对复杂。该模型的病理改变主要是体液免疫、细胞免疫、多种细胞因子共同作用的结果。
4.1 体液免疫
B种动物的肾毒血清经静脉注射给A种动物后,会经历两个体液免疫时相,即早期的异体反应时相和晚期的自体反应时相[1]。下面以兔代替B种动物,大鼠代表A种动物为例,阐述如下(见图1)。
外源性的抗GBM抗体(兔抗鼠GBM抗体,兔IgG★)与大鼠的GBM存在相同的抗原决定簇,因此流经肾时可以迅速结合到GBM处,免疫荧光可见IgG呈线性沉积,这就是早期的异体反应时相,该时期出现内皮细胞与GBM部分分离、足突融合等轻微的病理变化[6]。
外源性的抗GBM抗体(兔IgG★)对于大鼠来说是一种抗原,约7~10 d后,进入自体反应时相,大鼠会产生相应的抗体(鼠抗兔IgG★抗体),这一抗体与GBM上和循环中的抗原(兔IgG★)结合,导致原位和循环免疫复合物形成,GBM的免疫荧光呈不连续的颗粒状,原位和循环免疫复合物介导Ⅲ型超敏反应的发生,激活补体系统、激肽系统和炎症细胞等,GBM明显增厚、皱缩,部分断裂,球囊黏连,最终导致新月体形成[6, 31]。
而加速型NTSN实际上是缩短了异体反应时相,提前使大鼠产生抗兔IgG的抗体(鼠抗兔IgG▲抗体),当肾毒血清(兔IgG★)注射给大鼠时,大鼠早已产生的抗兔IgG的抗体立即与其结合,产生强烈的免疫反应。
由于形成的原位免疫复合物颗粒较大,加之又有循环免疫复合物及补体的沉积,原位和循环免疫复合物不能及时被清除,则诱发细胞Ⅳ型超敏反应,在一系列酶和细胞因子的作用下,基底膜受损,肾小球壁层上皮细胞增生,最终导致新月体形成,见图1。
4.2 细胞免疫
免疫细胞介导的肾损伤是新月体肾炎的发病基础[32-33],其中T淋巴细胞产生多种炎症因子,在新月体肾炎的发生发展过程中起着重要作用。T淋巴细胞包括多种细胞亚群,如Th1细胞、Th2细胞、Th17细胞、调节性T细胞、γδT细胞和NKT细胞等。Summers等[34-35]建立NTSN模型,发现模型组Th1细胞、Th17细胞中的转录因子T盒(T-box expressed in T cell,T-bet)、维甲酸相关孤核受体γt表达升高,提示Th1细胞、Th17细胞参与新月体肾炎肾小球损伤的病理过程。Guo等[36]也发现IL-17参与肾损伤。Paust等[37]发现Th17细胞、Th1细胞分别作用于新月体肾炎的不同时期,Th17细胞在新月体肾炎早期(第5~10天)发挥主要作用,而Th1细胞则在新月体肾炎后期(第20天后)作用逐渐增强。但是Sally等[38]发现肾肥大细胞产生的IL-17具有保护作用。
Th1细胞介导的免疫应答促进新月体的形成,而调节性T细胞(Regulatory T cells,Treg)具有免疫抑制作用,通过分泌IL-10等方式抑制其他T细胞的功能和B细胞的抗体合成,发挥负向调节作用,在新月体肾炎形成过程中具有重要的意义。Diefenhardt等[39]通过敲除IL-10受体的小鼠建立NTSN模型,发现与正常对照组相比,模型组Th17介导的免疫应答增强,肾损伤加重。Takabatake等[9]运用NTSN模型发现CD28的单克隆抗体JJ316减少了模型组大鼠的蛋白尿、新月体的形成、巨噬细胞和CD8+细胞聚集,同时伴随Treg增多,且在发病第3天单次注射JJ316可以阻止WKY大鼠在2月内死亡,因此,JJ316可能通过扩增和激活Treg细胞对新月体肾炎起显著的治疗作用。NKT细胞也对新月体的发展起抑制作用[40]。细胞免疫是新月体形成的关键,吲哚胺2,3-双加氧酶(indoleamine2,3-dioxygenase, IDO)是催化色氨酸代谢通路中的裂解吡咯环关键步骤的限速酶,可明显抑制T细胞介导的细胞免疫。Hou等[12]建立加速型NTSN模型,发现IDO活性在NTSN小鼠血清和肾组织中明显升高,免疫组化显示IDO在小球和肾小管上皮细胞表达明显上调;用1-甲基色氨酸(1-methyl-tryptophan, 1-MT)抑制IDO活性,肾病变恶化,新月体形成增加,CD4+T细胞和巨噬细胞在肾组织聚集,肾损伤加剧,这些研究结果表明新月体肾炎的发生发展受IDO活性的负向调节。
5 结语
综上所述,NTSN造模方法虽繁琐,但易于掌握、制作容易、造模成功率高、病变典型、重复性好、免疫机制复杂,临床广泛应用于研究原发或继发的免疫复合物介导的新月体肾炎。
