过表达JAZF1对甲状腺乳头状癌BCPAP细胞增殖、凋亡的影响及其机制
2019-09-27熊代刚侯泽宇蔡玉怀黄亮亮程晓明
熊代刚,侯泽宇,蔡玉怀,黄亮亮,杨 艳,曾 峰,程晓明*
(1.遵义医学院附属医院乳腺甲状腺疾病诊疗中心,贵州 遵义 563000; 2.遵义医学院附属医院医学检验科,贵州 遵义 563000)
甲状腺癌(thyroid carcinoma, TC)是目前最常见的内分泌系统肿瘤,近年来其在全球的发病率持续上升,TC病理分型主要包括分化型甲状腺癌(differentiated thyroid carcinoma, DTC)、未分化型甲状腺癌(anaplastic thyroid cancer, ATC)、髓样癌(medullary thyroid carcinoma,MTC),其中乳头状癌(papillary thyroid carcinoma, PTC)属于分化型甲状腺癌,是目前临床上最常见的类型,多数预后较好,但仍有部分患者复发率高、预后差。随着对甲状腺癌分子发病机制的深入研究,癌基因扩增或抑癌基因表达或功能障碍在TC发病中的不断认识,更多关于TC分子诊断、靶向治疗的分子研究被关注。JAZF1(juxtaposed with another zinc finger protein 1)又名孤儿核受体TAK1相互作用蛋白27(TAK1-interacting protein 27,Tip27),研究报道JAZF1参与子宫内膜间质肉瘤[1, 2]、前列腺癌[3]、非HBV及非HCV相关肝细胞癌[4]的进展,可能是抑癌基因。本课题组前期研究[5]发现JAZF1在甲状腺癌组织中表达相对良性甲状腺结节、癌旁组织明显下调,提示JAZF1可能参与了TC的发展,但具体机制不清楚。本研究将在甲状腺乳头状癌细胞BCPAP中过表达JAZF1,探讨JAZF1对BCPAP细胞增殖、凋亡的生物学作用及可能机制,从而为PTC的分子靶向治疗提供新思路。
1 材料和方法
1.1 实验材料
人甲状腺乳头状癌BCPAP细胞购自中科院上海干细胞库。
1.2 主要试剂与仪器
胎牛血清(FBS)、RPMI 1640、非必需氨基酸(NEAA)、丙酮酸钠、谷氨酰胺购至Gibco公司;RNA提取试剂盒、qRT-PCR试剂购自TaKaRa公司;GAPDH购自华安生物技术有限公司;PI3K、p-PI3K、Akt、p-Akt购自CST公司;全蛋白提取试剂盒、MTT试剂盒购自索莱宝科技有限公司;BCA蛋白定量试剂盒购自雅酶生物科技有限公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自凯基生物。FACSAria II流式细胞仪购自美国BD公司;ABI 7500实时荧光定量PCR仪购自美国ABI公司;Gel Doc XR+凝胶成像仪购自美国Bio-Rad公司。
1.3 实验方法
1.3.1 细胞培养与转染
BCPAP细胞采用含10% FBS、1% NEAA、1%丙酮酸钠、1%谷氨酰胺的RPMI 1640培养基、置于37℃、5% CO2孵箱中培养。细胞传至第6代且处于对数生长期,Adv-GFP、Adv-JAZF1-GFP分别感染BCPAP细胞,分为阴性对照组、空载组(Adv-GFP)、实验组(Adv-JAZF1-GFP),转染48 h后收集各组细胞,各实验重复3次。
1.3.2 MTT检测细胞增殖活性
收集对数生长期细胞制备细胞悬液并接种于96孔板,每孔细胞悬液103个/200 μL,37℃、5% CO2培养过夜,次日转染Adv-GFP/Adv-JAZF1-GFP,继续培养24 h、48 h、72 h,各时间点吸去上清,加入90 μL新鲜完全培养基,再加入10 μL MTT溶液,继续培养4 h,然后弃上清,各孔加入110 μL Formazan溶解液,置摇床上低速振荡10 min,使结晶物充分溶解,在酶联免疫检测仪490 nm处测量各孔吸光度值,同时设置调零孔、对照组,每组设定至少3个复孔。
1.3.3 平板克隆形成实验
将对数生长期细胞接种于6 cm培养皿,调整每皿细胞数为103个,每皿加入3 mL细胞完全培养基,混匀使细胞分布均匀静置于培养箱中培养,每2 d换一次液,14 d后出现肉眼可见的克隆,弃培养基后固定15 min,染色20 min,PBS漂洗3次,显微镜下计数细胞克隆数,并根据公式:克隆形成效率=克隆数量/接种细胞数量 × 100%,分别计算各组细胞克隆形成效率。
1.3.4 流式细胞术Annexin V-FITC/PI检测各组细胞凋亡
将细胞接种于6孔板,转染后48 h,用不含EDTA的胰酶消化并收集细胞,PBS洗涤细胞2次,加入500 μL的binding buffer重悬细胞,再加入5 μL的annexin V-FITC混匀后,加入5 μL的碘化丙啶(propidium iodide),混匀,室温避光反应15 min,流式细胞仪检测分析。
1.3.5 qRT-PCR检测
转染48 h后,分别提取各组细胞总RNA,逆转录合成cDNA,采用SYBR-Green I法、ABI 7500、qRT-PCR二步法检测JAZF1 mRNA的表达水平,以GAPDH作为内参,用2-△△CT值表示基因相对表达量。所用引物:GAPDH:上游5’-GGAGCGAGATC CCTCCAAAAT-3’,下游5’-GGCTGTTGTCATACTT CTCATGG-3’;JAZF1:上游5’-CACGCCACAGCAG TGGAAGC-3’,下游5’-AGCAGTGGAAGCCTTACT CC-3’。
1.3.6 Western blot法检测各组细胞蛋白的相对表达水平
转染48 h后,采用全蛋白提取试剂盒提取各组细胞总蛋白,BCA法定量各蛋白浓度,调整各蛋白浓度使电泳时上样量与体积一致,蛋白变性后,每个泳道上样量20 μg,10% SDS-PAGE电泳并4℃湿转过夜,封闭、洗膜、一抗(Bcl-2、Bax、PI3K、p-PI3K、Akt、p-Akt)4℃孵育过夜、洗膜、二抗室温孵育1 h,洗膜并显色成像,以GAPDH作为内参,采用Image J软件比较条带灰度值与灰度比即半定量各蛋白质含量。
1.4 统计学方法
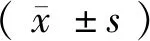
2 结果
2.1 JAZF1在BCPAP细胞中形成过表达
Adv-GFP、Adv-JAZF1-GFP转染BPCPA细胞48 h后,NC组与空载组比较无明显统计学差异,实验组JAZF1 mRNA、蛋白相对表达水平均较NC组、空载组明显上调(mRNA:P<0.001;蛋白:P<0.001),见图1。
2.2 过表达的JAZF1对BCPAP细胞增殖及集落形成能力的影响
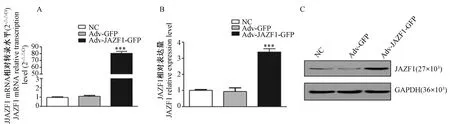
MTT结果提示过表达的JAZF1在24 h、48 h、72 h明显抑制BCPAP细胞增殖(均P<0.01);平板克隆形成实验表明实验组克隆形成效率较NC组、空载组明显降低(均P<0.001),见图2。
注:与NC组相比,***P<0.001。图1 qRT-PCR、Western blot检测各组BCPAP细胞JAZF1 mRNA、蛋白相对表达水平Note. Compared with the negative control group,***P<0.001.Figure 1 Relative expression levels of JAZF1 and JAZF1 mRNA in each group of BCPAP cells assessed by qRT-PCR and Western blot assay
2.3 上调JAZF1对BCPAP细胞凋亡的影响
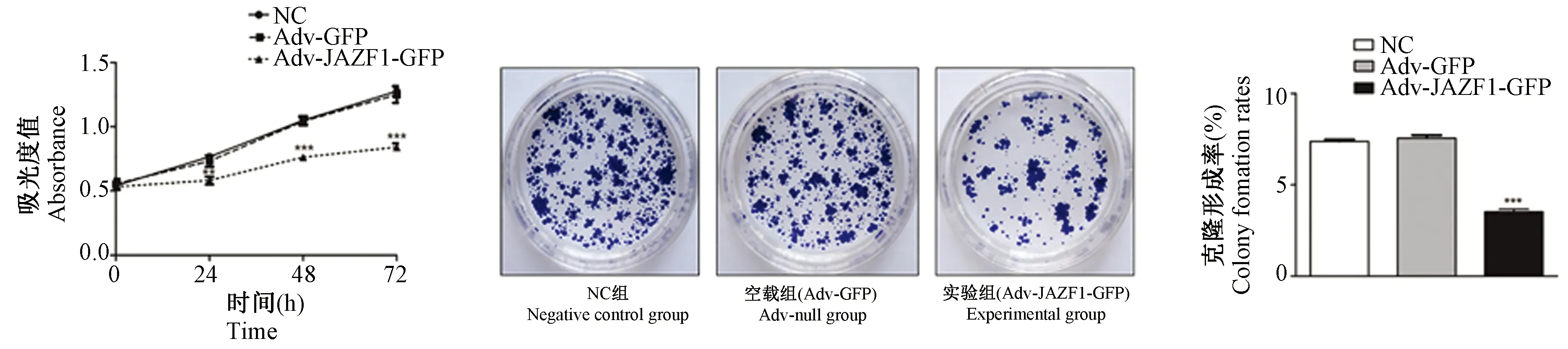
Annexin V-FITC/PI法流式细胞术检测结果显示:实验组细胞凋亡率较NC组、空载组明显增加(23.02±0.35%vs. 8.63±0.40%, 7.95±0.32%,均P<0.001),见图3。
2.4 过表达的JAZF1对Bcl-2/Bax信号通路的调控作用
Western blot实验结果表明:实验组Bcl-2蛋白相对表达水平明显下调,较NC组降低了66.0%(P<0.001),Bax相对蛋白表达水平明显上调,较NC组增加了64.8%(P<0.001),NC组与Adv-GFP组无统计学差异(均P>0.05)见图4。
2.5 过表达的JAZF1对PI3K/Akt信号通路的影响
Western blot实验结果发现过表达的JAZF1抑制BCPAP细胞p-PI3K、p-Akt蛋白相对表达水平(均P<0.001),能明显下调p-PI3K/t-PI3K、pAkt/t-Akt的比值(P<0.001),见图5。
注:与NC组相比,**P<0.01,***P<0.001。图2 JAZF1过表达对各组BCPAP细胞增殖、克隆形成能力的影响Note. Compared with the negative control group, **P<0.01, ***P<0.001.Figure 2 Effect of JAZF1 overexpression on the proliferation and clone formation of BCPAP cells in each group
图3 JAZF1过表达对各组BCPAP细胞凋亡的影响Figure 3 Effect of JAZF1 overexpression on apoptosis in the BCPAP cells in each group
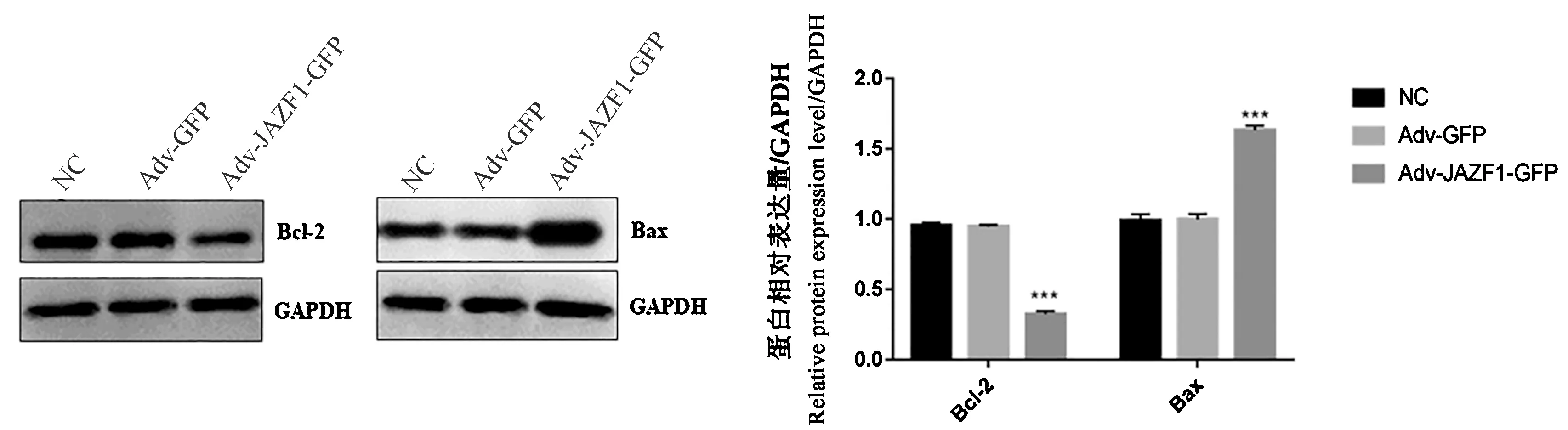
注:与NC组相比,***P<0.001。图4 过表达的JAZF1对Bcl-2/Bax信号通路的影响Note. Compared with the negative control group,***P<0.001.Figure 4 Effect of JAZF1 overexpression on the Bcl-2/Bax signaling pathway

注:与NC组相比,***P<0.001。图5 过表达的JAZF1对PI3K/Akt信号通路的影响Note. Compared with the negative control group,***P<0.001.Figure 5 Effect of JAZF1 overexpression on the PI3K/Akt signaling pathway
3 讨论
JAZF1是核孤儿受体TAK1的竞争抑制因子,包含三个假定的锌指基序和一个富含谷氨酸/天冬氨酸的区域,研究推测JAZF1中锌指结构域和富含谷氨酸/天冬氨酸的区域可能在TAK1-JAZF1复合物募集其他核蛋白中起作用[6]。既往研究表明JAZF1调控糖、脂代谢[7]、胰岛素抵抗[8],其变异体参与前列腺癌、子宫内膜间质肉瘤的发生与发展。由于TAK1的转录活性依赖于细胞类型,可能存在正调控或负调控转录作用,因此,作为TAK1竞争抑制因子的JAZF1可能在不同的细胞中表现不同的生物学效应。Bae等[9]研究表明过表达的JAZF1可以通过上调促凋亡基因诱导心肌细胞心力衰竭症状。Yuasa等[10]研究认为过表达JAZF1能促进C2C12细胞周期进展和细胞增殖。
基于本课题的前期研究提示:JAZF1可能在甲状腺癌的进程中可能发挥抑制作用,为进一步明确其生物学功能,本研究通过MTT实验观察过表达的JAZF1对乳头状甲状腺癌细胞BCPAP的增殖活性的影响,结果表明:过表达的JAZF1随时间明显抑制了BCPAP细胞的增殖(均P<0.01);同时,平板克隆形成实验结果显示上调的JAZF1明显抑制BCPAP细胞的克隆形成(均P<0.001),即JAZF1抑制了BCPAP细胞群体依赖性及细胞增殖能力。
细胞凋亡是细胞重要的生物学现象,且是多基因严格控制的过程。Bcl-2蛋白家族是通过控制线粒体通透性调节细胞凋亡,因其Bcl-2同源结构域分为三个亚家族:抗凋亡蛋白如Bcl-2、仅含BH3的促凋亡蛋白如BAD、孔隙形成促凋亡蛋白如Bax[11]。本研究通过流式细胞术检测分析细胞凋亡率,结果表明过表达的JAZF1促进了BCPAP细胞凋亡,进一步探讨JAZF1对BCPAP促凋亡的相关机制,Western blot结果证实了上调的JAZF1抑制了Bcl-2、增强了Bax蛋白相对表达水平。
磷脂酰肌醇3激酶-蛋白激酶B(PI3K /AKT)信号通路是细胞生长、增殖、蛋白质合成、凋亡和代谢过程中最关键的分子信号通路之一[12],全基因组测序研究也表明PI3K信号通路是甲状腺肿瘤发生的主要激活途径之一[12]。研究发现TC中PI3K、Akt发生遗传学改变,导致其表达量异常增加且信号通路呈过度激活状态[13-15]。在本研究中,上调的JAZF1能抑制p-PI3K和p-Akt表达,显著降低p-PI3K/PI3K、p-Akt/Akt的比值,表明过表达的JAZF1能抑制PI3K/Akt信号通路的激活,这也可能是抑制BCPAP细胞增殖和凋亡的可能机制。
综上所述,过表达的JAZF1能有效抑制BCPAP细胞增殖及克隆形成,且促进细胞凋亡,作用机制可能与Bcl-2/Bax、PI3K/Akt信号通路活性改变有关,这将可能为抑制PTC的治疗提供潜在的治疗靶点。
