拉莫三嗪对慢性癫痫大鼠海马PGP、MVP表达及氨基酸含量的影响
2019-09-27尹明姬池永学李今子
尹明姬,池永学,李今子
(延边大学附属医院 吉林 延吉 133002)
癫痫(epilepsy)是一种反复出现癫痫发作的慢性疾病。临床超过30%的患者存在不同程度地耐药,是慢性癫痫治疗的难点,甚至治疗失败[1-3]。越来越多的多药耐药基因在慢性癫痫的研究受到关注,P糖蛋白(P-glycoprotein protein,PGP)和主要穹窿蛋白(major vault protein,MVP)是耐药基因相关蛋白,尸检报告显示,存在耐药的慢性癫痫患者脑内海马区PGP和MVP表达的阳性细胞比邻近的正常脑组织及正常尸检标本表达均高,提示PGP和MVP在慢性癫痫耐药中发挥重要作用[4-5],另外氨基酸在慢性癫痫病变中也扮演重要角色。拉莫三嗪(lamotrigine,LTG)广泛用于耐药慢性癫痫的治疗[6],但拉莫三嗪对慢性癫痫脑内的PGP和MVP及氨基酸表达的影响鲜有报道,因此本课题拟采用戊四氮制备与人慢性癫痫病变高度相似的慢性癫痫大鼠模型,同时分析拉莫三嗪对慢性癫痫治疗的可能机制。
1 材料和方法
1.1 实验动物
SPF级雄性SD大鼠50只,4~5周龄,体质量250~300 g,购自延边大学[SCXK (吉) 2017-0003],在延边大学动物饲养中心[SYXK (吉) 2015-0007]饲养大鼠,并在该中心进行实验研究,饲养室温度为20℃ ~ 25℃,相对湿度50% ~ 65%,所有大鼠适应性饲养7 d后再行实验。动物使用伦理审批号:IACUC20170001,本研究符合动物实验的3R原则。
1.2 主要试剂与仪器
拉莫三嗪片(Glaxo Smith Kline Pharmaceuticals S.A,规格:50 mg/片,国药准字:H20110023,批号:20170109);戊四氮(美国Sigma公司,批号:SOL4242);TRIzol(美国Invitrogen公司,批号:15596026);RT-PCR试剂盒(美国TaKaRa公司,批号:201702);DBA(美国Bioword公司,批号:L201743);辣根过氧化物酶标记山羊抗兔Ig(武汉博士德生物技术有限公司,批号:SP1722)。51600型立体定向仪(美国Stoelting公司);D70-CCTPD70-PCTPC70-EEE型清醒动物生理信号采集系统(美国DSI公司);UV1700型紫外分光光度计(上海美谱达仪器有限公司);ZF-288型凝胶显像仪(上海嘉鹏科技有限公司);E2695型高效液相色谱仪(美国Waters公司)。
1.3 实验方法
1.3.1 慢性癫痫模型制备
大鼠腹腔注射戊四氮35 mg/(kg·d),连续注射28 d,每次注射后1 h采用红外摄像头观察并记录痫性发作的潜伏期与发作强度。按Racine癫痫发作分级标准评价,连续5 d出现≥ II级的发作即认为慢性癫痫大鼠模型制备成功,并纳入研究。
1.3.2 分组及给药
将慢性癫痫大鼠分为3组,模型组、拉莫三嗪低剂量(5 mg/kg)组和拉莫三嗪高剂量(10 mg/kg)组,每组大鼠15只,健康大鼠作为对照组,所有组别灌胃给药,模型组和对照组灌胃给予生理盐水,所有组别连续灌胃给药25 d。
1.3.3 指标检测
(1)大鼠行为学及体质量观察:记录所有大鼠治疗前及治疗后的行为学特征及体质量。
(2)癫痫发作时间和脑电波:末次给药1 d后,检测脑电波。将各组动物全麻并俯卧位固定在立体定向仪,定位海马,在海马深部前囟后约3.0 mm及旁2.5 mm处钻开颅骨,用脑立体定位仪将脑电图记录电极送入硬膜下约3.0 mm。将引导电极信号输入生理信号采集系统记录大鼠癫痫发作频率,记录1 h内所有组别大鼠癫痫的放电频率,出现尖波及棘波判定为癫痫发作,并记录每次癫痫发作的时间,计算均值。
(3)海马样本中的3种氨基酸含量的测定:取大鼠海马组织约50 mg,匀浆,分别采用高效液相色谱仪分析海马组织的天冬氨酸(aspartate,Asp)、谷氨酸(glutamate,Glu)和甘氨酸(glycine,Gly)含量。
(4)免疫组化检测脑组织中的PGP和MVP表达:末次给药1 d后,检测完脑电波后,取脑的海马组织,部分置于多聚甲醛固定48 h,石蜡包埋,切片,二甲苯脱蜡,梯度乙醇水化,过氧化氢室温放置15 min,PBS清洗,高压修复抗原,放置至室温,PBS清洗,山羊血清,室温封闭放置20 min,滴加一抗PGP和MVP(1∶100),4℃孵育过夜,室温放置30 min,PBS清洗,滴加二抗,37℃放置10 min,PBS清洗,加链霉菌抗生物素蛋白-过氧化物酶,37℃放置10 min,DAB显色,镜下观察。
(5)Western blot检测海马中PGP和MVP水平:取大鼠海马组织约50 mg,加入裂解液和蛋白酶抑制剂,冰上超声裂解5 s,重复4次,低温离心,收集上清,以紫外分光光度计法定量总蛋白,蛋白定量5 g/L,每个电泳道上样50 μg,采用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳,采用蛋白质电泳转移仪将产物转移到PVDF膜,脱脂奶粉封闭放置2 h,加入一抗PGP和MVP(工作浓度均为1∶100)+ GAPDH(1∶1000),4℃孵育过夜,TBST洗膜,羊抗鼠二抗(1∶5000)室温孵育1.5 h,清洗,以凝胶显像仪和定量软件,以GAPDH条带与电泳条带的灰度面积比值表示GST-π蛋白质的含量。
1.4 统计学方法
2 结果
2.1 各组大鼠行为学比较
对照组大鼠活动正常。慢性癫痫模型组大鼠表现为活动减少、咀嚼、节律性点头,头颈上仰、前肢阵挛发作,少数大鼠竖尾或尾拍地面。拉莫三嗪组大鼠由早期的头颈上仰、前肢阵挛发作逐渐过渡到竖毛及嘴和面部肌肉抽搐,少见竖尾或尾拍地的情况。治疗前,与对照组比,模型组及拉莫三嗪组的体质量均明显降低(P<0.05)。治疗后,与对照组比,模型组体质量明显降低(P<0.05),与模型组比,拉莫三嗪组的体质量明显增高(P<0.05),且呈拉莫三嗪剂量依赖性趋势,见表1。

Table1Comparison of body mass of rats in the four experimental groups
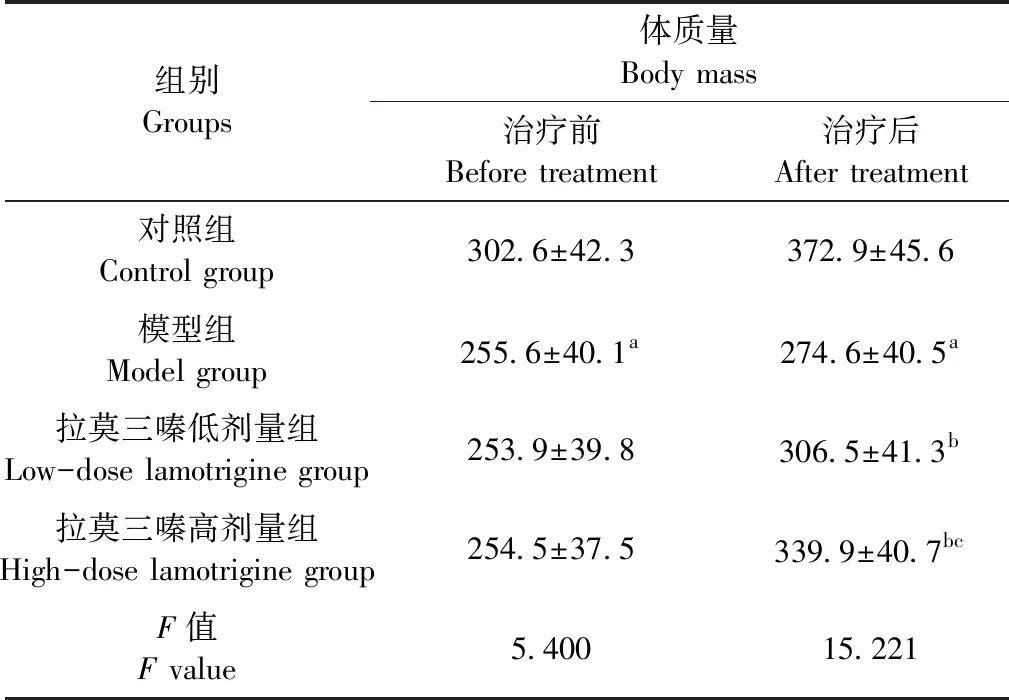
组别Groups体质量Body mass治疗前Before treatment治疗后After treatment对照组Control group302.6±42.3372.9±45.6模型组Model group255.6±40.1a274.6±40.5a拉莫三嗪低剂量组Low-dose lamotrigine group253.9±39.8306.5±41.3b拉莫三嗪高剂量组High-dose lamotrigine group254.5±37.5339.9±40.7bcF值F value5.40015.221
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05;与拉莫三嗪低剂量组组比,cP<0.05。
Note. Compared with the control group,aP<0.05. Compared with the model group,bP<0.05. Compared with the low-dose lamotrigine group,cP<0.05.
2.2 各组大鼠癫痫发作时间和脑电图比较
与对照组比,模型组癫痫发作时间增高(P<0.05),脑电图频率降低(P<0.05),波幅增高(P<0.05);与模型组比,拉莫三嗪组的癫痫发作时间降低(P<0.05),脑电图频率增高(P<0.05),波幅降低(P<0.05),且呈拉莫三嗪剂量依赖性趋势,见表2。

表2 各组大鼠癫痫发作时间和脑电图比较
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05;与拉莫三嗪低剂量组相比,cP<0.05。
Note. Compared with the control group,aP<0.05. Compared with the model group,bP<0.05. Compared with the low-dose lamotrigine group,cP<0.05.

表3 各组大鼠海马的氨基酸含量比较
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05;与拉莫三嗪低剂量组相比,cP<0.05。
Note. Compared with the control group,aP<0.05. Compared with the model group,bP<0.05. Compared with the low-dose lamotrigine group,cP<0.05.
2.3 各组大鼠海马的氨基酸含量比较
与对照组比,模型组海马的Asp和Glu均明显增高(P<0.05),Gly明显降低(P<0.05);与模型组比,拉莫三嗪组海马的Asp和Glu均明显降低(P<0.05),Gly明显增高(P<0.05),且呈拉莫三嗪剂量依赖性趋势,见表3。
2.4 免疫组化法检测各组大鼠海马PGP和MVP表达
PGP和MVP阳性表达均在细胞膜与细胞核。与对照组比,模型组海马PGP和MVP阳性表达增高(P<0.05);与模型组比,拉莫三嗪组海马PGP和MVP阳性表达降低(P<0.05),且呈拉莫三嗪剂量依赖性趋势,见图1。
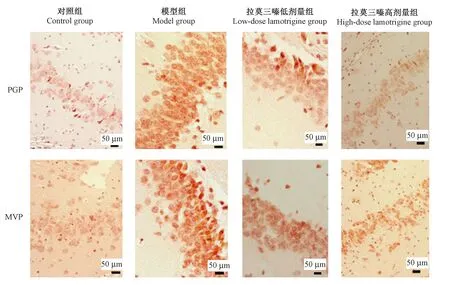
图1 免疫组化法检测各组大鼠海马PGP和MVP表达(× 200)Figure 1 Expression of PGP and MVP in the hoppicampal tissues detected by immunohistochemical staining
2.5 Western blot法检测各组大鼠海马PGP和MVP表达
与对照组比,模型组海马PGP和MVP阳性表达增高(P<0.05);与模型组比,拉莫三嗪组海马PGP和MVP阳性表达降低(P<0.05),且呈拉莫三嗪剂量依赖性趋势,见图2。
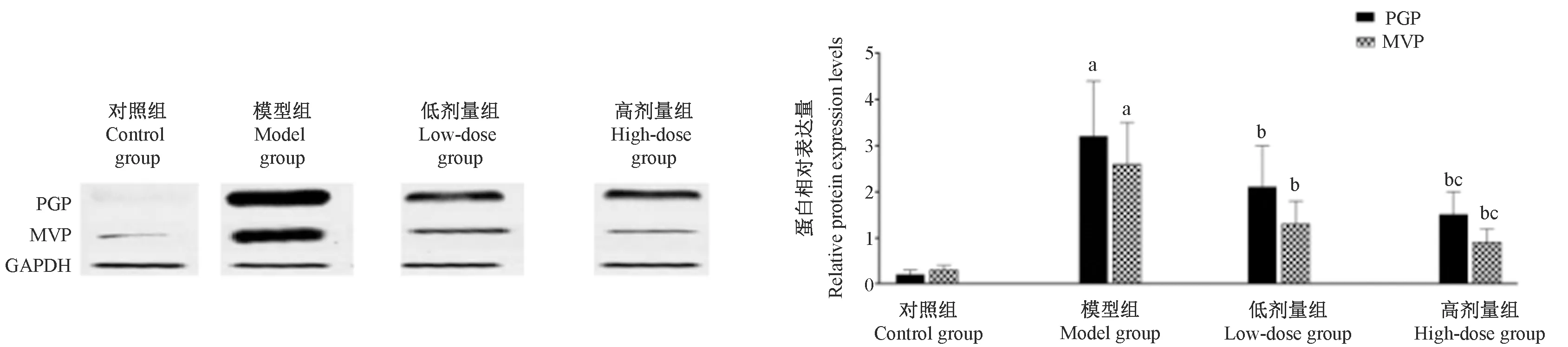
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05;与拉莫三嗪低剂量组相比,cP<0.05。图2 Western blot检测各组大鼠海马PGP和MVP表达Note. Compared with the control group, aP<0.05. Compared with the model group, bP<0.05. Compared with the low-dose lamotrigine group, cP<0.05.Figure 2 Expression of PGP and MVP in the hoppicampal tissues detected by Western blotting
3 讨论
Asp和Glu为脑内兴奋性氨基酸,两者的兴奋性神经毒性作用可导致神经细胞变性和死亡,Gly为脑内抑制性氨基酸,在脑内含量异常可诱导癫痫发作,当脑内兴奋性与抑制性氨基酸的平衡被破坏,尤其是Asp和Glu增高,Gly降低,诱导癫痫发作[7-9]。本课题结果所示,与对照组比,慢性癫痫大鼠海马区的Asp和Glu明显增高,Gly显著降低,同时慢性癫痫的癫痫发作次数较多,脑电图显示异常,且均存在统计学差异,由此可见脑内兴奋性和抑制性的氨基酸动态平衡被打破,表达异常则引导癫痫发作。给予拉莫三嗪治疗后,慢性癫痫大鼠海马区的氨基酸趋向平衡,即Asp和Glu明显降低,Gly明显增高,可见拉莫三嗪治疗慢性癫痫与稳定或改善癫痫海马区的氨基酸水平,降低癫痫发作次数,且呈现剂量依赖性趋势,与文献报道拉莫三嗪通过改善氨基酸的递质活性,降低脑内异常放电而达到治疗慢性癫痫的结果一致[10-11]。
与肿瘤耐药相似,慢性癫痫也存在耐药现象,且与耐药蛋白表达增高相关,其中被研究较为成熟的是PGP和MVP。PGP作为跨膜药物转运蛋白,属于ABC转运蛋白超家族,通过排出细胞内药物或通过细胞内囊泡分泌等途径降低药物聚集在细胞间隙,细胞质及细胞器,达到耐药的效果[12-14]。MVP是细胞器穹隆蛋白的主要成分,穹隆蛋白在阻止药物靠近细胞核,降低病灶的药物浓度并避免药物与靶点结合中起到关键作用[15-16]。本课题结果显示,与对照组比,慢性癫痫大鼠海马中的PGP和MVP蛋白均明显上调,且差异存在统计学意义,可见存在明显的耐药基础。给予拉莫三嗪治疗后,慢性癫痫大鼠海马中的PGP和MVP蛋白均明显下调,且剂量越高,下调越显著,提示拉莫三嗪治疗慢性癫痫可能与降低海马中的PGP和MVP蛋白表达紧密相关。对于拉莫三嗪治疗慢性癫痫可能与降低海马中的PGP和MVP蛋白表达机理尚无明确报道,如王海燕等[17]认为拉莫三嗪降低PGP和MVP蛋白表达的机理是间接而非直接,又如Liu等[18]采用药剂手段,以mPEG-PLA/TPGS混合胶束装载拉莫三嗪,通过人为手段提高癫痫病灶的拉莫三嗪浓度,PGP表达明显降低,提示拉莫三嗪可直接降低PGP表达。本文也存在以下缺陷,临床收治的存在耐药的慢性癫痫患者与长期服用抗癫痫药有关,但本文制备的慢性癫痫大鼠与临床患者的病情存在病理性的不同,再加上给与慢性癫痫大鼠的时间相对较短,对临床治疗的推荐价值有限,因此进一步的研究有必要进行长期给药,考察长期给药对慢性癫痫动物模型的干预效果。
综上所述,拉莫三嗪治疗慢性癫痫与降低海马PGP、MVP蛋白及改善海马氨基酸相关,但拉莫三嗪治在降低海马PGP、MVP蛋白的机制仍需进一步考察。
