动脉粥样硬化(气滞血瘀证)病证结合大鼠模型的研究
2019-09-27郭文鹤黄娜娜张晓亮李晓宇张家祥齐晓甜
郭文鹤,黄娜娜,张晓亮,李晓宇,4,张家祥,齐晓甜,孙 蓉,*
(1.山东大学第二医院,济南 250033; 2.哈尔滨商业大学生命科学与环境科学研究中心,哈尔滨 150076;3.山东中医药大学,济南 250355; 4.山东省中医药研究院,济南 250014; 5.山东大学 高等医学研究院,济南 250012)
动脉粥样硬化(atherosclerosis,AS)是引发心脑血管疾病的重要因素,其发病机制主要涉及脂质沉积、内皮损伤、血小板功能亢进、Ca2+超负荷等[1]方面,其中,内皮损伤和脂质沉积是公认的动脉粥样硬化发病的始动因素[2]。祖国医学将其归为“脉痹”、“中风”、“胸痹”等范畴。动脉粥样硬化的临床分型主要包括气滞血瘀型、气虚血瘀型、痰瘀互结型、气阴两虚型[3]。近年来,随着人们生活水平的提高和生活方式的转变,动脉粥样硬化的发病率呈逐年升高的趋势。相比于西药不良反应频发,新药研制迟缓的现状,中药着眼整体,标本兼治,在防治动脉粥样硬化方面别具一格,前景广阔。工欲善其事,必先利其器,伴随中药抗动脉粥样硬化药效研究的不断深入,相应的药效评价模型显得捉襟见肘。目前,动脉粥样硬化病证结合模型的研究有限,主要包括秽浊痰阻型、痰瘀阻络型、气阴两虚型[4-5]。气滞血瘀型作为动脉粥样硬化临床常见分型,尚无相应动物模型的报道。本研究基于动脉粥样硬化发病机制的现代研究以及动脉粥样硬化中医病因病机的演变规律,选择内皮细胞损伤、脂质沉积和“寒凝气滞”为切入点,拟用尾静脉注射牛血清蛋白、灌胃脂肪乳和冰水浴三种方法复合作用构建动脉粥样硬化(气滞血瘀)大鼠模型,以期为动脉粥样硬化(气滞血瘀证)相关药物的药效学和作用机制研究提供载体。
1 材料和方法
1.1 实验动物
SPF级雄性Wistar大鼠150只,6~8周龄,体重为180 ~ 220 g,购于山东大学实验动物中心[SCXK (鲁) 2013-0009]。大鼠饲养于山东大学实验动物中心动物房屏障环境[SYXK (鲁) 2013-0001],饲养室室温20℃ ~ 25℃,相对湿度(45 ± 10)%,通风良好,使用鼠饲料[SCXK (鲁) 2017-0014]饲喂大鼠。实验动物福利伦理批准号[KYLL-2018(KJ)A-0089],实验期间按实验动物使用的3R原则给予人道主义关怀。
1.2 主要试剂与仪器
通脉颗粒(吉林华康药业股份有限公司,批号170903051);辛伐他汀(世贸天阶制药有限责任公司,批号20170824);牛血清白蛋白(上海伯奥生物科技有限公司批号020701);胆固醇(国药集团化学试剂有限公司,批号20170607);脱氧胆酸钠(国药集团化学试剂有限公司,批号20160329);6-正丙基-2-硫代尿嘧啶(上海麦克林生化科技有限公司,批号C10024745);吐温80(国药集团化学试剂有限公司,批号20170606);1,2-丙二醇(国药集团化学试剂有限公司,批号20170209);猪油为市售;总胆固醇、甘油三酯、高密度脂蛋白胆固醇测定试剂盒、低密度脂蛋白胆固醇测定试剂盒均购于南京建成生物工程研究所,批号分别为20180126、20180126、20180125、20180124。TDZ5-WS型台式低速离心机,湘仪(湖南)离心机仪器有限公司;Multiskan Go-1510全波长酶标仪,赛默飞世尔科技(中国)有限公司;可调式移液器,上海赛默飞世尔仪器有限公司;木质旷场实验箱由山东大学实验动物中心提供。
1.3 实验方法
1.3.1 动脉粥样硬化(气滞血瘀证)动物模型诊疗评价指标抽提
参照《动脉粥样硬化中西医结合诊疗专家共识》[3],动脉粥样硬化(气滞血瘀证)的主要证候为走窜疼痛、拒按、局部青紫肿胀。或心烦易怒,情志不遂。舌质紫暗、瘀斑。脉沉、脉涩。临床检测指标主要包括血脂异常,升主动脉见片状或钙质沉着阴影[3]。依据血瘀证中西医结合诊断标准及实用血瘀证学内容,气滞血瘀证主证为舌质紫暗或有瘀斑,齿龈、趾端青紫,间歇性跛行。次证为肢体麻木或偏瘫,疼痛,精神狂躁,血液流变学、凝血功能异常。诊断标准规定,具备上述两项及以上者,即可确诊[6-7]。动脉粥样硬化中医证候积分量化表参照《中药新药临床研究指导原则》[8],见表1,根据中医证候改善率评价中医主要临床的症状和体征改善状况,应用尼莫地平法计算中医证候改善率,证候积分为各证候项下所得积分相加,依据证候改善率分为痊愈(≥95%)、显效(≥70%且<95%)、有效(≥30%且<70%)、无效(<70%)四等级。动脉粥样硬化中医诊疗方案中未明确病变程度的积分评价范围。中医证候改善率计算公式如下:
中医证候改善率=(治疗前积分 - 治疗后积分)/治疗前积分 × 100%。
基于上述诊疗标准和量化分析结果,选取①大鼠表征指标和行为学变化。②理化检测指标:血脂水平,凝血四项异常。血瘀证临床指征因辩证分型不同,其诊疗指标的贡献度所占权重各异,寒凝所致的气滞血瘀证凝血四项指标检测贡献度所占权重高于血液流变学[9-10]。③病理指标:升主动脉和肝组织病理检测。④以方测证作为动脉粥样硬化(气滞血瘀证)诊疗评价指标。

表1 动脉粥样硬化(气滞血瘀证)证候积分评价量化表[8]
注:无(0),轻度(2),中度(4),重度(6)。
Note. None (zero); mild (two); moderate (four); severe (six).
1.3.2 造模方法的筛选
据报道,每日冰水浴20 min,连续造模2 ~ 3周即可引起气滞血瘀证[11]。采用脂肪乳连续灌胃两周后可引起大鼠脂质代谢紊乱,连续灌胃40 d后可构建高脂血症大鼠模型[12]。一次性大剂量免疫损伤对动脉粥样硬化的发病具有促进作用[13]。祖国医学认为,过食肥甘会导致脾胃健运失常,体内膏脂过剩沉积,致使血脉瘀滞,浊邪内生,血脉不利。血遇寒凝,寒气生浊,可致气滞血瘀,浊邪随气血输布,沉积于脉道,进一步损伤脉道。本研究结合以往文献报道,主要考察免疫应激时间和连续冰水浴时间两因素,每个因素设定三个水平,具体为免疫应激时间分别为第1、2、3周,连续冰水浴时间依次为2、4、6周,以血脂水平的变化、升主动脉的病理变化为考察指标,对造模方法进行优化筛选。
1.3.3 动物分组与造模方法
将雄性Wistar大鼠按体重随机分为四组,正常组、模型组(见优化结果)、辛伐他汀组、通脉颗粒组,每组30只。反证药物按体表面积比值2倍量折算成大鼠给药剂量,辛伐他汀组0.9 mg/kg,通脉颗粒组2700 mg/kg。
正常组使用基础饲料喂养,模型组和药物反证组均以10 mL/kg脂肪乳(25%猪油、10%胆固醇、1%丙基硫氧嘧啶、2%脱氧胆酸钠、25%吐温80、20% 1,2丙二醇、17%水)进行灌胃,每天灌胃一次,实验进行3周后,模型组、药物反证组大鼠分别一次性尾静脉注射小牛血清蛋白468.75 mg/kg[14],继续进行灌胃脂肪乳,与此同时,将模型组、药物反证组大鼠分别放置在0℃ ~ 1℃冰水中20 min,一天一次,连续进行冰水浴,造模8周后,从模型组中随机选取3只大鼠,检测血脂、凝血四项水平以及升主动脉病理形态,进行成模预检测。
1.3.4 指标观察与检测
(1)一般指标观察:观察并记录各组别大鼠体重变化、进食情况及症状和体征的变化,摄像并留取图片,并根据抽提指标对各组别大鼠进行量化评分。
(2)行为学考察:将各组别大鼠放于长、宽、高(100 cm × 100 cm × 40 cm)的旷场反应箱底面中心,同步录像并计时,观察各组别大鼠5 min内的活动情况,每只拍摄结束后,及时清理箱体内部,避免对其他大鼠造成干扰。实验结束后,记录各组别大鼠跨过的方格数,直立次数,在中央格内停留时间,粪便粒数。
(3)指标检测方法:造模成功后,按设置剂量给予辛伐他汀、通脉颗粒进行干预,每天一次,给药一个疗程,在末次给药之后,各组别大鼠均禁食12 h,麻醉后使用普通血清管和枸橼酸钠抗凝管采血,分别应用自动生化分析仪和血凝仪检测血脂和凝血四项水平。采血结束后,摘取升主动脉和肝组织,HE染色,观察升主动脉和肝组织的病理变化。
1.4 统计学方法
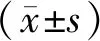
2 结果
2.1 造模方法的优化
实验结果发现,与正常组相比,模型组各组别大鼠血脂水平均显著升高,尤其是模型7、8、9组具有极显著性差异,见表2。升主动脉病理结果显示,模型1、2、3、4、5、6、7、8组升主动脉被覆单层扁平上皮细胞,中膜较厚,主要由弹性纤维组成,外膜较薄,可见少量脂肪组织和结缔组织,模型9组升主动脉内膜下可见少量泡沫细胞,见图1。由此可见,在血脂异常的前提下进行免疫应激有助于损伤内皮细胞,同时,复合冰水浴刺激,进一步促进脂质沉积和主动脉的损伤。因此,本实验选用连续灌胃脂肪乳3周后进行免疫应激,同时复合冰水浴的方法进行造模。
2.2 一般状态观察与证候积分变化
与正常组相比,模型组大鼠自主活动减少,畏寒,部分大鼠舌质紫暗,舌尖出现少许瘀斑,见图2。造模干预组大鼠的证候积分前4周持续升高,8 ~ 21周之内,造模组证候积分维持在8 ~ 12之间。21周开始给药干预后,通脉颗粒组中医证候改善率为45.9%,表明通脉颗粒可有效改善动脉粥样硬化(气滞血瘀证)中医症状和体征表现,辛伐他汀组无显著性变化。大鼠中医证候积分变化见图3。
2.3 大鼠行为学变化
第21周对各组别大鼠进行行为学考察,为成模检测提供参考。结果发现,与正常组相比,模型组、辛伐他汀组、通脉颗粒组大鼠跨格子数、直立次数、中央区停留时间非常显著降低(P<0.01),粪便粒数非常显著增加(P<0.01)。提示,造模方法干预模型组、辛伐他汀组、通脉颗粒组后,大鼠自主活动显著降低,见表3。

表2 血脂水平变化
注:与正常组比较,*P<0.05,**P<0.01。
Note. Compared with the normal group,*P<0.05,**P<0.01.

注:A:模型1组;B:模型2组;C:模型3组;D:模型4组;E:模型5组;F:模型6组;G:模型7组;H:模型8组;I:模型9组。图1 升主动脉病理学图片Note. A, Model group one. B, Model group two. C, Model group three. D, Model group four. E, Model group five. F, Model group six. G, Model group seven. H, Model group eight. I, Model group nine.Figure 1 Pathological changes of the rat ascending aortas

注:A1:正常组舌象;B1:模型组舌象;C1:辛伐他汀组舌象;D1:通脉颗粒组舌象。A2:正常组耳廓;B2:模型组耳廓;C2:辛伐他汀组耳廓;D2:通脉颗粒组耳廓。A3:正常组爪趾;B3:模型组爪趾;C3:辛伐他汀组爪趾;D3:通脉颗粒组爪趾。A4:正常组尾部;B4:模型组尾部;C4:辛伐他汀组尾部;D4:通脉颗粒组尾部。图2 大鼠外观对比Note.A1, Tongue manifestation of the normal group; B1, Tongue manifestation of the model group; C1, Tongue manifestation of the simvastatin group; D1, Tongue manifestation of the Tongmai granule group. A2, Auricle of the normal group; B2, Auricle of the model group; C2, Auricle of the simvastatin group; D2, Auricle of the Tongmai granule group. A3, Claw toe of the normal group; B3, Claw toe of the model group; C3, Claw toe of the simvastatin group; D3, Claw toe of the Tongmai granule group. A4, Tail of the normal group; B4, Tail of the model group; C4, Tail of the simvastatin group; D4, Tail of the Tongmai granule group.Figure 2 Comparison of the rat appearance

组别Groups跨格子数Number of grid crossing直立次数Times of upright standing中央区停留时间(s)Central area residence time粪便粒数Number of feces正常组Normal group110.5±10.48.8±1.010.8±1.81.8±0.9模型组Model group61.6±5.0∗∗6.4±1.1∗∗3.9±0.9∗∗4.4±0.9∗∗辛伐他汀组Simvastatin group63.1±4.4∗∗6.6±0.7∗∗6.7±0.9∗∗5.3±0.7∗∗通脉颗粒组Tongmai granule group67.3±6.8∗∗7.5±0.9∗∗5.8±1.3∗∗4.1±0.6∗∗
注:与正常组比较,*P<0.05,**P<0.01。
Note. Compared with the normal group,*P<0.05,**P<0.01.
2.4 体重变化
实验期间,正常组大鼠饮食正常,体重日渐增长。与正常组相比,造模干预各组大鼠造模期间体重降低非常显著(P<0.01),具体表现为大鼠体型消瘦,体重较轻。其中,辛伐他汀组个别大鼠体重增长相对较快,出现辛伐他汀组体重与模型组有所差异的情况。21周进行反证药物干预后,与模型组相比,药物反证组大鼠体重显著升高。见表4。
2.5 日食量和日水量变化
与正常组相比,造模干预各组大鼠在开始给予脂肪乳灌胃后,大鼠日食量显著降低。第21周进行反证药物干预后,辛伐他汀组、通脉颗粒组大鼠日食量显著升高,见图4。与正常组相比,造模干预各组大鼠日进水量显著降低,见图5。因成模检测之前,对各组别大鼠进行旷场实验,旷场实验为全人工照明,人为设定“白天”与“黑夜”。因此,从19周开始,为调整大鼠昼夜节律,以适应白天实验时间所需,对大鼠进行为期两周的昼夜颠倒适应期,由于大鼠对环境变化比较敏感,导致各组别大鼠饮食受到影响,出现进食量和饮水量显著下降的情况。
注:N:正常对照组;M:模型组:S:辛伐他汀组;T:通脉颗粒组。图4、图5同。图3 大鼠中医证候积分变化Note. N, Normal control group. M, Model group. S, Simvastatin group. T, Tongmai granule group. The same in the Figure 4 and Figure 5.Figure 3 Changes in Traditional Chinese Medicine syndrome scores in the rats
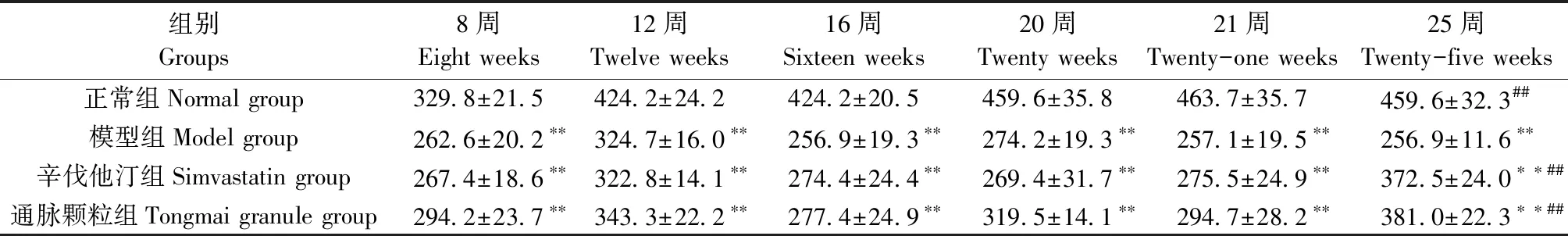
组别Groups8周Eight weeks12周Twelve weeks16周Sixteen weeks20周Twenty weeks21周Twenty-one weeks25周Twenty-five weeks正常组Normal group329.8±21.5424.2±24.2424.2±20.5459.6±35.8463.7±35.7459.6±32.3##模型组Model group262.6±20.2∗∗324.7±16.0∗∗256.9±19.3∗∗274.2±19.3∗∗257.1±19.5∗∗256.9±11.6∗∗辛伐他汀组Simvastatin group267.4±18.6∗∗322.8±14.1∗∗274.4±24.4∗∗269.4±31.7∗∗275.5±24.9∗∗372.5±24.0∗∗##通脉颗粒组Tongmai granule group294.2±23.7∗∗343.3±22.2∗∗277.4±24.9∗∗319.5±14.1∗∗294.7±28.2∗∗381.0±22.3∗∗##
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
Note. Compared with the normal group,*P<0.05,**P<0.01. Compared with the model group,#P<0.05,##P<0.01.

图4 日进食量变化Figure 4 Changes in the rat daily appetite
2.6 生化指标检测结果
2.6.1 血脂水平结果
实验结果表明,与正常组相比,模型组大鼠TC、TG、LDL-C水平非常显著升高(P<0.01),HDL-C水平非常显著降低(P<0.01);第21周给药干预后,与模型组相比,通脉颗粒组大鼠TC、TG、LDL-C水平非常显著降低(P<0.01),HDL-C水平显著升高(P<0.05),辛伐他汀组TG、LDL-C水平非常显著降低(P<0.01),HDL-C水平显著升高(P<0.05),见表5。
2.6.2 凝血四项结果
与正常组相比,模型组凝血酶原时间显著降低(P<0.05),活化部分凝血酶时间非常显著降低(P<0.01),纤维蛋白原含量非常显著升高(P<0.01)。第21周,药物反证组开始进行药物干预,结果显示,与模型组相比,通脉颗粒组纤维蛋白原含量降低非常显著(P<0.01);辛伐他汀组凝血酶原时间、活化部分凝血酶原时间显著升高(P<0.05),纤维蛋白原含量非常显著降低(P<0.01)。结果表明造模干预后各组大鼠血液凝固性升高,血液循环凝滞的风险加大。通脉颗粒和辛伐他汀对大鼠的血液凝滞状况具有不同程度的改善作用。见表6。
2.7 升主动脉和肝组织病理结果
升主动脉病理结果显示,正常组升主动脉被覆单层扁平上皮细胞,中膜较厚,主要由弹性纤维组成,外膜较薄,可见少量脂肪组织和结缔组织。模型组升主动脉内膜脂质沉积波及范围较大。第21周给予反证药物干预后,与模型组相比,辛伐他汀组和通脉颗粒组升主动脉内膜病变得到逆转。肝病理结果显示,正常组大鼠肝小叶结构大小一致,中央静脉周围的肝细胞索呈放射状排列,肝细胞呈多边形,胞浆丰富,核大而圆,位于中央。模型组大鼠肝细胞空泡变性。药物反证组大鼠肝小叶结构完整,肝细胞未见坏死、变性。见图6。

图5 日进水量变化Figure 5 Changes in daily water intake of the rats

组别Groups甘油三酯TG总胆固醇TC高密度脂蛋白HDL-C低密度脂蛋白LDL-C正常组Normal group0.69±0.08##2.40±0.27##0.51±0.05##0.84±0.06##模型组Model group1.27±0.06∗∗10.20±1.06∗∗0.33±0.07∗∗2.06±0.41∗∗辛伐他汀组Simvastatin group0.95±0.90∗∗##9.00±1.46∗∗0.30±0.06∗∗#1.06±0.10∗∗##通脉颗粒组Tongmai granule group0.81±0.05∗∗##5.90±1.22∗##0.41±0.07#0.96±0.10∗##
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
Note. Compared with the normal group,*P<0.05,**P<0.01. Compared with the model group,#P<0.05,##P<0.01.

表6 凝血四项结果
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
Note. Compared with the normal group,*P<0.05,**P<0.01. Compared with the model group,#P<0.05,##P<0.01.

注:A1:正常组升主动脉;B1:模型组升主动脉;C1:辛伐他汀组升主动脉;D1:通脉颗粒组升主动脉。A2:正常组肝组织;B2:模型组肝组织;C2:辛伐他汀组肝组织;D2:通脉颗粒组肝组织。箭头标示升主动脉内膜的病变部位。图6 升主动脉和肝组织病理学图片Note. A1, Ascending aorta of the normal group; B1, Ascending aorta of the model group; C1, Ascending aorta of the simvastatin group; D1, Ascending aorta of the Tongmai granule group. A2, Hepatic tissue of the normal group; B2, Hepatic tissue of the model group; C2, Hepatic tissue of the simvastatin group; D2, Hepatic tissue of the Tongmai granule group. Arrow indicates the lesion site of ascending aortic intima.Figure 6 Pathological changes of the rats ascending aorta and hepatic tissues
3 讨论
内皮细胞损伤和血脂异常是动脉粥样硬化发病的始动因素[2],血管内皮细胞损伤可促成脂质沉积和泡沫细胞的形成,开启发病进程[15]。中医记载,膏脂粘滞,易沉积于脉道,致气血运行阻滞,脂浊沉积,渗于脉膜,可致动脉粥样硬化[16]。气滞血瘀,引生脂浊,血浊气滞而凝聚,气、血、瘀互结交织,相互影响[17],进而加重动脉粥样硬化病变。基于此,本研究构建动脉粥样硬化(气滞血瘀证)以血脂异常为基础,以内皮损伤为关键环节,辅以寒凝气滞,构建动脉粥样硬化(气滞血瘀证)病证结合模型。
目前,动脉粥样硬化病证结合模型的研究仅限于痰瘀阻络型、秽浊痰阻型、气阴两虚型。痰瘀阻络型AS模型以高脂饲喂构建,以血脂水平和主动脉病理指标评价[4],评价指标仅限于血脂指标和升主动脉病理检测。古丽加玛力·尼亚孜等[5]利用AS发病与寒燥环境、高脂饮食习惯的关系构建秽浊痰阻型AS模型。气阴两虚型AS模型则利用中老年大鼠长期慢性饥饿、竭力游泳的方法构建。相比于上述几种模型构建方法和评价指标,本研究选用尾静脉注射牛血清蛋白、灌胃脂肪乳和冰水浴三种方法复合作用制备动脉粥样硬化(气滞血瘀)大鼠模型。除病理学形态和生化指标检测外,本研究在参考气滞血瘀证、动脉粥样硬化主、次证表现的基础上,对模型大鼠的生物表征进行量化评分,基于中医“心主血脉,贵在流通”思想,心气盛则脉络疏通而条达,心主血脉功能出现异常,致使脏腑失于濡养,终致血脉损伤[18-19]。通过行为学(旷场实验)考察反映大鼠心功能状况,辅助模型的成模判断。分别从中医“四诊”信息、行为学考察、病理学形态、生化指标检测四个方面评价动脉粥样硬化(气滞血瘀证)大鼠模型。本研究结果发现,模型组大鼠症状和体征变化情况与拟定诊断标准基本一致。日进食量、日进水量减少,体型消瘦。灌胃脂肪乳导致大鼠脂质代谢异常,体内血脂水平升高,为内皮细胞脂质的沉积奠定基础。凝血四项指标显示血液凝固性升高,纤溶性降低,提示血液循环瘀滞风险增大。病理检测显示,模型组升主动脉内膜下泡沫细胞可见,出现不同程度的脂质沉积。反证药物干预后,大鼠的症状和体征得到不同程度改善,大鼠自主活动逐渐恢复,血液生化指标显著改善,升主动脉病变被逆转。与此同时,研究发现大鼠证候积分、日进食量、日进水量曲线变化出现波动,究其原因,这主要与灌胃脂肪乳、冰水浴、旷场实验等实验操作对大鼠的影响有关。结合动脉粥样硬化(气滞血瘀证)诊疗指南和动脉粥样硬化中医诊疗方案,以上三个表征指标的曲线变化趋势与大鼠临床症状表现相符,造模方法对实验结果的信度影响尚可接受。另外,舌诊指标对气滞血瘀证临床诊断具有重要价值。中医认为,舌尖主病。舌尖青紫或有瘀斑,主血瘀病证[20]。气滞血瘀所致病多见舌质紫暗、舌尖有紫点或紫斑[21]。如今,中医舌象定量化、客观化研究取得长足进步,翁维良等[22]运用中医舌诊专家系统对血瘀证进行量化诊断,对血瘀证舌质的RGB值进行测定,舌质红色分量R值以暗红最高,绿色分量G值以紫红最高,蓝色分量B值以紫红、暗红较高。这与血瘀证的一般观察以紫暗、青紫为主相符。另外,血瘀证者较非血瘀者的瘀斑或瘀点出现率显著升高,并具有统计学差异[23]。方小燕等[24]将14种舌象进行聚类分析,其中第三类舌红或紫暗,瘀斑与气滞血瘀证舌象特点相符。梁耀月等[25]通过色度检测、分析,发现气滞血瘀证大鼠舌象有紫暗、瘀斑。本研究对大鼠舌象的一般观察亦发现大鼠出现舌质紫暗、舌尖瘀斑的表征变化,这与上述研究结果相吻合。对于其他表征指标,如外耳、足趾及尾的证候表现目前以一般观察为主,尚无客观定量研究。
动脉粥样硬化(气滞血瘀证)大鼠模型相比于动脉粥样硬化其他病证结合模型具有以下优点:①成模均匀,本研究采用灌胃脂肪乳的方法替代饲喂高脂饲料,可保证高脂摄入量均一,提高成模的均匀性。②相比于球囊导管局部损伤法,免疫应激所造成的内皮细胞损伤部位不固定。③与动脉粥样硬化(气滞血瘀证)临床表现基本一致。制备方法基于内皮细胞损伤和血脂异常这一公认的发病机制,并结合AS、气滞血瘀证的病因病机。所构建模型与动脉粥样硬化(气滞血瘀证)临床鉴别、诊断结果相符,能较真实地反映动脉粥样硬化发病过程的复杂性。同时,该方法也存在一些缺点,如造模时间较长,操作较为繁杂,工作量较大等。基于上述分析,免疫应激、冰水浴结合脂肪乳灌胃复合方法可使动脉粥样硬化(气滞血瘀证)病证同塑,为相应药物的药效作用和机制研究提供评价载体。
