甲醛对SH-SY5Y细胞的损伤作用
2019-09-27李红威
李红威,张 玲,李 卓,秦 川
(国家卫生健康委员会人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
甲醛是一类广泛存在于自然环境和人类生活环境中的醛类分子,其分子结构简单,化学性质活泼,是一种能导致DNA损伤的毒性分子,它是一种强力的蛋白质和DNA交联剂[1-2]。但在体细胞增殖和发挥正常功能所必须的一碳循环(one carbon cycle)中,丝氨酸酶解生成内源性甲醛,内源性甲醛作为体细胞正常生命活动的一种副产物,机体在维持正常生理机能和代谢平衡方面有着固有的抵御甲醛威胁的双重保护机制,使机体免受内源性甲醛的侵害。机制之一即醇脱氢酶3(ADH3)将内源性甲醛转化为甲酸[3],进而促进核苷酸的合成;而通过范科尼贫血途径(Fanconi anaemia pathway)进行DNA交联修复,逆转甲醛所致的DNA损伤为机制之二[4]。
过量的甲醛会对机体产生危害,有研究发现[5]在甲醛浓度超标的环境中长期工作,对暴露者的记忆力、注意力以及感觉认知等方面均有不同程度的损害。临床研究表明[6],阿尔茨海默病(Alzheimer’s disease,AD)患者的尿液甲醛浓度显著高于同龄正常老年人,且与认知功能下降程度呈正相关。神经细胞特别是神经元的减少和丢失是认知障碍性疾病AD的特征性病理表型[7]。然而,目前对甲醛损伤神经细胞的机制尚未完全阐明。因此,本研究,我们利用SH-SY5Y细胞系作为神经细胞的体外模型,探索甲醛对神经细胞的损伤作用,为甲醛损伤神经细胞的机制提供一定的科学依据,也为我们后续建立神经细胞损伤的体内模型提供基础。
1 材料和方法
1.1 实验材料
本研究选用人源神经母细胞瘤细胞(SH-SYSY)细胞系作为研究对象,由北京协和医学院细胞资源中心/国家实验细胞资源共享平台提供。
1.2 主要试剂与仪器
胎牛血清(FBS)、RPMI-1640购自美国Gibco公司;甲醛、PMSF购自美国Sigma公司;Cell Titer-Glo® Luminescent Cell Viability试剂盒购自美国Promega公司;NE-PER Nuclear and Cytoplastic Protein Extraction试剂盒、Protease inhibitor cocktail购自美国Thermo公司;Annexin V/FITC凋亡检测试剂盒购自日本同仁公司;T231兔单克隆抗体购自英国Abcam公司;6E10鼠单克隆抗体购自美国Biolegend公司;DRP1(dynamin-related protein 1)兔单克隆抗体购自美国CST公司;MID49(mitochondrial dynamics protein 49)、MID51(mitochondrial dynamics protein 51)兔多克隆抗体购自美国Proteintech公司;anti-β-tubulin内参购自中国中杉金桥公司。CO2恒温培养箱购自美国NAPCO公司;超净工作台购自中国北京半导体设备厂;流式细胞仪购自美国AccuriTMBD Biosciences公司;多功能酶标仪购自美国PerkinElmer公司;JEM-1400 Plus电镜购自日本电子株式会社;化学发光成像系统购自美国Bio-Rad公司。
1.3 实验方法
1.3.1 细胞培养
将SH-SY5Y细胞在完全培养基中进行培养,培养基成分包括:10% FBS、100 U/mL青霉素、100 μg/mL链霉素及RPMI-1640,置于培养箱(37℃、5% CO2)中进行培养。选取对数生长期进行实验。
1.3.2 细胞实验分组与处理
若无特殊说明,细胞实验分组均按表1所示进行处理。

表1 细胞实验的分组及处理
注:处理方式即将不同浓度甲醛加入RPMI-1640完全培养基/无血清培养基中混匀而成。
Note. The treatment method involved mixing of different formaldehyde concentrations into RPMI-1640 complete or serum-free medium.
1.3.3 细胞划痕实验
实验具体步骤参照文献[8]进行,处理完毕立刻于显微镜下选取固定位点,拍照后放入培养箱中继续培养。之后分别以6 h、12 h、24 h为时间点拍照,最后用Image-pro Plus软件计算细胞划痕面积变化;处理30 h后高倍观察并拍照。
1.3.4 细胞活性检测实验
将细胞以104个/mL的比例接种于管壁不透明的96孔板内,每孔100 μL细胞悬液,每个处理组设置5个复孔,同时设置空白对照孔,只加入培养基而不加入细胞;第二日将常规培养基更换为含甲醛的培养基,分别作用2 h和4 h时,提前30 min从培养箱取出平衡至室温,加入100 μL/孔CellTiter-Glo试剂,室温孵育10 min后在酶标仪检测化学发光值。
1.3.5 细胞凋亡检测
参照文献[9]应用Annexin V/FITC凋亡检测试剂盒进行各处理组的细胞凋亡检测,其中Annexin V-/PI-代表细胞正常;Annexin V+/PI-代表细胞早期凋亡;Annexin V+/PI+代表细胞晚期凋亡/死亡;Annexin V-/PI+代表细胞机械性死亡。
1.3.6 透射电镜检测细胞超微结构
将各组细胞处理完毕后用0.125%胰酶消化,离心后弃上清,PBS重悬,使其密度不低于1×107个/mL,再离心形成细胞沉淀,加入足量2.5%戊二醛,4℃固定过夜。第二日用PBS(pH=7.2)冲洗三次,每次10 min;之后1%锇酸4°C固定2 h,双蒸水冲洗三次,每次10 min;梯度乙醇脱水,环氧丙烷置换处理,树脂浸透,包埋,制成90 nm厚的超薄切片,醋酸双氧铀和枸橼酸铅染色,应用JEM-1400 Plus电镜观察。
1.3.7 免疫印迹检测相关蛋白表达
细胞以相同浓度接种于6孔板,待生长至对数生长期时,加入各处理因素,作用4 h。处理结束后收集细胞,加入含蛋白酶抑制剂的RIPA裂解细胞,提取蛋白,用BCA法测定蛋白浓度。用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,浓缩胶为5%,分离胶为10%,加样量为30 μg,60 V恒压电泳30 min至条带到达分离胶(溴酚蓝到达分离胶),调至100 V恒压电泳至蛋白marker分离开合适间距(约1~1.5 h),即结束电泳。用湿法电转印将凝胶中的蛋白转移至PVDF膜上(300 mA,1 h),用含5%脱脂奶粉的TBST溶液室温孵育60 min,分别加入一抗T231、6E10、DRP1、MID49、MID51,稀释比例均为1∶1000,4℃过夜;第二日TBST漂洗三次,每次10 min,然后加入二抗,稀释比例1∶7500,室温孵育1 h;anti-β-tubulin内参(1∶7500)室温孵育1 h;TBST漂洗三次,将ECL发光试剂A和B液等体积混合,均匀加到PVDF膜上,反应约1 min,置于化学发光成像系统中,自动显影。利用Image J软件进行条带光密度值的分析,并利用目的蛋白与内参蛋白条带的光密度比值比较目的蛋白的相对表达量,从而比较不同样本目的蛋白的相对表达量之间的差异。
1.4 统计学方法
2 结果
2.1 甲醛对SH-SY5Y细胞迁移能力的影响
相对于对照组,甲醛处理组的SH-SY5Y细胞的迁移能力降低,其与甲醛浓度相关。甲醛处理浓度越高,对迁移能力的影响越大,细胞迁移能力越低。如图1所示,在甲醛作用24 h后,与对照组相比,甲醛组划痕缩小面积均存在显著性差异(P<0.001)。FA-1(1 mmol/L)组细胞则在甲醛作用19 h后全部死亡,而在培养24 h后FA-0.5(0.5 mmol/L)组细胞死亡约10%,FA-0.25(0.25 mmol/L)组也存在少量细胞死亡现象。

注:A:划痕后于0 h、6 h、12 h、24 h拍照图片;B:划痕24 h后各组间迁移面积的比较;C:划痕后0 h、6 h、12 h、24 h各组迁移面积的改变。与对照组比较,***P<0.001。标尺=100 μm。图1 划痕实验显示甲醛作用对SH-SY5Y细胞迁移能力的影响Note. A, Images acquired at 0 h, 6 h, 12 h, and 24 h after scratching. B, Comparison of migration areas between groups at 24 h after scratching. C, Changes in migration area of each group at 0 h, 6 h, 12 h, and 24 h after scratching. Compared with the control group, ***P<0.001. Bars=100 μm.Figure 1 Scratch testing revealed the effect of formaldehyde on the migratory ability of SH-SY5Y cells
2.2 甲醛对SH-SY5Y细胞活性的影响
结果如图2所示,与对照组相比,在甲醛作用2 h后,FA-1(1 mmol/L)组、FA-0.5(0.5 mmol/L)及FA-0.25(0.25 mmol/L)组细胞存活率均显著降低,P值分别为0.0003,0.0460, 0.0400;而FA-0.1(0.1 mmol/L)组、FA-0.05(0.05 mmol/L)组细胞存活率虽然有所降低,但差异无统计学意义,P值分别为0.072,0.095。在甲醛作用4 h后,与对照组相比,FA-1(1 mmol/L)组、FA-0.5(0.5 mmol/L)、FA-0.25(0.25 mmol/L)组及FA-0.1(0.1 mmol/L)组细胞存活率均显著降低,P值分别为0.001,0.002, 0.001,0.002;而FA-0.05(0.05 mmol/L)组细胞存活率虽然有所降低,但差异无统计学意义,P=0.101。在FA-1(1 mmol/L)组、FA-0.5(0.5 mmol/L)、FA-0.25(0.25 mmol/L)组,作用4 h与作用2 h相比,细胞存活率也出现显著降低(P<0.05),P值分别为0.014,0.037,0.044;而在FA-0.1(0.1 mmol/L)组和FA-0.05(0.05 mmol/L)组,作用4 h与作用2 h相比,细胞存活率差异不存在统计学意义,P值分别为0.382,0.990。

注:分别于甲醛作用2 h、4 h检测。与对照组比较,*P<0.05,**P<0.01,***P<0.001;同一处理浓度组内的不同时间比较,#P<0.05。图2 CTG细胞活性实验显示甲醛对SH-SY5Y细胞活性的影响Note. Detection after formaldehyde treatment for 2 h and 4 h, respectively. Compared with the control group, *P<0.05, **P<0.01, ***P<0.001. Comparison between different time points within the group treated with the same concentration, #P<0.05.Figure 2 CTG cell viability assay revealed the effect of formaldehyde on SH-SY5Y cells
2.3 甲醛对SH-SY5Y细胞形态的影响
在中高倍显微镜下观察细胞形态改变。如图3所示,当甲醛作用30 h后拍照,与对照组相比,甲醛处理组细胞随着甲醛浓度的升高,细胞形态的改变愈加明显。FA-0.05(0.05 mmol/L)组细胞数量轻度减少,细胞形态与对照组相似,细胞结构清晰;而FA-0.5(0.5 mmol/L)、FA-0.25(0.25 mmol/L)、FA-0.1(0.1 mmol/L)组细胞依次减少,细胞形态逐渐不规则,神经突样结构变短、消失,出现大量凋亡及死亡细胞;而FA-1(1 mmol/L)组细胞则全部死亡,只留细胞轮廓尚存,细胞失去活性,暗淡无光。
2.4 甲醛对SH-SY5Y细胞凋亡的影响
结果如图4所示,与对照组相比较,FA-1(1 mmol/L)组、FA-0.5(0.5 mmol/L)、FA-0.25(0.25 mmol/L)、FA-0.1(0.1 mmol/L)组的细胞早期凋亡水平显著性升高(P<0.001),而FA-0.05(0.05 mmol/L组细胞的早期凋亡水平与对照组未见显著性差异,P=0.078;这与细胞活性检测实验结果相一致。在晚期凋亡方面,甲醛处理组与对照组相比,细胞凋亡水平均存在显著性差异(P<0.05),FA-0.05(0.05 mmol/L)组不同时间比较,P=0.043;其余各组相比,均P<0.001。

注:中高倍显微镜下拍摄细胞形态,于甲醛作用30 h后拍摄。蓝色标尺=100 μm。图3 甲醛作用对细胞形态的影响Note. Cell morphology was photographed under medium- and high-magnification 30 h after formaldehyde treatment. Blue bars=100 μm.Figure 3 Effect of formaldehyde on cell morphology
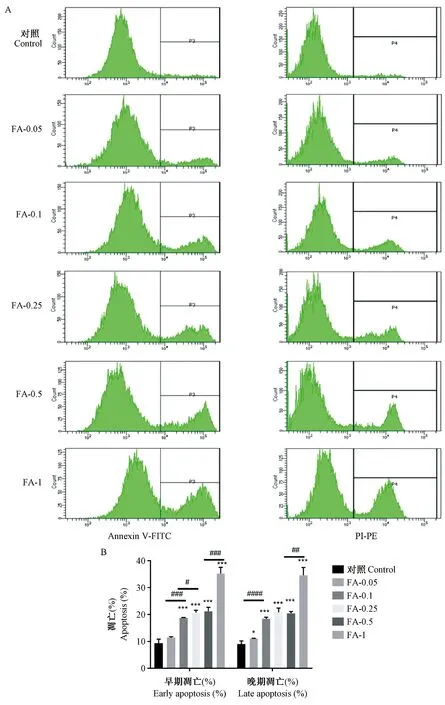
注:A:Annexin V/PI双染法检测细胞凋亡水平(%),包括早期凋亡和晚期凋亡及死亡细胞的水平。B:不同处理组间细胞凋亡率相比较,可见与对照组比较,*P<0.05,**P<0.01,***P<0.001;与不同浓度甲醛处理组比较,#P<0.05,##P<0.01,###P<0.001。图4 甲醛对SH-SY5Y细胞的凋亡的影响Note. A, Annexin V/PI double staining assay for apoptosis levels (%), including early apoptosis, late apoptosis, and dead cells. B, Ratios of apoptotic cells in different treatment groups were compared with the control group, *P<0.05, **P<0.01, ***P<0.001; or compared between formaldehyde treatment groups of different concentrations, #P<0.05, ##P<0.01, ###P<0.001.Figure 4 Effect of formaldehyde on apoptosis in SH-SY5Y cells
2.5 甲醛对SH-SY5Y细胞超微结构线粒体的影响

注:A:不同处理组间亚细胞器线粒体的比较,包括2000倍视野下的平均数量与形态改变,红色箭头指示线粒体;B:不同处理组间2000倍视野下线粒体的平均数量比较,与对照组比较,*P<0.05,***P<0.001;与不同浓度甲醛处理组比较,##P<0.01。图5 甲醛对SH-SY5Y细胞线粒体的影响Note. A, Comparison of mitochondria between different treatment groups, including the average number and morphological changes under a 2000× visual field. Red arrows indicate mitochondria. B, Average number of mitochondria in 2000× field of different treatment groups was compared with the control group, *P<0.05, ***P<0.001; or compared between formaldehyde treatment groups of different concentrations, ##P<0.01.Figure 5 Effect of formaldehyde on mitochondria of SH-SY5Y cells
在透射电镜下观察SH-SY5Y细胞,对其超微结构线粒体进行重点观察,发现不同处理组间线粒体的损伤程度存在一定的差异。如图5所示,在数量方面,对照组细胞线粒体密集,均匀分布;与对照组相比,FA-0.05(0.05 mmol/L)组和FA-0.1(0.1 mmol/L)组线粒体数目虽有所减少,但差异无统计学意义,P值分别为0.158,0.288;FA-0.25(0.25 mmol/L)组则线粒体数目显著性减少,P=0.013;FA-0.5(0.5 mmol/L)组和FA-1(1 mmol/L)组与对照组相比,线粒体数目减少地更加显著,P值分别为0.0009,0.0007。而在线粒体形态方面比较,对照组线粒体双层膜结构清晰,线粒体嵴分布均匀;与对照组相比,FA-0.05(0.05 mmol/L)组与对照组形态近似,体积稍大(膨胀);FA-0.1(0.1 mmol/L)组线粒体大部分形态正常,偶见双层膜崩解现象;FA-0.5(0.5 mmol/L)组和FA-1(1 mmol/L)组则线粒体肿胀明显,部分线粒体残留少量内嵴或嵴结构完全消失。
2.6 甲醛对SH-SY5Y细胞磷酸化tau蛋白及线粒体裂解相关蛋白表达的影响
利用免疫印迹实验(western blot)检测Control、FA-0.25(0.25 mmol/L)、FA-0. 5(0.5 mmol/L)及FA-1(1 mmol/L)组不同处理组间SH-SY5Y细胞蛋白表达水平,包括Aβ(6E10)、磷酸化tau蛋白(T231),线粒体裂解相关蛋白DRP1、MID51、MID49。结果如图6A、6B所示,与对照组相比,FA-0.25(0.25 mmol/L)组、FA-0.5(0.5 mmol/L)组和FA-1(1 mmol/L)组T231位点的磷酸化tau蛋白表达量明显增高,差异存在统计学意义,P值分别为0.016,0.006,0.010。而甲醛处理组之间的表达量无明显差异,P>0.05。Aβ(6E10)虽然在甲醛处理组表达量略有升高,但差异无统计学意义,与对照组相比,P值分别为0.048,0.076,0.117。DRP1、MID51、MID49为线粒体裂解相关蛋白,当线粒体裂解增强时,其表达增多。如图6C所示,与对照组相比,三种蛋白表达都有显著增多(P<0.05),但DRP1和MID51并未表现出甲醛处理组之间存在差异,而MID49除较对照组明显表达升高外,FA-0.25(0.25 mmol/L)组与FA-0.5(0.5 mmol/L)组,FA-0.25(0.25 mmol/L)组与FA-1(1 mmol/L)组间表达量均存在显著差异,P值分别为0.012,0.023。

注:A:T231、6E10、DRP1、MID51、MID49的免疫印迹蛋白表达条带;B:不同处理组SH-SY5Y细胞中T231、6E10蛋白表达的灰度分析结果;C:不同处理组SH-SY5Y细胞中DRP1、MID51、MID4蛋白表达的灰度分析结果。与对照组比较,*P<0.05,**P<0.01;不同浓度甲醛处理组间比较,#P<0.05。图6 甲醛对SH-SY5Y细胞磷酸化tau蛋白及线粒体裂解相关蛋白表达的影响Note. A, Western blot showing protein expression of T231, 6E10, DRP1, MID51 and MID49. B, Grayscale analysis results of T231 and 6E10 protein expression in SH-SY5Y cells of different formaldehyde treatment groups. C, Grayscale analysis results of DRP1, MID51, and MID4 protein expression in SH-SY5Y cells of different formaldehyde treatment groups. Compared with the control group, *P<0.05, **P<0.01. Comparison between groups treated with different concentrations of formaldehyde, #P<0.05.Figure 6 Effect of formaldehyde on expression of phosphorylated tau proteins and mitochondrial fission-associated proteins in the SH-SY5Y cells
3 讨论
甲醛在人体中,血液甲醛浓度的范围是20~100 μmol/L[4]。而本实验围绕正常血液浓度设置甲醛处理组的浓度梯度,对SH-SY5Y神经细胞模型进行处理。发现0.1 mmol/L甲醛作用4 h即可降低细胞生存活性和增殖能力,且甲醛对神经细胞的毒性作用与作用时间和剂量呈正相关。相比于对照组,甲醛浓度越高,对SH-SY5Y细胞的迁移能力的抑制作用越明显。而作用时间越长,对SH-SY5Y细胞的生长存活能力、增殖能力抑制性越显著。细胞的迁移能力是正常细胞的基本功能之一,是机体正常生长发育的重要生理过程,迁移也是活细胞普遍具备的一种运动形式[10]。机体在炎症反应、免疫反应以及血管生成、伤口愈合等过程中都会涉及细胞迁移。而甲醛对细胞的迁移能力的抑制,无疑是对其正常生理功能的干扰和损伤。而本研究中细胞活性实验检测的结果表明,甲醛作用浓度越大,对细胞的存活能力损伤越显著,其结果就是导致神经细胞的凋亡和坏死[11]。这可能是由于甲醛导致蛋白质和DNA的交联作用,引起DNA大量损伤,而超出了细胞自身修复的能力,最后导致神经元的死亡和减少。
在神经病理学方面,认知障碍脑病理的重要表型是神经元的变性和凋亡[12-13]。在本研究中,应用流式细胞仪检测了不同处理组间SH-SY5Y细胞的凋亡情况,发现甲醛可以诱导SH-SY5Y细胞的凋亡,且与甲醛作用剂量呈正相关。而线粒体是作为一种细胞器,在真核细胞中具有重要的生理功能,是动物细胞内ATP产生的主要场所[14]。在细胞凋亡的线粒体途径中,由于DNA损伤等因素,会激活Bcl-2家族促凋亡因子,进而导致线粒体通透性增加,线粒体释放凋亡相关因子,导致蛋白水解酶Caspase-3的激活,最后导致细胞凋亡[13]。研究显示线粒体内膜通透性的转变可以导致细胞出现凋亡[15]。这与我们在透射电镜下观察到的线粒体形态改变结果相一致。线粒体在较高浓度甲醛作用下,结构受到破坏且数量显著减少,线粒体双层膜结构受损,出现肿胀和内部嵴结构消失,是甲醛作用使线粒体膜的通透性改变,从而加剧了细胞的凋亡。
另外,线粒体能够发生高度的动态变化,能在细胞中发生移位,同时也通过自身的不断分裂和融合活动而发生形态结构变化。它的分裂与融合动态平衡对机体健康非常重要[16-17]。DRP1(dynamin-related protein 1)蛋白,即线粒体动力相关蛋白,它的主要功能是调控线粒体分裂,它对线粒体分裂活动以及维持线粒体在轴突、树突和神经突触的分布都是必不可少的。MID49(mitochondrial dynamics protein 49)和MID51(mitochondrial dynamics protein 51)是线粒体动态蛋白,在线粒体分裂过程中也发挥着重要作用。当线粒体处于分裂期时,MID49、MID51及其他线粒体分裂因子(如Mff)会招募胞浆中的DRP1,并与之结合起来调控线粒体分裂过程。正常表达的DRP1能维持线粒体动力学平衡,维持细胞正常功能。而异常表达的DRP1会引起线粒体动态异常,影响线粒体形态进而导致神经细胞的死亡。有研究显示[18],在基因修饰大鼠模型中,过氧化物酶体呈细管状,认为原因之一是DRP1的表达上调,原因之二是DRP1与Pex11β结合,从而影响了过氧化物酶的功能。我们的研究发现,甲醛作用组DRP1和MID49/51均表达上调,证明线粒体分裂增加,而影响了正常的线粒体功能和分布,导致神经细胞功能受损。这与我们的超微结构观察结果一致,甲醛作用组线粒体形态异常,数量显著减少,提示线粒体形态和分布异常,失去正常功能,最终影响神经细胞的功能和活性。
微管系统是神经细胞的骨架成分,tau蛋白是一种微管相关蛋白,它在正常脑中与微管结合,维持微管的稳定性[19-20]。在本研究的免疫印迹检测中,发现较高剂量甲醛组比对照组的磷酸化tau蛋白含量有显著增多,这与文献报道结果一致。有研究将纯化的tau蛋白与5%浓度的甲醛温育24 h后,发现tau蛋白明显集聚,形成配对螺旋样二聚体,tau蛋白错误折叠成类球形,类似阿尔茨海默病患者脑内的异常超微结构神经原纤维缠结,且其聚集产物有明显的细胞毒性,可以导致细胞的代谢障碍和死亡。因此提出“内源性甲醛慢性损伤”假说[21]。Aβ阳性斑块形成增多是神经细胞受损时神经病理的另一个重要特征,但在本研究中,甲醛作用组与对照组相比,Aβ(6E10)蛋白表达量虽有所升高,但未存在统计学意义,这需要我们进一步改进实验方案进行研究。
综上所述,甲醛通过抑制细胞迁移、降低生存活性、促进凋亡、破坏线粒体结构和功能并使其分裂增强等途径损伤神经细胞,同时上调神经细胞tau蛋白的磷酸化水平。
