基于“建构模型” 突破高考难点
2019-09-24历业余
历业余
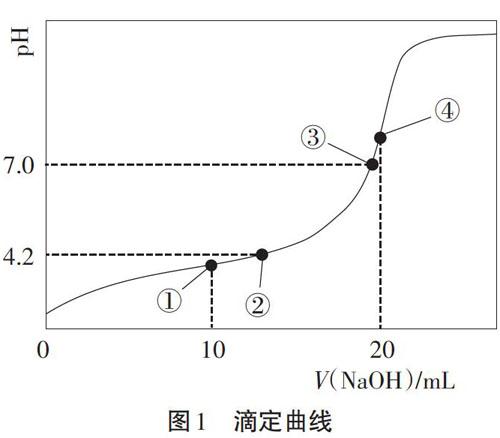
摘要:“认知模型、分析模型、建构模型、应用模型”是突破高考难点的重要路径和方法,可以大大提高高三复习效率。高三化学复习过程中,及时了解学生学习的真实状况,追踪错误的原因,精准把握教学评的难点,再顺应学生的思维和学情,顺势建构概念认知模型、理论分析模型、图表表征模型等,帮助学生突破难点。
关键词:新课程标准;突破难点;建构模型;粒子浓度
文章编号:1008-0546( 2019)08-0060-03
中图分类号:G633.8
文献标识码:B
doi: 10.3969/j.issn.1008-0546.2019.08.020
《普通高中化学课程标准(2017年版)》指出:“证据推理与模型认知”是高中化学五大核心素养之一。模型认知的具体内涵有:能认识化学现象与模型之间的联系,能运用多种模型来描述和解释化学现象,预测物质及其变化的可能结果;能依据物质及其变化的信息建构模型,建立解决复杂化学问题的思维框架[1]。粒子浓度大小比较一直是高三化学复习教学和高考难点、热点专题之一。教学中要引领学生模型认知,帮助学生树立模型意识,在难点突破中建构模型.促进学生逐渐将模型认知固化为自己学习的一种重要方式。
一、厘清概念,建构概念认知模型,突破难点“KpK等的理解与应用”
高考试题中出现K和pK等符号或概念时,学生比较陌生,无所适从。教师应当引导学生克服畏惧心理,厘清概念、理解概念、建构模型、应用模型。
1.厘清概念
理解电离常数K的概念及意义,正确判断酸或碱的相对强弱。以二元弱酸H2A为例:
2.建构模型
进一步深化对概念的认知,建构相应的概念认知模型:
(1)K值越大或pK越小,电离程度越大,酸性或碱性就越强,其相应离子的水解能力越弱;K值越小或pK越大,电离程度越小,酸性或碱性就越弱,其相应离子的水解能力越强。
(2)K只随温度的变化而变化,一般温度升高,K值变大。
例l (2017年江苏卷14题)常温下,Ka(HCOOH)=1.77xl0-4,Ka(CH3COOH) =1.75xl0-5,K(NH3·H20)=1.76xlO-5,下列说法正确的是
A.浓度均为0.1 mol.L-1的HCOONa和NH4Cl溶液中阳离子的物质的量浓度之和:前者大于后者;
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等;
C.0.2 mol.L-1HCOOH与0.1 mol.L-1NaOH等体积混合后的溶液中:c(HCOO-)+c(OH-) =c(HCOOH)+c(H+);
D.0.2mol.L-1
CH3COONa与0.Imol.L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(cr)>C(CH3COOH)>c(H+)。
3.应用模型1
根据以上概念模型可知:电离程度HCOOH>NH3.H20 -CH3COOH(近似相等),酸性HCOOH>CH3COOH,水解能力HCOO-
