借助电离学说史料突破电解质教学难点
2019-09-24邢瑞敏刘真真许英范艳花刘山虎
邢瑞敏 刘真真 许英 范艳花 刘山虎
摘要:理清电解质和电离的概念是中学化学教学中的重难点之一。结合电离学说这一史料,围绕“电解质导电的实质”和“电解质电离的能量来源”这两个核心内容,突破电解质及其电离的教学难点,加强学生对电解质定义的深度理解,掌握电解质导电的实质,理解电解质电离的驱动能量。
关键词:电解质;导电实质;能量
文章编号:1008-0546( 2019)08-0021-02
中图分类号:G633.8
文献标识码:B
doi: 10.3969/j .issn.1008-0546.2019.08.006
电解质及其电离是人教版高中《化学必修l》(以下简称教材)第二章第二节的内容,在高中化学教学中占据重要地位,起着承上启下的作用。在教学过程中我们发现学生不能很好地理解电解质概念和电离的过程,通过调研开封市杞县三所高中2018年秋季学期高一期中考试580份试卷发现,这一内容所涉及到的题目得分率约11%。经过分析试卷以及对学生、一线教师的访谈,发现学生在学习上存在以下易错内容:(1)电解质、非电解质的判断;(2)电解质的电离是否需要通电;(3)电解质是否一定能导电、非电解质是否一定不导电、在水溶液中能导电的物质是否一定是电解质。
一、重现史料,探寻难点
1799年意大利物理学家伏打(Alessandro,V.1745-1827)发明电池以后,英国化学家尼柯尔森( Nic- holson.W. 1753-1815)和卡里斯尔(Carlisle,A.1768-1840)最先发现溶液具有导电性[1]。英国化学家法拉第( Faraday,M.1791-1867)将分解前的物质称为电解质,并根据通电使其分解的现象提出了阴阳离子的概念[2]。英国化学家威廉逊( Willianson,A.W.1824-1904)和德国化学家克劳胥斯(Clausius,R.JE.1822-1888)则认为,电解质分子与其形成的阴阳离子之间存在着动态平衡,在常温下溶液中的分子不可能大量地离解[3]。最后瑞典物理化学家阿伦尼乌斯( Arrhenius,A.1859-1927)通过氨的实验发现这种物质在气体状态时是不导电的,而它的水溶液却是导体,溶液越稀,导电性越好[4],于1883年5月得出结论:溶液稀释时,导电性增加的原因是水而不是由于通电,提出了电离学说。
科学概念形成的突破点、转折点往往是中学教学过程中的重难点。结合法拉第的观点以及学生的易错点,我们发现电解质导电的条件是一个教学重点,由于电解质导电的微观现象比较抽象,所以讲解电解质导电的实质便成为本节课的教学难点。威廉逊、克劳胥斯提出了电解质分子与其形成的阴阳离子之间存在着动态平衡且没有验证,原因在于他们对电解质电离的驱动能量不清楚;阿伦尼乌斯的理论最初没有得到大家的认可,是因为导电使电解质电离的思想观念还未扭转,那么电离的能量来源又成为教学的另一个难点。
经过分析,我们发现电解质及其电离的教学难点有两个方面:一是电解质导电的实质;二是电解质电离的驱动能量。我们根据存在的问题,从化学史料出发,重构化学课堂,帮助学生理解电解质和非电解质的相关知识,掌握科学方法,提升学科素养。
二、立足史料,突破难点
1.难点一:电解质导电的实质
设计思路及意圖:
本设计不加外接电源,通过观察电流表指针的偏转判断物质是否导电。不仅验证了法拉第的观点,而且从宏观角度使学生理解电解质电离的条件。探究引起NaCl溶液或者熔融状态下的NaCl(以下简称)NaCl溶液/熔融)导电的物质是水?或NaCl固体?或NaCl溶液/熔融?从微观角度理解电解质导电是因为有自由移动的离子,并与S02在水溶液中导电行为进行比较,使学生清楚电解质导电的实质,提升“宏微结合”的化学学科核心素养。
教学过程:
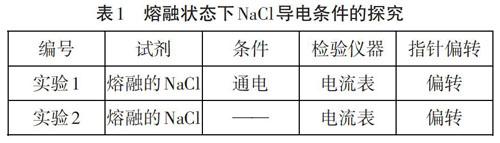
【环节一】电解质的研究始于法拉第,命名起源于法拉第错误地认为电解质是一种能被电流分解的物质,他把电解以前被分解的物质称为电解质。随着科学家的进一步研究发现:通电以前电解质在水溶液中已经解离了,电离不需要电流。但是由于历史的原因,电解质这个名字却被保留了下来。电解质是否真如字面意思一样,是一种通电分解的物质,我们采用小组实验探究一下。实验记录结果见表1。
根据实验可以得出:2中的电流表发生了偏转,说明通电不是电解质电离的必要条件。所以法拉第做出了错误的解释。那么电解质导电的微观世界到底是怎样的呢?
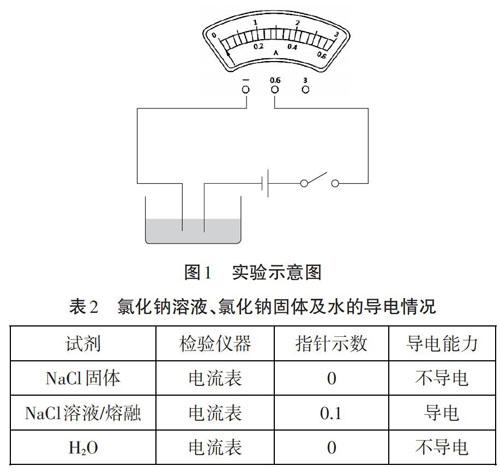
【环节二】猜测引起NaCl溶液导电的物质可能是NaCl固体本身、可能是NaCl溶液/熔融产生新粒子、可能是H20。运用图l实验装置进行小组实验,电流表量程选用0-0.6A,结果记录见表2。
通过实验我们发现,NaCl溶液/熔融能够导电,NaCl溶液/熔融导电是因为有自由移动的离子。
【环节三】NaCl溶液能够导电是因为氯化钠本身含有钠离子和氯离子,S02能导电是因为它与水反应产生了H2S03,H2S03电离出了自由移动的离子,使得溶液能够导电,并不是S02自身电离出来的离子使溶液能够导电,引导学生回答判断电解质和非电解质时,还要看是否为自身电离。
【小结】电解质导电的实质是其在水溶液或者熔融状态下自身解离出自由移动的离子。
2.难点二:电解质电离的能量来源
设计思路及意图:
电解质(以氯化钠为例)电离是什么驱使的呢?本设计从H20是极性分子,氧原子上聚集着负电荷,氢原子上聚集着正电荷角度出发,引出电解质在水溶液中电离的驱动力是水的静电引力,进而大胆猜测熔融状态下电离的驱动力。
教学过程:
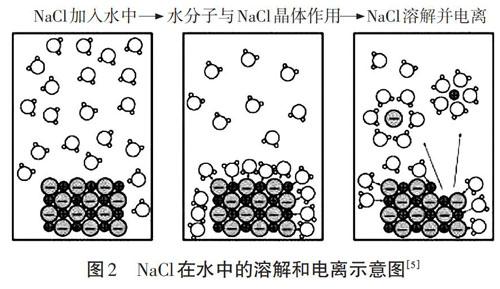
【环节一】阿伦尼乌斯的观点没有很快得到大家的认可,是因为通电使电解质分解的思想观念还未扭转,更不知道电解质借助什么来破坏其内部强烈的相互作用力。结合图2分析,水分子是一个极性分子,不断撞击氯化钠晶体表面,水分子中氧原子上聚集着负电荷容易与钠离子结合形成水合钠离子、氢原子上聚集着正电荷容易与氯离子结合形成水合氯离子,使学生明白在水溶液中电解质电离出来阴阳离子的关键在于水的静电引力。
【环节二】NaCl由固态变为熔融的液态的过程中,被束缚着的钠离子和氯离子在加热提供的热能的作用下挣脱束缚,变成自由移动的钠离子和氯离子而能够导电。
【小结】电解质电离的能量来源是水溶液提供的静电引力或加热提供的热能。
三、突破难点,加强对电解质、非电解质定义的理解深度
无论是2002年人教版教材还是2007年新版人教版教材,电解质的概念是一致的。教材中给出的电解质概念关键词突出——“水溶液”“熔融状态”“导电”“化合物”。经过上面的分析,我们可以尝试对电解质的定义做一个补充。电解质:在水溶液或熔融状态下自身解离出自由移动的阴阳离子而导电的化合物。非电解质:在水溶液和熔融状态下不能自身解离出自由移动的阴阳离子而不能导电的化合物。在定义中增加了两个关键词——“自身电离”“自由移动”。
描述电解质导电的微观现象,有利于学生对电解质、非电解质相关内容作出正确的判断,“自由移动”这一微观描述对判断电解质非电解质能否导电提供依据。例如:氯化钾溶液中钾离子和氯离子能自由移动能导电,氯化钾固体中钾离子和氯离子不能自由移动不能导电。“自身解离”这一微观描述为判断二氧化硫、氨气、二氧化碳、蔗糖等这类分子化合物是不是电解质提供依据。例如:蔗糖自身不能解离所以是非电解质。
四、总结与思考
通过对电离学说发展史的梳理,学生不仅清晰地认识电解质的概念、掌握电解质导电的实質、明白电解质电离的驱动能量,也感受到科学概念发展过程中科学家们不断完善的艰辛。因此,在教学过程中,合理引入化学史是十分必要的,不但可以把难点讲得通透,而且可以培养学生的科学探究精神。
参考文献
[1]袁翰青,应礼文.化学重要史实[M].北京:人民教育出社,1989:336-339
[2] Charles A.Kraus.The present state of the electrolyte problem[J].Journal of Chemical Education, 1958(7):324
[3] Ran Friedman.Electrolyte Solutions and Specific Ion Effectson Interfaces[J].Journal of Chemical Education, 2013(8):1018-1023
[4]高晓伟,郑长龙,徐洁.“电解质”的教学设计与反思[J].中学化学教学参考,2015(13):19-23
[5]宋心琦,普通高中课程标准实验教科书(化学)[M].北京:人民教育出版社,2007
