以三氯化铁蒸发结晶现象作为盐类水解新授课教学素材的尝试
2019-09-24何文杰陈伯瀚
何文杰 陈伯瀚
摘要:针对以解释盐溶液酸碱性为主的盐类水解常规教学中存在的问题,进行教学改进。尝试以三氯化铁蒸发结晶现象作为盐类水解新授课的教学素材,通过三氯化铁、氯化钠、硫酸铁三种溶液蒸发结晶现象的对比和三氯化铁结晶方法的改进讨论,引发真实问题探究。介绍了该教学过程中促进学生建立水溶液问题解决思路的策略,以及提升学生水解平衡模型认知水平的策略。
关键词:盐类的水解;三氯化铁;教学策略;水溶液
文章编号:1008-0546( 2019) 08-0026-02
中图分类号:G633.8
文献标识码:B
doi: 10.3969/j .issn.1008-0546.2019.08.008
一、问题引出
盐类水解的常规教学模式一般通过盐溶液的酸碱性引发学生思考,进而分析盐溶液中微粒种类,分析溶质和溶剂电离过程及可能存在的相互作用,并在教师帮助下建立水解平衡概念,最终利用水解平衡概念对不同盐类物质的酸碱性等宏观现象做出解释与预测[1-4]。常规教学中往往存在以下问题:①只测定溶液酸碱性,缺少对水解过程更多的证据支持;②由于证据单一,学生难以从平衡的角度理解水解过程;③单纯解释酸碱性,导致探究活动中学生思考深度不足,难以调动学生学习兴趣,也难以体现水解平衡的应用价值。笔者尝试利用FeCl3、NaCl、Fe2(S04)3溶液蒸发结晶中现象的差异,引发真实问题探究,并改进上述问题。
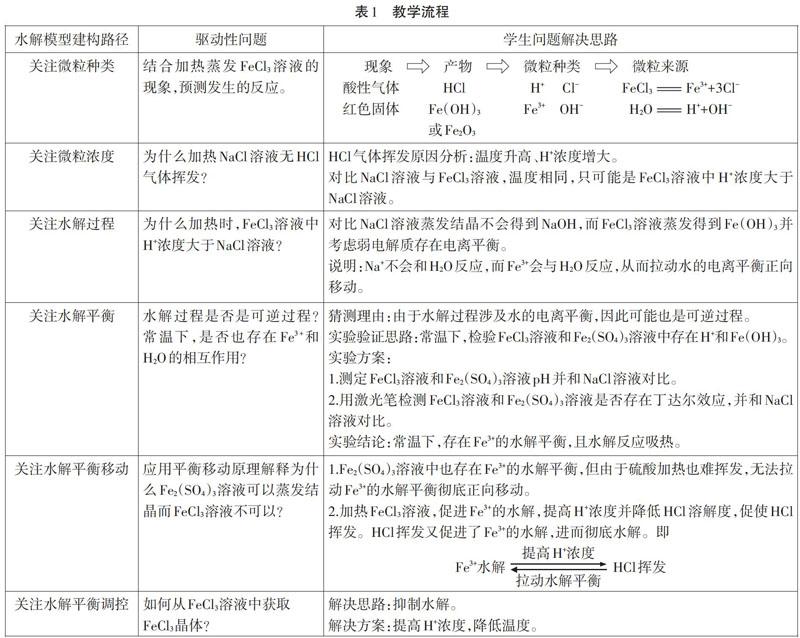
二、教学流程概述
实验情景:三种盐溶液蒸发结晶现象存在差异。氯化钠:得到白色固体,经检验为氯化钠。硫酸铁:得到白色固体,经检验为硫酸铁。三氯化铁:加热一段时间后溶液变浑浊,生成红色固体与酸性气体,经检验红色固体中不含Cl-。探究问题:为什么三氯化铁溶液无法蒸发结晶?如何改进方法获取三氯化铁晶体?
三、教学策略分析
1.促进学生建立水溶液问题解决思路的策略
本设计通过解释加热FeCl3溶液时的特殊现象作为情景引入,分为四个环节:①通过讨论加热过程中发生的反应促使学生关注溶液中微粒的种类;②通过讨论氯化氢挥发的原因,促使学生关注微粒的浓度及溶质与溶剂之间微粒的相互作用;③通过常温和加热时水解过程的比较,促使学生意识到水解是一个平衡过程;④通过对特殊现象的解释和对获取三氯化铁晶体方法的讨论,促使学生分析水解平衡的移动与调控方法。
通过设计以上的驱动性问题,串起了解决水溶液问题的一般思路,并将思路细化拆分,有逻辑地依次呈现给学生,从而有效地引导学生自主建立水溶液问题的分析思路。同时,问题的设置不仅仅停留在建立水解平衡,还涉及平衡移动的分析解释与调控,使学生所形成的水溶液问题解决思路更为体系化。在课程最后,教师会要求学生阐述形成的思路,予以总结。
此外,与水解平衡常规教学的探究活动仅从盐溶液酸碱性进行展开不同,蒸发FeCl3溶液可以给学生提供更丰富的溶质溶剂间存在相互作用的证据。同时,三种盐溶液蒸发结晶现象的差异也可以促使学生主动对三种水溶液中微粒种类的差异作比较,对溶液中可能存在的平衡和平衡移动的影响因素进行讨论,给予了学生更大的思考空间和思考深度。学生需要不断地基于现象分析,基于实验验证。这种基于真实问题的解决过程,可使学生更好地建立并固化水溶液问题的解决思路。
2.提升学生水解平衡模型认知水平的策略
水解模型的认知应该包括模型理解和模型应用两个方面。
(1)运用对比理解水解平衡。通过加热FeCl3溶液会有氢氧化铁生成,而加热NaCl溶液不会有氢氧化钠生成的对比,可使学生意识到强离子和弱离子水溶液中的差异,从而理解水解的条件。通过对加热NaCl溶液和FeCl3溶液是否生成氯化氢的对比,使学生意识到弱离子和水反应的过程会促进水的电离,并改变溶液中H+和OH-的浓度,从而引导学生自主建构水解平衡模型,理解水解的本质。
此外,和常规教学相比,本设计更加强调学生寻找平衡的过程。引导学生通过分析水解过程涉及水的电离平衡,猜测水解过程可能是可逆过程。进而引导学生从生成物与反应物共存和不同温度下平衡的移动两个角度尋找水解平衡过程存在的证据,并推测该平衡过程中的能量变化。
(2)创设情境应用水解平衡。在复杂情境中应用水解模型是促使学生将平衡原理迁移至水解平衡的有效方式。难点在于如何引导学生分析和预测多平衡之间的相互影响以及在多平衡中找到主平衡,并进行调控。
例如,蒸发FeCl3溶液同时涉及Fe3+水解平衡和氯化氢的溶解平衡。两个平衡之间存在相互影响,Fe3+的水解提高了溶液中H+浓度,促使氯化氢挥发。同时,氯化氢挥发也促进了Fe3+的水解平衡,二者相互影响,致使在加热条件下,三氯化铁彻底水解。通过对比Fe2(SO4)3和FeCl3溶液加热时的现象,可以引导学生主动将平衡移动原理应用于水解平衡,对二者的现象差异进行解释。
再如,在让学生设计从FeCl3溶液中获取晶体的方法时,部分学生想到提高H+浓度的方法,但却将原因解释为抑制了水的电离平衡,说明学生没有准确地找到主平衡;另有部分学生提出加入氯化钠抑制三氯化铁的水解这一错误方法,说明学生没有从弱离子和水相互作用这一本质角度理解水解平衡。通过教师的纠错,学生可以有效地提升对水解模型的认知水平。
参考文献
[1]胡久华,支瑶,陈欣.采用不同教学处理进行盐类水解教学的案例研究[J].化学教育,2006(12):23-25
[2]何彩霞.运用化学观念促进学生深层思维[J]中学化学教学参考,2013(12):10-12
[3] 李蓉.基于学生自主发展的“盐类的水解”有效教学设计[J].中学化学教学参考,2010(6):26-29
[4]王敏,“盐类的水解”教学设计[J].化学教育,2010(增刊):65-67
