纤维素/海藻酸钠基双膜水凝胶的制备及其药物控释研究
2019-09-24许孟杰陈华泉周雪松
许孟杰,陈华泉,周雪松
(华南理工大学 制浆造纸工程国家重点实验室,广东 广州 510640)
海藻酸盐可以从天然褐藻中获得,具有生物相容性、低毒性、成本低廉、容易与二价金属离子凝胶化等优点,被广泛用于制备水凝胶并应用在生物医学领域,尤其是蛋白质和药物的传输[1]。海藻酸盐基水凝胶运用于药物传输,一般方法是将目标药物包封在三维网络结构的水凝胶中,通过扩散和水凝胶的瓦解来实现药物稳定释放[2]。纤维素是一种天然高分子,来源广泛、生物相容性好、无毒,故纤维素被应用在药物医学方面有天然的优势,并有较长的历史[3]。但以往研究纤维素材料作为药物载体,仅考虑了单药物传输系统,而缺乏复合药物传输系统的研究[4]。近5年来,各种生物高分子聚合物(壳聚糖[5]、海藻酸盐[6-7]、羧甲基纤维素[8])被研究制作多层膜水凝胶材料。本研究旨在开发阳离子纤维素和阴离子海藻酸盐的双膜水凝胶材料,并作为新型复合药物载体。因为构建水凝胶的两组分都是天然多糖,故双膜水凝胶的生物相容性和无毒性得以保证。
对于药物释放,如果药物传递系统能逐渐释放活性成分,则可以确保长时间的治疗水平,克服活性物质半衰期短的缺点[9]。本研究选用牛血清白蛋白和茶碱为模型药物,分别担载在双膜水凝胶的内外层,探究双膜水凝胶作为新型药物载体的复合药物释放效果。
1 实验部分
1.1 试剂与仪器
微晶纤维素、海藻酸钠(SA)、牛血清白蛋白(BSA)、考马斯亮蓝G250、氢氧化钠(NaOH)、脲、氯化钙(CaCl2)、(3-氯-2羟丙基)三甲基氯化铵溶液(CHPTAC,65%)、茶碱(药典BP级)均为分析纯,无需纯化可直接使用。
FTIR-Nexus 670红外光谱仪;AVANCE AV 400超导核磁共振谱仪;EV018扫描电子显微镜(SEM);UV8453紫外分光光度计;Vario EL cue型元素分析仪;OLYMPUS光学显微镜。
1.2 阳离子纤维素的制备
合成路线如下:
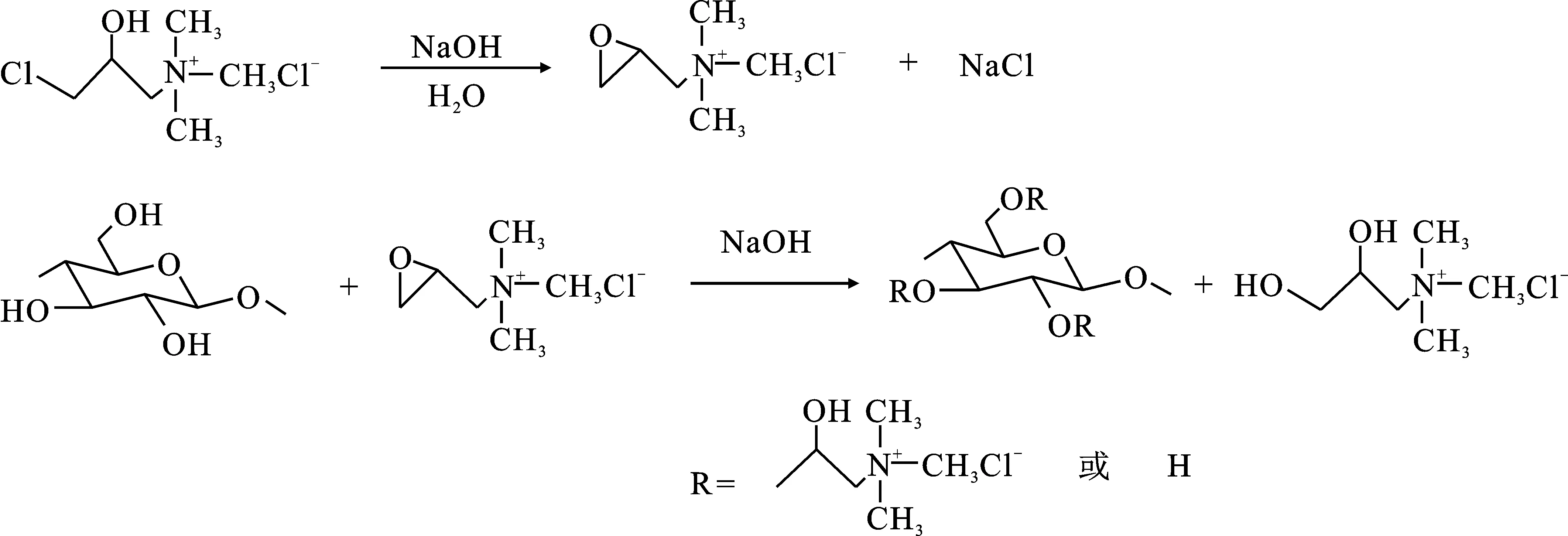
按照氢氧化钠∶脲∶水质量比为7∶12∶81 的比例配制 100 g 溶液[10],放置在冰箱中预冷至-12 ℃,然后快速将2 g纤维素加入配制好的溶液中,高速搅拌 5 min。随后,将得到的溶液转移到离心管中,放入冷冻离心机中,8 000 r/min 条件下离心10 min,除去气泡和少量未溶解的纤维素,即得透明的浓度为2%纤维素溶液,0~5 ℃下封口存放待用。
将不同量的CHPTAC加入到纤维素溶液中,在25 ℃条件下搅拌反应24 h后,用HCl将反应后的溶液中和到pH=7。然后加入2倍体积的无水乙醇,搅拌,砂芯漏斗抽滤,无水乙醇洗涤数次后,于 60 ℃下真空干燥24 h,得到白色颗粒状固体,即为阳离子纤维素。根据CHPTAC与纤维素不同的物质的量比,合成两种阳离子纤维素CC-1、CC-2。
1.3 阳离子纤维素的表征
红外光谱(FTIR)采用傅里叶变换红外光谱仪,以溴化钾压片。核磁分析13C NMR采用核磁共振谱仪,以重水(D2O)为溶剂。
采用元素分析仪测定阳离子纤维素氮元素含量,根据氮元素的含量计算阳离子纤维素的取代度(DS),公式为:
1.4 水凝胶的制备
1.4.1 单膜水凝胶 分别配制0.15%(质量分数)的阳离子纤维素溶液(CC-1)、0.15%(质量分数)阳离子纤维素溶液(CC-2)、1.5%(质量分数)海藻酸钠溶液。混合阳离子纤维素溶液和海藻酸钠溶液,用喷嘴直径为3 mm的注射器吸取上述混合溶液,将混合溶液通过注射器滴入到0.2 mol/L的CaCl2的水溶液中,交联反应1 h,产生水凝胶。用去离子水冲洗掉水凝胶表面的Ca2+,然后用滤纸吸收水凝胶表面的水。分别制备出纯海藻酸钠水凝胶(SA)、海藻酸钠/阳离子纤维素水凝胶(SA/CC-1、SA/CC-2)。
1.4.2 双膜水凝胶 将制得的单层膜水凝胶放置在1.5%(质量分数)海藻酸钠溶液中,放置不同的时间(5 min,20 min,1 h,3 h,6 h)。当单层膜水凝胶吸收完不同量的海藻酸钠溶液后,将其转移到0.2 mol/L 的CaCl2溶液中交联形成第二层海藻酸钠膜。制备双层膜水凝胶的路线见图1。
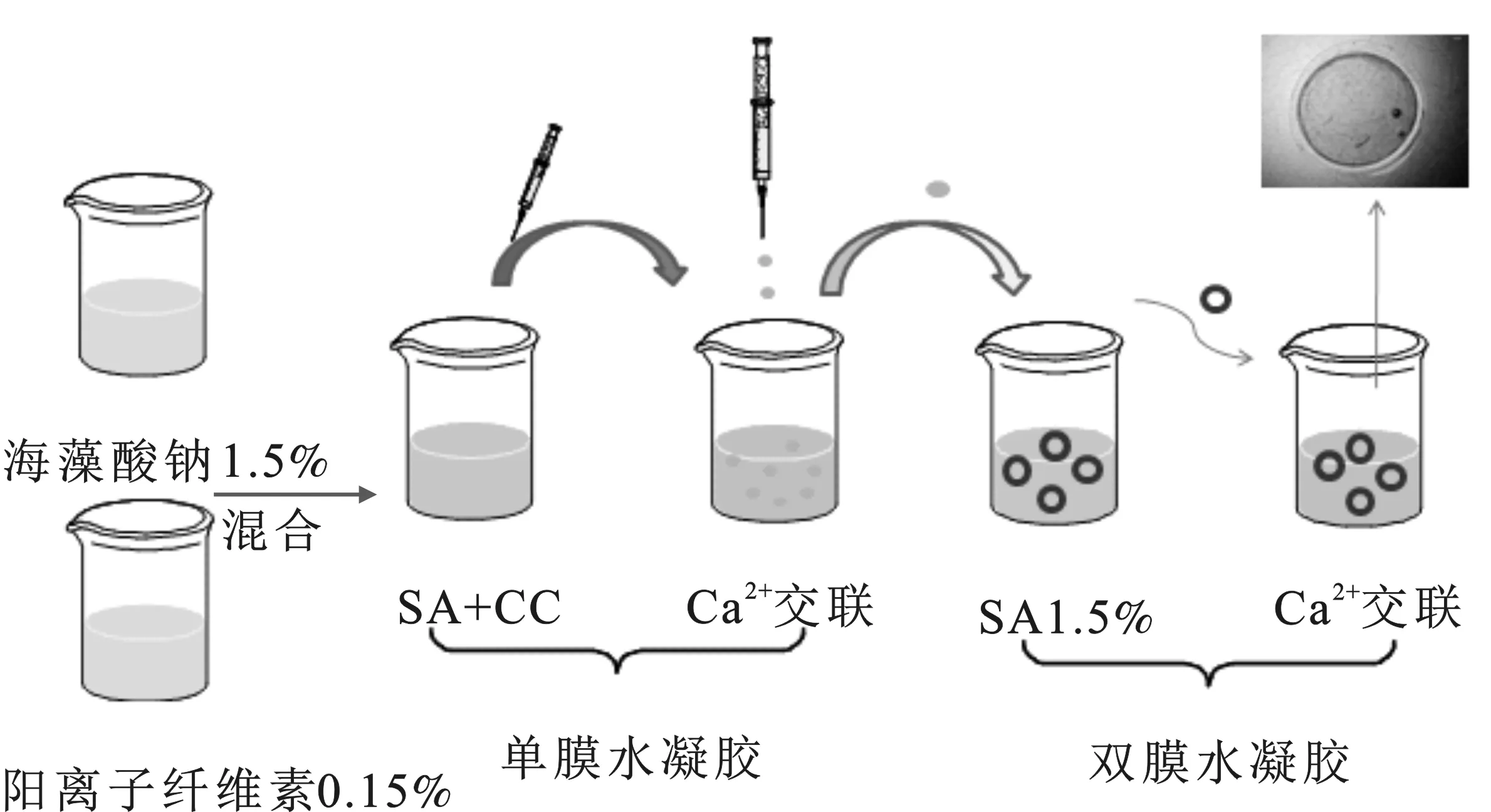
图1 单膜和双膜水凝胶制备流程Fig.1 Preparation process of single-membrane and double-membrane hydrogels
1.5 水凝胶结构表征
1.5.1 光学显微镜 用光学显微镜观察单膜、双膜水凝胶的形貌,放大倍数为10倍。将球形水凝胶放置在长方形石英比色皿上,然后滴加去离子水直至完全浸没水凝胶。
1.5.2 扫描电镜 通过SEM进一步观察冷冻干燥后的水凝胶的表面和内部结构,在观察之前,所有样品都镀金,在10 kV的加速电压下进行SEM操作。
1.6 体外药物释放研究
1.6.1 单膜水凝胶 以牛血清白蛋白为模型药物探究单膜微球水凝胶体外药物释放行为。制备担载药物的微球体水凝胶,首先将牛血清白蛋白溶解在海藻酸钠、阳离子纤维素混合水溶液中并不断搅拌,牛血清白蛋白的浓度为0.1%(w/v)。然后吸取上述混合溶液滴加到0.2 mol/L的CaCl2溶液中,交联反应1 h制得担载牛血清白蛋白的微球体水凝胶。将担载了药物的微球体水凝胶分别浸入到pH=2.0和pH=7.4的缓冲液中,温度为37 ℃的条件下进行药物释放性能的研究。分别在pH=2.0和pH=7.4的条件下进行药物释放实验,是模拟人体的胃部和结肠部位的pH环境。利用Bradford[11]方法,在预定的时间点取0.8 mL待测液,用紫外分光光度计测量其在595 nm处的吸光度,进而检测释放出牛血清白蛋白的浓度。待测定完成后,向待测液中加入另外的0.8 mL新鲜缓冲液,保持待测液总体积恒定。根据标准曲线可以确定牛血清白蛋白的累积释放率。
1.6.2 双膜水凝胶 两层膜担载不同的药物,内层担载牛血清白蛋白,外层担载茶碱,研究不同药物的释放行为。类似于单层膜药物释放研究,将担载了药物的双层膜水凝胶浸入到pH=2.0和pH=7.4的缓冲液中,温度为37 ℃的条件下进行药物释放性能的研究。在预定的时间点取3 mL待测液,用紫外分光光度计于波长273 nm处测定溶液的吸光度,进而检测释放出茶碱的浓度。同时取0.8 mL待测液,利用Bradford方法,用紫外分光光度计于波长595 nm处测定溶液的吸光度,确定释放出的牛血清白蛋白的浓度。测定完成后,向待测液中加入等额的新鲜缓冲液,维持待测液总体积恒定。
1.7 溶胀/侵蚀行为
将双层膜水凝胶浸没在pH=2.0和pH=7.4的缓冲液中,研究溶胀行为。在特定的时间间隔,取出吸水后的水凝胶,用滤纸去除水凝胶表面的水分,用质量法算出水凝胶的溶胀率(SR)。
其中,Ws是吸水后的水凝胶质量,Wd是初始水凝胶的质量。
2 结果与讨论
2.1 阳离子纤维素表征
通过元素分析测定不同样品(CC-1、CC-2)的氮元素含量及取代度,结果见表1。
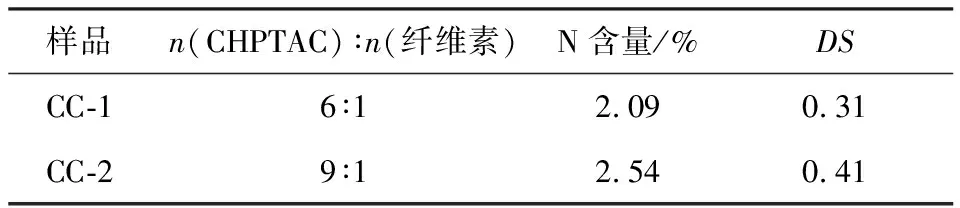
表1 样品元素分析及取代度Table 1 Elemental analysis and substitutiondegree of samples
阳离子纤维素的红外光谱见图2。
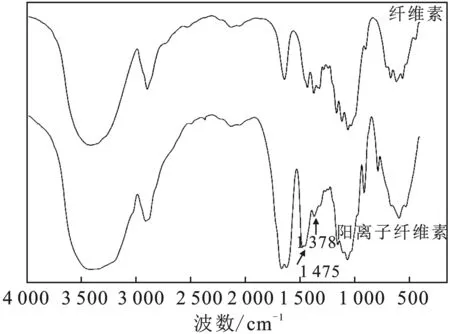
图2 阳离子纤维素(样品CC-2)红外光谱图Fig.2 Infrared spectrum of cationic cellulose (sample CC-2)
由图2可知,阳离子纤维素与纤维素最明显不同之处在于1 474 cm-1处的吸收峰,对应于铵盐基团中的甲基。此外,1 378 cm-1处是C—N键的吸收峰。红外图谱表明,季铵盐阳离子基团被成功引入到了纤维素分子链上。
将阳离子纤维素溶于氘代水中,其13C NMR 谱图见图3。
由图3可知,化学位移102.4,78.5分别对应于葡萄糖单元上的C1、C4吸收峰;化学位移73.0处为葡萄糖单元上的C2、C3和 C5的吸收峰;而在此化学位移处还有一吸收峰,几乎与 C2,3,5的吸收峰重合,应归属于阳离子醚化剂3-氯-2-羟丙基三甲基氯化铵(CHPTAC)中亚甲基中的碳原子(C7);化学位移60.0对应于亚甲基碳C6;在化学位移68.2处为季铵盐阳离子基团中位于氮原子与羟基碳原子之间的碳原子(C9);位于65.2处的吸收峰则归属于阳离子醚化剂中连接羟基的碳原子(C8);在 54.4附近有一个强烈的吸收峰,应为季铵盐阳离子基团中连接氮原子的三个甲基碳原子(C10)吸收峰。根据碳谱的结果,进一步证明,在NaOH/脲溶剂体系中,成功合成了阳离子纤维素。
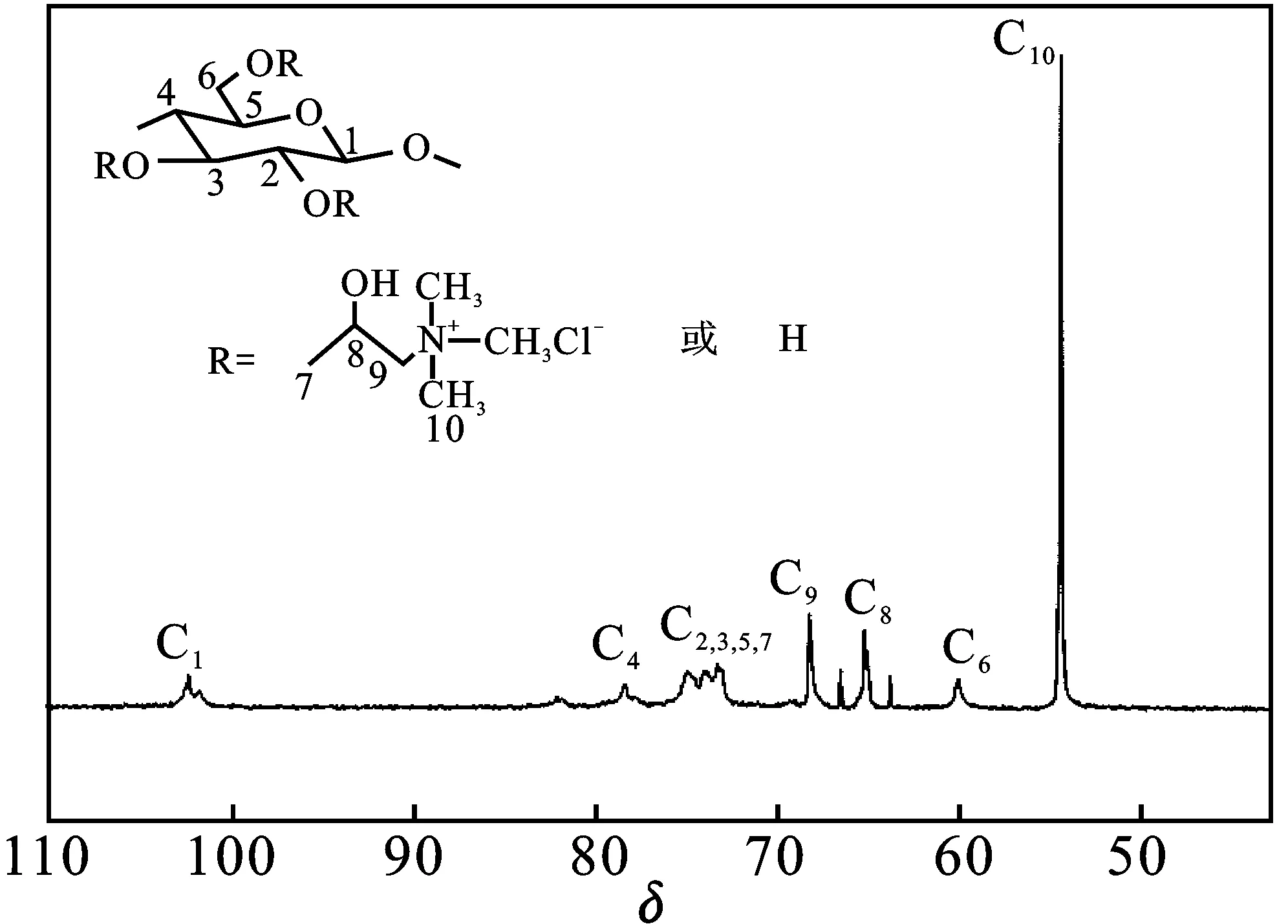
图3 阳离子纤维素的13C NMR谱图(样品CC-2,DS=0.41)Fig.3 13C NMR spectra of cationic cellulose
2.2 水凝胶的形态结构
用光学显微镜观察球体单膜和双膜水凝胶的结构,结果见图4。通过控制吸收纯海藻酸钠的时间,水凝胶外层膜的厚度从35(5 min)~700 μm(3 h)。具体厚度见表2。因为水凝胶的厚度太小或太大都不利于药物的控制释放,故在进行水凝胶的复合药物释放研究时,选用了持续吸附纯海藻酸钠1 h而制备成的双膜水凝胶。
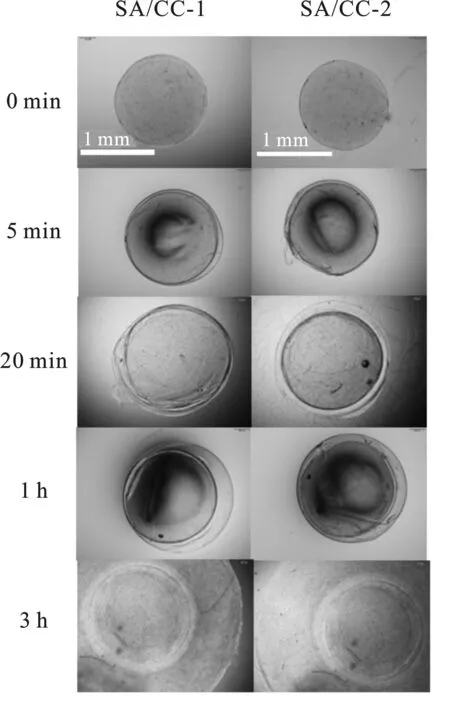
图4 水凝胶的光学显微镜照片Fig.4 Optical microscopic photographs of hydrogels
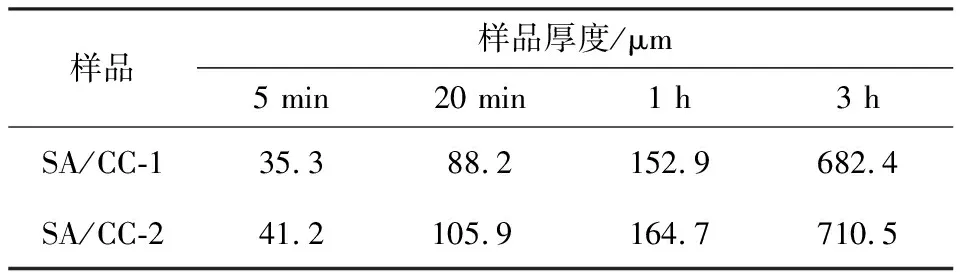
样品样品厚度/μm5 min20 min1 h3 hSA/CC-135.388.2152.9682.4SA/CC-241.2105.9164.7710.5
水凝胶冷冻干燥后,用扫描电镜观察其整体和内部的形貌,结果见图5。
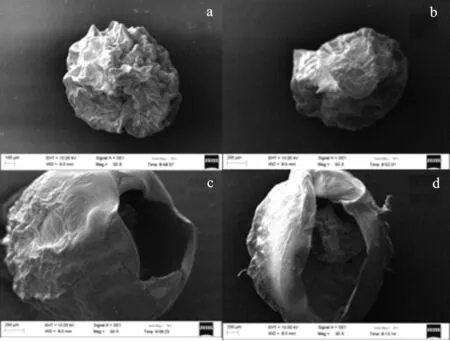
图5 水凝胶的SEM图Fig.5 SEM images of hydrogels a.SA单膜水凝胶;b.SA/CC-2单膜水凝胶; c.SA/CC-2-1h双膜水凝胶;d.SA/CC-2-3h双膜水凝胶
由图5a和5b可知,SA/CC单膜水凝胶与SA水凝胶的塌陷表面形态相比,表现出更规则和完全球形的形态。这是由于刚性纤维素的存在,可以防止海藻酸钠基水凝胶结构倒塌和增强其结构稳定性。由图5c和5d可知,SA/CC-1h和SA/CC-3h水凝胶的双膜结构,一个薄薄的外膜覆盖了内部水凝胶表面。
2.3 单膜水凝胶的药物释放特性
单膜水凝胶的药物释放行为(BSA)是pH敏感的,在温度37 ℃,pH=7.4和pH=2.0缓冲液中3种单膜水凝胶的累积药物释放曲线见图6。
由图6a可知,在pH=7.4条件下,3种单膜水凝胶SA、SA/CC表现出不同的药物释放行为。与纯海藻酸钠水凝胶SA快速释放牛血清蛋白(3 d)相比,SA/CC-1水凝胶释放牛血清白蛋白的效果明显缓慢,延长至6 d,SA/CC-2甚至可以控制释放至8 d。在形成稳定的交联结构的基础上,SA/CC水凝胶能延缓牛血清白蛋白释放,一是相比于SA水凝胶,刚性纤维素链的存在可延长药物扩散的路径;二是阳离子纤维素与海藻酸盐之间存在强的静电作用,可以进一步延缓药物的释放,故阳离子化程度更高的SA/CC-2水凝胶控释牛血清白蛋白的效果最好。由图6b可知,在pH=2.0的条件下,所有水凝胶的牛血清白蛋白释放量明显减少,因为海藻酸盐在酸性条件下会变得更紧密,渗透性更低。同样由于阳离子纤维素与海藻酸盐之间的静电作用,SA/CC-1和SA/CC-2水凝胶的3%牛血清白蛋总释放量,明显低于SA水凝胶的6%总释放量。
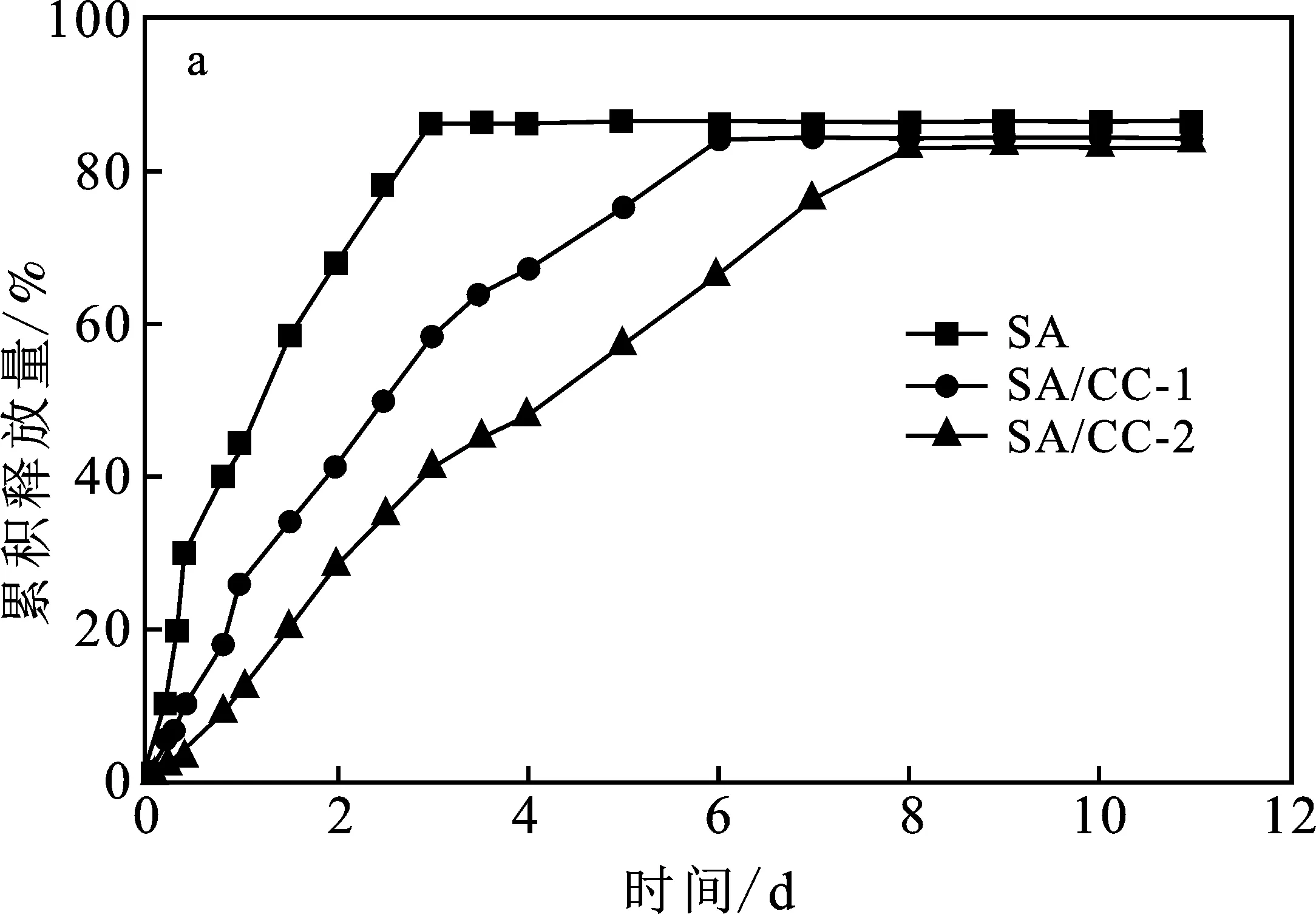
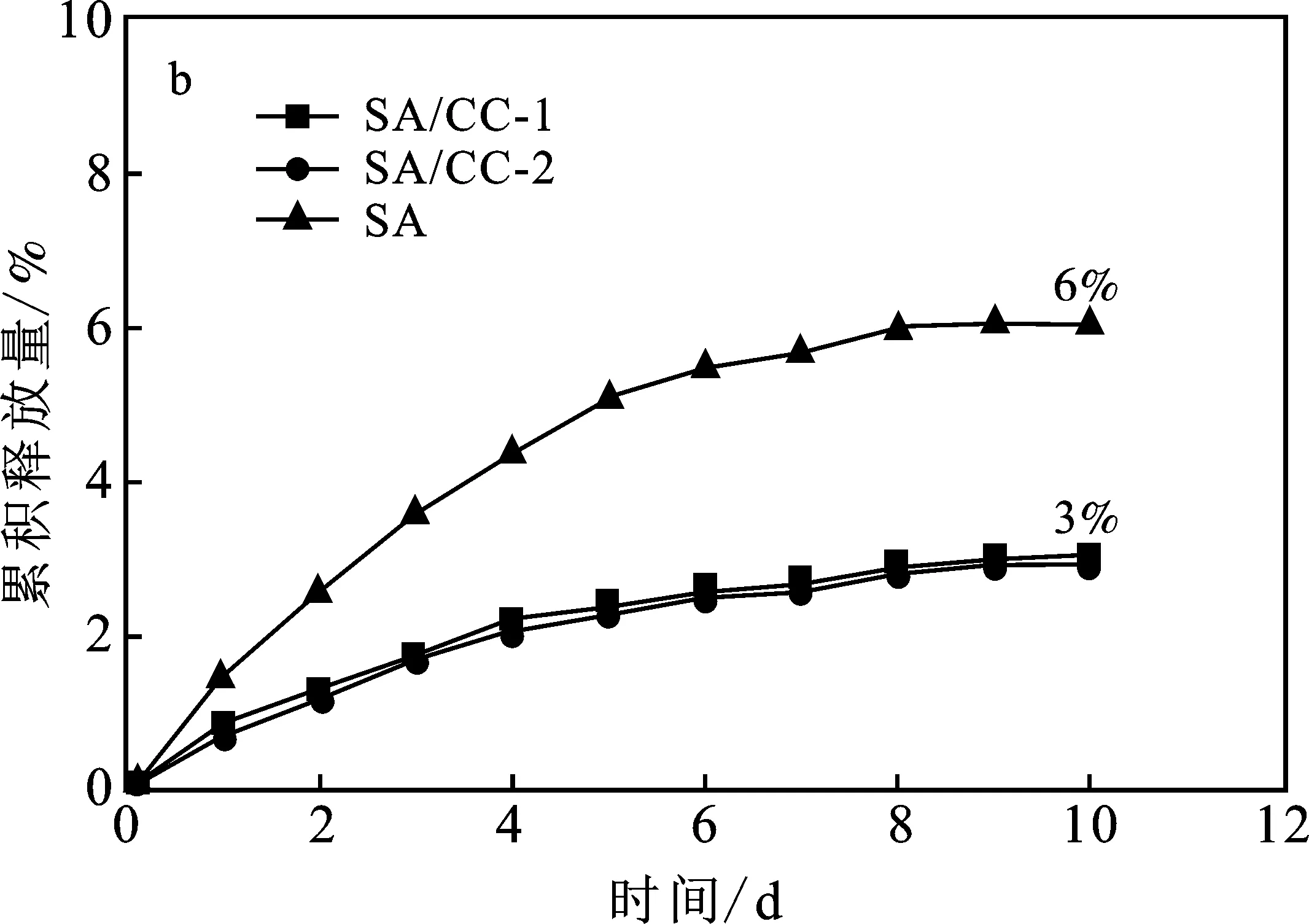
图6 单膜水凝胶的牛血清白蛋白释放研究Fig.6 Bovine serum albumin release of single-membrane hydrogela.pH=7.4;b.pH=2
2.4 双膜水凝胶的复合药物释放特性
由图7可知,关于茶碱的释放,SA/CC-1-1h,SA/CC-2-1h双膜水凝胶表现出相似的行为,即pH=7.4条件下药物分子在3 d内快速释放。这两种水凝胶有相同组分和结构,快速释放茶碱可归因于外部纯海藻酸盐膜的溶胀和崩解。在茶碱释放的前3 d期间,没有检测到牛血清白蛋白的释放,这表明复合药物是从双膜水凝胶中有序释放出来的。对于SA/CC-1-1h双膜水凝胶,牛血清白蛋白在4 d后开始释放,并从第6 d到第8 d快速释放,第9 d达到平衡。然而,SA/CC-2-1h双膜水凝胶表现出不同的牛血清白蛋白药物释放行为,其药物的持续释放延长至7~8 d(从第4 d开始释放并在第11 d或第12 d 达到平衡)。这种结果和研究单膜水凝胶药物释放行为类似,即作为水凝胶组分之一的纤维素的阳离子化程度越高,两组分之间的静电作用更强,药物的延缓释放效果越显著。
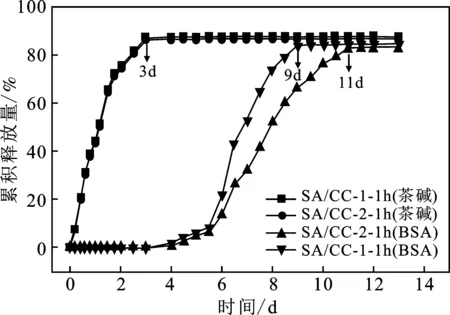
图7 在pH=7.4缓冲溶液中双膜水凝胶的复合药物释放曲线Fig.7 Complexing drug release curve of double-membrane hydrogel in pH=7.4 buffer solution
2.5 溶胀侵蚀行为
为了探究复合药物释放的过程,在pH 7.4和pH 2.0条件下对SA/CC-2-1h双膜水凝胶进行溶胀/侵蚀实验,结果见图8。
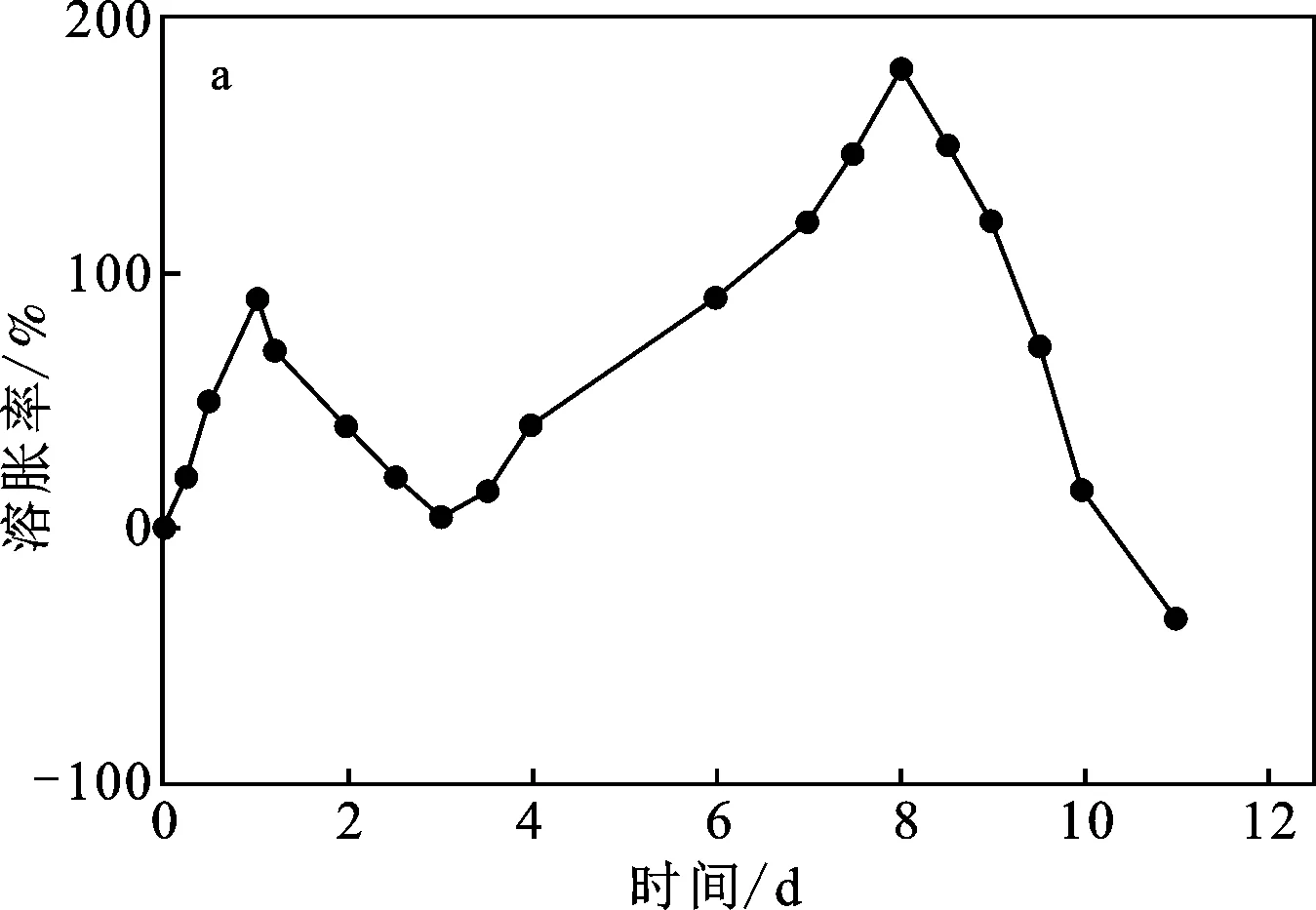
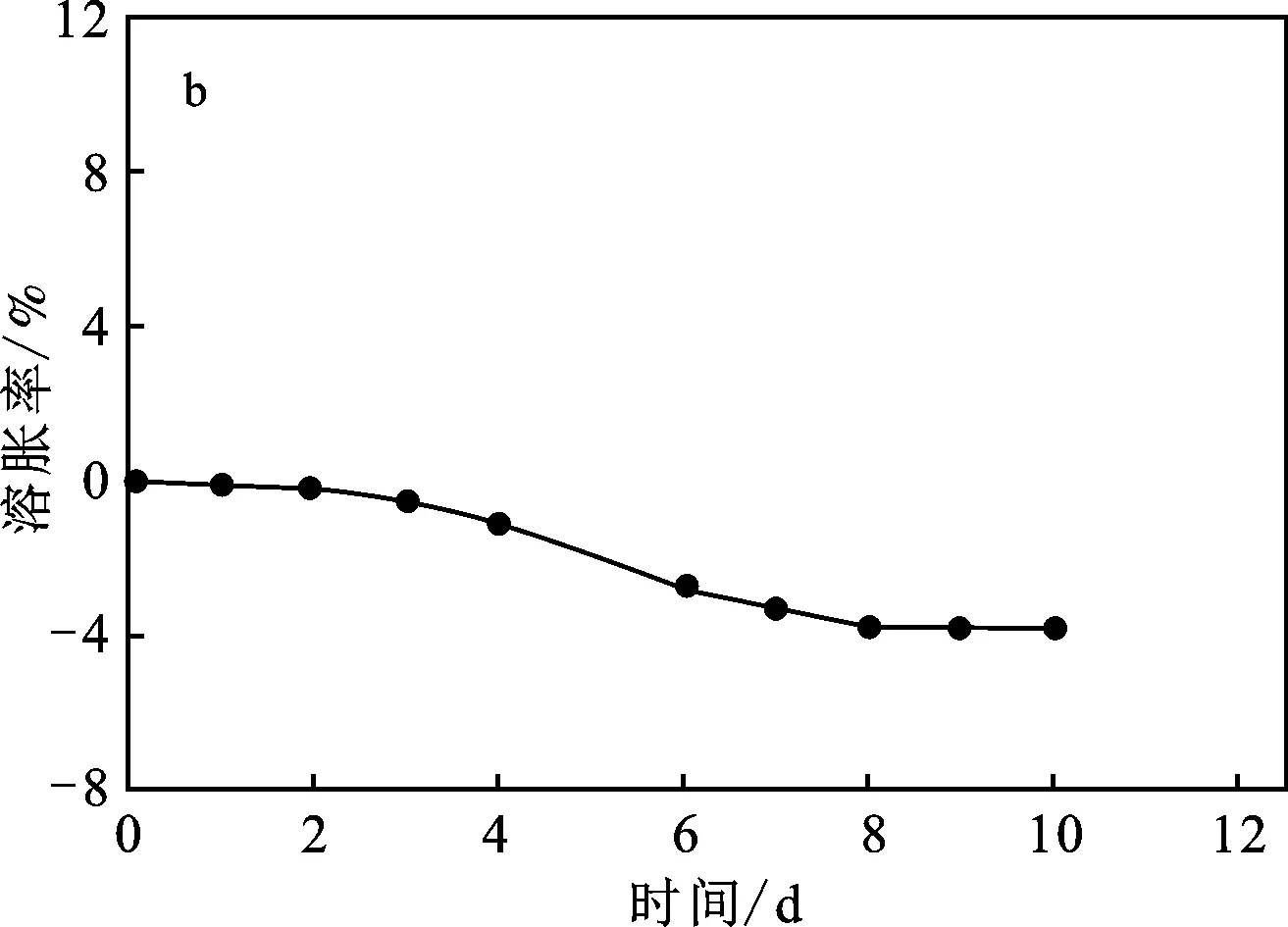
图8 在pH=7.4(a)和pH=2(b)条件下SA/CC-2-1h双膜水凝胶的溶胀/侵蚀行为Fig.8 Swelling/erosion behavior of the SA/CC-2-1h double-membrane hydrogel under pH 7.4 and pH 2.0 conditions
由图8可知,基于双膜水凝胶内外膜不同的结构特点,溶胀/侵蚀展现出两个不同的过程。pH=7.4时水凝胶的外层膜在第1 d吸水溶胀,然后溶胀率从第1 d~第3 d逐渐减少,这可归因于外膜水凝胶的逐渐侵蚀。在3 d后,外层全部被侵蚀,内层水凝胶吸水溶胀,溶胀率重新上升,持续5 d,在第8 d能达到180%的最高溶胀率。8 d后,双膜水凝胶中的内膜水凝胶开始侵蚀,故溶胀率第二次下降。而pH 2.0条件下双膜水凝胶的溶胀/侵蚀行为则不同,10 d后SA/CC-2-1h表现出很小的溶胀/侵蚀率,为-4%,表明了在酸性条件下海藻酸盐基水凝胶的收缩行为和结构稳定性。溶胀/侵蚀结果反映了SA/CC-2-1h双膜水凝胶在不同pH条件下的结构变化,这与复合药物释放行为基本一致。
基于单膜和双膜水凝胶的体外药物释放和溶胀行为的结果,可以提出由阳离子纤维素和阴离子SA制备的双膜水凝胶可能的复合药物释放模型,见图9。

图9 在pH=7.4下,双膜水凝胶的复合药物释放过程Fig.9 Complexing drug release process of double-membrane hydrogel at pH=7.4
由图9可知,在pH 7.4条件下,纯海藻酸盐的外膜经历溶胀,部分和完全瓦解,快速释放茶碱。对于内膜,存在刚性的阳离子纤维素链与阴离子海藻酸盐之间的静电相互作用,促进了内部水凝胶的结构稳定性。因此,在pH 7.4条件下,内膜经历比外膜更长的溶胀和瓦解过程,故内部水凝胶担载的药物可以实现缓慢释放。值得注意的是,作为药物传输系统的双膜水凝胶实现了复合药物释放,其中一种药物快速释放,另一种药物缓慢释放。
3 结论
制备出了海藻酸盐/纤维素双膜水凝胶,并作为一种新型复合药物载体。内膜中存在阳离子纤维素,可以通过其与阴离子海藻酸盐之间的静电相互作用增强水凝胶的结构稳定性。内外部水凝胶的不同组成和特性使得药物释放的效果不同,在复合药物的传输中,达到快速释放茶碱和持续缓慢释放牛血清白蛋白的目的。本研究中生物相容性水凝胶展现出特殊的双膜结构和复合药物控释行为,可以应用到口服给药等生物医学领域。
