Bcl2基因修饰骨髓间充质干细胞移植治疗脊髓损伤大鼠实验研究
2019-09-24姜福贵沈成华陈劲松蒋文昊
姜福贵, 李 俊, 沈成华, 陈劲松, 蒋文昊
黔东南州人民医院 创伤骨科,贵州 凯里 556000
脊髓损伤是中枢神经系统的严重创伤,常导致不可逆性的感觉及运动功能丧失[1]。目前,临床治疗采用手术治疗、药物治疗及基因治疗等,虽能使脊髓功能得到某种程度的恢复,但均无法有效解决患者截瘫这一难题[2]。随着神经生物学和干细胞技术的发展,细胞移植有望成为治疗脊髓损伤的有效方法[3]。骨髓间充质干细胞(bone marrow mesenchyml stem cells,BMSCs)具有自我更新能力及多向分化潜能,除能分化为基质细胞外,还能在体内外分化为神经元和神经胶质细胞[4-5]。BMSCs移植治疗脊髓损伤具有很好的疗效,而移植后BMSCs的存活是细胞移植治疗发挥作用的关键[6]。Bcl-2是调节细胞凋亡的关键基因,能对抗多种因素造成的细胞凋亡[7]。有研究发现,Bcl-2基因转染可提高BMSCs在恶性环境中的耐受力,提升其存活率[8]。本研究将Bcl-2修饰的BMSCs通过静脉注射的方式移植入脊髓损伤大鼠体内,通过体内外实验探究该治疗方式的疗效及相应作用机制,旨在为临床采用BMSCs移植治疗脊髓损伤提供理论参考。现报道如下
1 材料与方法
1.1 实验动物与试剂 健康成年雌性大鼠150只,平均体质量为(220±20)g,由北京维通利华实验动物技术有限公司提供,动物许可证号SCXK(京)2017-0022。乙醚(东莞市亿鑫化工有限公司),α-MEM培养基(美国GIBCO公司),胎牛血清(上海素尔生物科技有限公司),胰蛋白酶(上海雅心生物技术有限公司),细胞培养皿(美国Corning公司),原位末端标记法(TdT-mediated dUTP Nick-End Labeling,TUNEL)检测试剂盒(美国R&D公司)。
1.2 研究方法
1.2.1 实验模型建立与分组 建立脊髓损伤大鼠模型。麻醉大鼠,以胸10椎体为中心做约4 cm的纵向切口,充分显露胸10棘突,棘突上放置一圆形薄塑料垫片,在Allen′s装置上安装10 g重锤,启动装置使重锤自由下落,撞击垫片造成脊椎冲伤[9]。造模后,运动功能评分(basso beattie bresnahan,BBB)<8分即为造模成功。造模成功108只,随机分模型组、BMSCs组、BMSCs+Bcl2组,每组36只,另选取36只正常大鼠作为对照组。
1.2.2 BMSCs的分离、培养和传代 取成年清洁级SD大鼠,利用DEME冲洗股骨髓腔,并加入Ficoll-Paque分离液离心得到骨髓单个核细胞。CD抗原测定结果显示CD44、CD90呈阳性,CD14、CD34呈阴性,证实培养的细胞具备BMSCs的生物学特性。继续传代培养以备后续实验采用。
1.2.3 Bcl2转染BMSCs及BMSCs细胞移植 取对数期BMSCs细胞,向其中加入含Ad-EGFP-Bcl-2或Ad-EGFP的病毒液转染BMSCs,利用倒置荧光显微镜观察转染后绿色荧光蛋白(green fluorescent protein,GFP)表达情况。实验模型建立3 d后进行BMSCs细胞移植,BMSCs组及BMSCs+Bcl2组大鼠24 h后经尾静脉分别注射3×103个/μl BMSCs和Bcl2基因转染的BMSCs悬浮液1 ml。对照组及模型组大鼠尾静脉注入等量生理盐水。在BMSCs移植后的12周后,处死大鼠,取出损伤部位脊髓,制成组织切片,HE染色后观察组织切片。
1.3 观察指标 采用BBB评分分别于建模前3d及移植术后1、2、4、6、8、12周对各组大鼠进行大鼠后肢运动功能评分,其中后肢无运动功能为0分,后肢运动功能完全正常为21分。在移植术后14 d,选取各组大鼠脊髓损伤节段采用TUNEL法检测细胞凋亡,细胞核或细胞质中出现棕黄色颗粒为阳性。在高倍镜下选取5个100 mm3区域,计阳性细胞数取平均值。在细胞移植术后1、2、3周,采用免疫印迹法检测Bcl-2、神经丝蛋白200(neurofilament 200,NF-200)及胶质纤维酸性蛋白(glial fibrous acidic protein,GFAP)表达水平。以β-actin为内参蛋白,计算Bcl-2、NF-200及GFAP蛋白相对表达量。
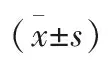
2 结果
2.1 大鼠BMSCs感染及移植结果 细胞转染4 d时GFP的表达最理想,可见大量绿色荧光。随后对脊髓损伤大鼠进行细胞移植,发现BMSCs组大鼠、Bcl2+BMSCs组大鼠脊髓损伤部位可见大量绿色荧光。见图1。

图1各组细胞荧光成像图片(HE×100,a.BMSCs组细胞转染后4 d;b.细胞移植1周后白光下脊髓损伤部位切片;c.细胞移植1周后绿色荧光聚集在脊髓损伤部位,BMSCs向损伤部迁移)
2.2 4组大鼠Bcl-2蛋白相对表达量比较 在细胞移植术后1、2、4周后,模型组和DMSCs组Bcl-2蛋白相对表达量较低,而Bcl2+BMSCs组Bcl-2蛋白相对表达量呈持续较高水平,显著高于同时段的对照组、模型组及DMSCs组,差异均有统计学意义(P<0.05)。见图2。
2.3 脊髓组织切片TUNEL染色情况 模型组阳性细胞数为(18.68±3.74)个,显著高于对照组的(6.85±2.03)个;BMSCs组及Bcl2+BMSCs组阳性细胞数分别为(13.56±2.48)个和(9.31±2.74)个,显著低于模型组;Bcl2+BMSCs组显著低于BMSCs组,差异均有统计学意义(P<0.05)。
2.4 4组大鼠脊髓组织细胞 NF-200及GFAP蛋白阳性面积比例移植治疗后,模型组NF-200阳性面积比例为(14.66%±2.03%),低于对照组的(49.36%±4.56%),GFAP阳性面积比例为(16.87%±2.03%),高于对照组的(4.02%±0.16%);Bcl2+BMSCs组NF-200阳性面积比例为(34.54%±3.65%),高于模型组及DMSCs组的(21.32%±2.34%),GFAP阳性面积比例为(6.01%±1.02%),低于模型组及DMSCs组的(9.86%±2.14%),差异均有统计学意义(P<0.05)。见图3。
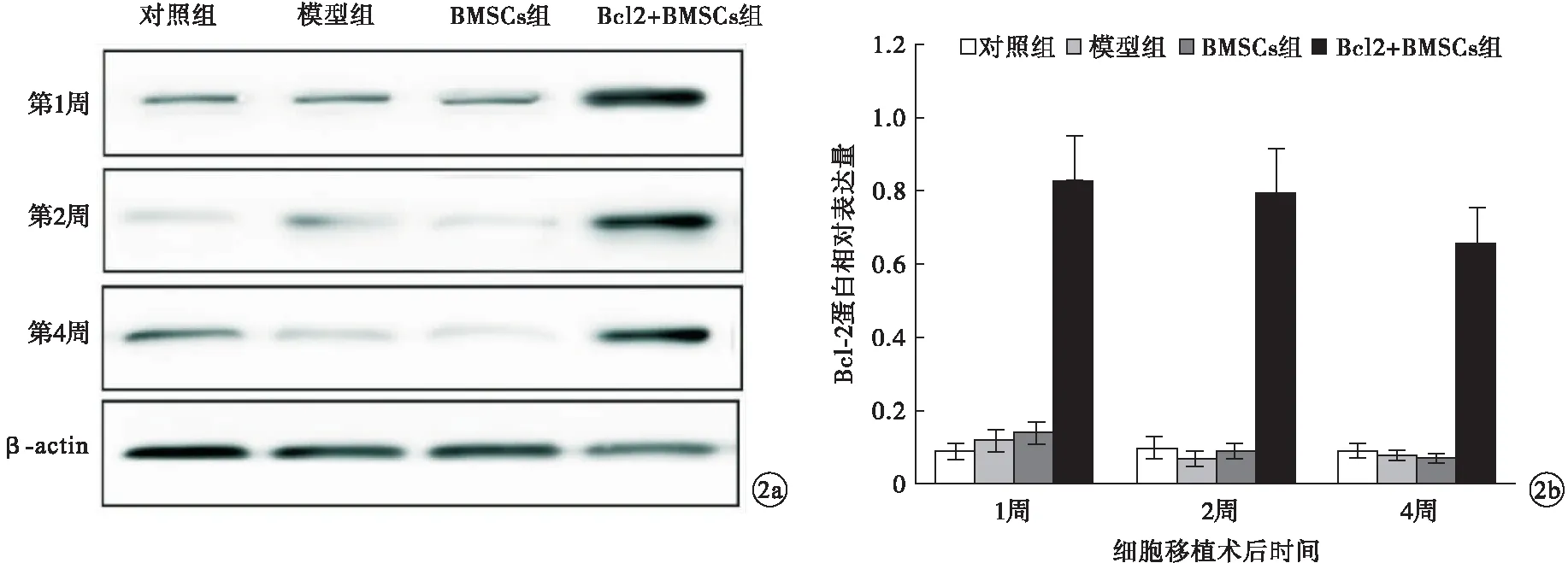
图2 4组大鼠Bcl-2蛋白相对表达量
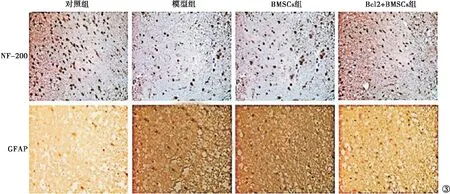
图3 4组大鼠NF-200及GFAP蛋白阳性面积比(TUNEL染色×100)
2.5 大鼠后肢运动功能评价 移植治疗4、6、8、12周后,BMSCs组及Bcl2+BMSCs组大鼠运动功能评分均显著高于模型组,且Bcl2+BMSCs组显著高于BMSCs组,差异均有统计学意义(P<0.05)。见表1。

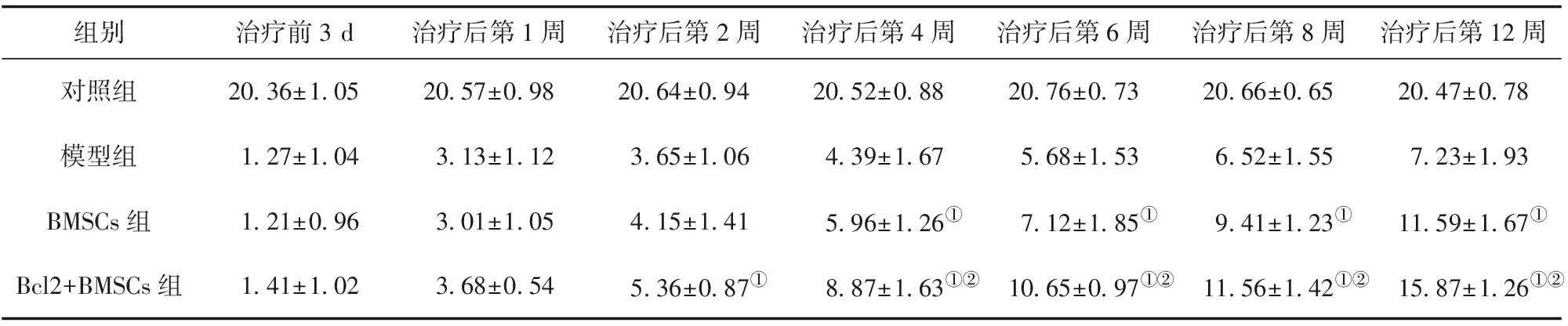
组别治疗前3 d治疗后第1周治疗后第2周治疗后第4周治疗后第6周治疗后第8周治疗后第12周对照组20.36±1.0520.57±0.9820.64±0.9420.52±0.8820.76±0.7320.66±0.6520.47±0.78模型组1.27±1.043.13±1.123.65±1.064.39±1.675.68±1.536.52±1.557.23±1.93BMSCs组1.21±0.963.01±1.054.15±1.415.96±1.26①7.12±1.85①9.41±1.23①11.59±1.67①Bcl2+BMSCs组1.41±1.023.68±0.545.36±0.87①8.87±1.63①②10.65±0.97①②11.56±1.42①②15.87±1.26①②
注:与模型组比较,①P<0.05;与BMSCs组比较,②P<0.05
3 讨论
BMSCs细胞移植为临床治疗脊髓损伤提供了新途径,防止BMSCs细胞凋亡是移植治疗成功的关键,而Bcl2修饰可明显提升BMSCs移植细胞的存活率[10]。本研究发现,Bcl2+BMSCs组大鼠细胞凋亡数显著低于模型组和BMSCs组,脊髓组织及脊髓神经细胞状态明显优于模型组和BMSCs组,其BBB评分也显著高于模型组和BMSCs组,证实Bcl2修饰的BMSCs治疗脊髓损伤大鼠能显著抑制大鼠神经细胞凋亡,促进损伤神经功能恢复,具有很好的治疗效果。
本研究采用GFP对BMSCs修饰,在显微镜下可观察到大量绿色荧光,随后将修饰后的BMSCs移植入脊髓损伤大鼠体内,1周后在大鼠脊髓损伤部位观察到大量绿色荧光,说明移植后BMSCs能有效向损伤部位迁移。细胞移植1、2、4周后,Bcl2+BMSCs组Bcl-2蛋白相对表达量明显高于其他组。Bcl-2对抗多种原因引起的细胞凋亡,被认为是能够抑制细胞凋亡的“抗凋亡基因”[11]。本研究中,TUNEL染色实验发现,在治疗14 d后,Bcl2+BMSCs组阳性细胞数显著低于模型组及BMSCs组,提示Bcl2+BMSCs细胞移植治疗脊髓损伤能通过提升大鼠损伤部位Bcl2表达量来抑制BMSCs细胞凋亡。有研究发现,Bcl2基因修饰神经干细胞移植可促进脊髓损伤大鼠神经突触的再生,提升脊髓损伤区Bcl2基因表达和降低神经细胞凋亡,与本研究结果一致[12]。
NF-200是构成神经元胞体和轴突细胞骨架的主要成分,脊髓损伤后NF-200阳性神经元数量及神经元胞体着色程度和后肢功能恢复密切相关[13]。BMSCs本身不表达NF-200,只有分化为神经元样细胞时才能表达NF-200,且NF-200染色程度可直接反映已分化的神经细胞的功能状态[14]。本研究结果显示,BMSCs组NF-200阳性面积比例显著高于模型组,提示单纯的BMSCs移植治疗能促进神经功能的恢复,BMSCs在脊髓损伤的微环境下可分化为神经元样细胞,NF-200阳性面积增加。此外,Bcl2+BMSCs组NF-200阳性面积比例显著高于模型组和BMSCs组,同时结合BBB评分可知Bcl2修饰的BMSCs能更好的修复脊髓损伤,促进大鼠神经功能恢复。
GFAP是构成神经胶质细胞的骨架蛋白,主要发挥促进细胞突起延长、维持胶质细胞基本形态的作用,机体发生脊髓损伤后,其合成和分泌量均显著增加,GFAP的含量可以反映星形胶质细胞的功能状态[15-16]。本研究发现,Bcl2+BMSCs组GFAP阳性面积比例最高,证实脊髓损伤后大鼠体内GFAP表达量提升。此外,Bcl2+BMSCs组GFAP阳性面积比例低于模型组及DMSCs组,提示Bcl2基因修饰BMSCs移植治疗脊髓损伤能显著抑制大鼠脊髓损伤部位GFAP表达量,从而更好的促进轴突再生。其原因可能为Bcl2基因能有效抑制BMSCs细胞发生凋亡,从而促进BMSCs分化成为神经元细胞,分化的神经元细胞能大量分泌神经营养因子并且提供神经修复的骨架结构,从而有效抑制神经胶质细胞增生和GFAP表达,促进神经功能恢复。
综上所述,Bcl2基因修饰BMSCs移植治疗脊髓损伤大鼠能通过提升损伤部位Bcl2表达量抑制脊髓细胞发生凋亡,从而促进脊髓损伤大鼠神经功能恢复。
