HPLC法同时测定刺玫果提取物中的黄酮类成分及其体外活性测定
2019-09-24钟方丽张晓丽王晓林雷永平
邸 松 钟方丽 张晓丽,2 王晓林 雷永平
(1. 吉林化工学院,吉林 吉林 132022;2. 吉林大学,吉林 长春 130012)
刺玫果为野生山刺玫的成熟果实,又名花伞蔷薇,广泛分布于东北、内蒙等地[1]。其果实呈卵型或球型,香甜气息浓郁,酸甜可食[2]。刺玫果含丰富的黄酮类、三萜类、皂苷、挥发油及氨基酸等成分,营养价值极高[3-4]。因其具有抗衰老、预防心脑血管疾病作用,且抗氧化与治疗高血脂效果显著,近年来以刺玫果为主要原料的保健食品的开发受到了广泛的重视[5]。
在刺玫果提取物黄酮类成分研究的报道中,采用HPLC法定性、定量黄酮类成分的研究较多,其中有同时测定芦丁、金丝桃苷与槲皮素[6],木犀草素与金丝桃苷[7],槲皮素和山奈酚[8]的报道。但尚未见同时测定刺玫果提取物中金丝桃苷、芦丁、槲皮素及木犀草素的报道。有关黄酮类成分体外活性的研究,大多都是总黄酮提取物、或经过纯化的总黄酮提取物进行体外活性研究。例如:通过测定DPPH自由基清除率[9]、ABTS自由基阳离子清除率[10]、羟基自由基清除率[11]以及抗脂质过氧化作用[12]来评价其抗氧化活性;通过测定清除亚硝酸盐活性、阻断亚硝胺合成能力评价其抗癌活性[13];通过测定抑制α-糖苷酶活性,评价供试品的降血糖活性[14]。这类试验只表明了黄酮类成分协同作用的体外活性,未对其黄酮类单体成分及其单体复方配伍活性进行评价。同时也未有对刺玫果提取物中所含的黄酮类成分单体及单体复方配伍的活性研究。
试验拟使用HPLC法,建立同时测定刺玫果提取物中4种黄酮类单体成分的方法,并分析对比各成分及单体对应复方配伍的体外活性,以期为刺玫果提取物的开发利用提供依据。
1 材料与方法
1.1 试剂与仪器
1.1.1 材料与试剂
刺玫果:安徽亳州医药材料总公司,由吉林化工学院药学系薛健飞博士鉴定为成熟果实;
木犀草素、芦丁、金丝桃苷、槲皮素对照品:纯度≥98.5%,成都曼思特生物科技有限公司;
乙腈、甲醇:HPLC级,天津市大茂化学试剂厂;
α-糖苷酶(酶活≥34 U/mg)、PNPG:生物试剂,上海生物科技有限公司;
其他试剂均为国产分析纯。
1.1.2 主要仪器设备
高效液相色谱仪:Agilent-1260型,搭载DAD阵列检测器,安捷伦科技有限公司;
紫外分光光度计:TU-1810型,北京普析通用仪器有限公司;
酶标仪:PL-9602型,北京普朗新科技有限公司。
1.2 方法
1.2.1 溶液配制
(1) 供试品溶液的制备:参考杨扬等[15]对刺玫果总黄酮的提取纯化工艺制备刺玫果提取物,采用乙醇热回流法提取刺玫果总黄酮,使用D-101大孔树脂对提取的刺玫果总黄酮进行纯化,得到刺玫果提取物。精密称取刺玫果提取物0.5 g,置于25 mL容量瓶中,加入60%乙醇水溶液15 mL,超声处理30 min使其完全溶解后定容,过滤,取滤液5 mL置于10 mL容量瓶中定容,采用0.45 μm 滤膜过滤,即得供试品溶液。
(2) 对照品溶液的制备:精密称取金丝桃苷对照品4.2 mg、芦丁、木犀草素、槲皮素对照品各4.1 mg,分别置于10 mL容量瓶中,加入甲醇溶解并定容,精密吸取上述各对照品溶液2.5 mL于25 mL容量瓶中并定容,得混合对照品溶液,放置在冰箱(4 ℃)内避光保存备用。
1.2.2 刺玫果提取物中4种黄酮类单体成分的含量测定
(1) 色谱条件及流动相考察:使用紫外分光光度计,在200~600 nm对芦丁、金丝桃苷、槲皮素及木犀草素的甲醇溶液进行全波长扫描,对比扫描图谱,选择4种黄酮类单体成分均具有较大吸收的波长作为检测波长。使用依利特ODS2C18色谱柱,柱温35 ℃,进样量20 μL。分别考察乙腈—0.1%磷酸水溶液、甲醇—0.1%磷酸水溶液、乙腈—甲醇—0.1%磷酸水溶液等度洗脱系统及梯度洗脱系统。根据理论塔板数、分离度、保留时间及峰型因素,从中优选出流动相。
(2) 线性关系的考察:精密吸取混合对照品溶液0.5,1.0,2.0,3.0,4.0,5.0 mL置于10 mL容量瓶中,定容,在色谱条件下进样20 μL,测定峰面积,以进样浓度为横坐标,峰面积为纵坐标,进行线性回归。
(3) 方法学考察:① 精密吸取同一混合对照品溶液,在色谱条件下连续进样6次,分别记录4种黄酮类单体成分的峰面积,并计算RSD值。精密吸取供试品溶液20 μL,进样6次,分别记录4种黄酮类单体成分的峰面积,计算RSD值,考察仪器精密度。② 取同一批刺玫果提取物,按照供试品溶液制备方法进行溶液制备。按照色谱条件进样6次,分别记录4种黄酮类单体成分的峰面积,并计算RSD值。③ 吸取同一供试品溶液,分别在0,6,12,24,36,48 h进样,分别记录4种黄酮类单体成分峰面积,计算RSD值。
(4) 加样回收率试验及含量测定:称取6份已知含量的刺玫果提取物,每份0.5 g,精密称定。每份中分别加入金丝桃苷305 μg、芦丁225 μg、槲皮素94 μg、木犀草素6 μg,按照供试品溶液制备方法进行制备。在1.2.2(1)所选择的色谱条件下分别进样20 μL,计算回收率。称取0.5 g 刺玫果提取物,按供试品溶液配制方法配制供试品溶液,平行进样3次,记录4种黄酮类单体成分峰面积,将平均值代入线性关系计算刺玫果提取物中4种黄酮类单体成分含量。
1.2.3 体外活性测定 根据含量测定结果,配制4种黄酮单体成分的复方配伍,并对刺玫果提取物、4种黄酮单体及其复方配伍进行清除自由基、清除亚硝酸盐、阻断亚硝胺合成、抑制α-糖苷酶活性的测试。
(1) 清除DPPH自由基清除试验:参照文献[16]进行调整。吸取0.1 mg/mL DPPH自由基溶液17 mL于25 mL 容量瓶中,加入无水乙醇定容,制备DPPH自由基溶液。吸取2 mL不同质量浓度的各种供试品溶液(VC溶液、刺玫果提取物溶液、4种黄酮类单体成分及复方配伍溶液)与DPPH自由基溶液,混合,混合液在室温下避光反应30 min,在517 nm下测定吸光度A样品,按式(1)计算自由基清除率,并计算IC50值。
(1)
式中:
RDPPH——DPPH自由基清除率,%;
Ak——2 mL无水乙醇与2 mL DPPH自由基溶液混合的吸光度;
Ad——2 mL供试品溶液与2 mL无水乙醇混合的吸光度。
(2) ABTS自由基阳离子清除试验:参考文献[17]配制ABTS自由基阳离子工作液。取0.1 mL不同质量浓度的各种供试品溶液与3.9 mL ABTS自由基阳离子工作液混合,23 ℃避光放置6 min,与734 nm测定吸光度,每份样品平行操作2次,按式(2)计算自由基清除率,并计算IC50值。通过对比IC50,比较VC、刺玫果提取物、4种黄酮类单体成分及复方配伍体外抗氧化活性。
(2)
式中:
RABTS——ABTS自由基阳离子清除率,%;
Ak——0.1 mL水与3.9 mL ABTS自由基阳离子混合吸光度;
Ay——0.1 mL供试品与3.9 mL ABTS自由基阳离子混合吸光度。
(3) 抗脂质过氧化试验:以抑制率为指标,参照文献[18]的试验方法,对VC、刺玫果提取物、4种黄酮类成分单体及复方配伍的抗卵磷脂脂质过氧化作用进行测试。在具塞试管中依次加入1 mL卵磷脂溶液,1 mL 0.4 mmol/L FeSO4溶液及1 mL供试品溶液混匀。于37 ℃ 避光水浴60 min,加入2 mL TCA-TBA-HCl混合液,90~100 ℃水浴15 min,迅速冷却,以5 000 r/min离心10 min,取上清液在波长535 nm处测定吸光度As。空白管以1 mL重蒸水代替1 mL供试品溶液测得Ac,按式(3)计算抗脂质过氧化抑制率。
(3)
式中:
RZ——抗脂质过氧化抑制率,%。
(4) 清除亚硝酸盐活性试验:采用盐酸萘乙二胺法[19]。在15 mL模拟胃液(pH=3.0)中加入2 mL供试品溶液混合,加入10 μg/mL的亚硝酸钠溶液2.5 mL,37 ℃ 恒温水浴反应30 min,取出后立即加入0.4%对氨基苯磺酸溶液0.5 mL,混匀,静置15 min后加入0.2%盐酸萘乙二胺溶液0.25 mL及蒸馏水7 mL,混合均匀,放置15 min。于538 nm处测定吸光度,按式(4)计算自由基清除率,并计算IC50值。
(4)
式中:
RQ——亚硝酸盐清除率,%;
Ai——加入供试品溶液的吸光度;
Aj——供试品溶液的吸光度;
A0——不加供试品溶液的对照组吸光度。
(5) 阻断亚硝胺合成活性试验:采用α-萘胺法[20]。取pH 3.0的柠檬酸—磷酸氢二钠缓冲溶液2.0 mL,加入2.0 mmol/L亚硝酸钠溶液、2.0 mmol/L二甲胺溶液各0.6 mL、各供试品溶液1.0 mL,混合均匀,加入1.5 mL蒸馏水,37 ℃水浴恒温反应1 h,用移液管吸取1.0 mL溶液加到直径7 cm的培养皿中,加入0.5%的碳酸钠溶液0.5 mL,在254 nm紫外灯下照射15 min,取出后分别加入1%对氨基苯磺酸溶液1.5 mL、0.1%α-萘胺溶液0.5 mL、蒸馏水0.5 mL,摇匀,放置15 min后,用紫外分光光度计在525 nm处分别测定吸光度值,通过式(5)计算阻断率。
(5)
式中:
RZD——亚硝胺合成阻断率,%;
A0——未加提取液的比色管中亚硝酸钠的吸光度;
Ax——加提取液的比色管中亚硝酸钠的吸光度。
(6) 抑制α-糖苷酶活性试验:根据赖小燕等[21]试验方法进行调整。在96孔板中加入80 μL磷酸盐缓冲液(pH=6.8)、20 μL 2.5 mmol/L的PNPG底物溶液以及20 μL各供试品溶液,37 ℃水浴10 min。加入20 μL 1.4 U/mLα-葡萄糖苷酶溶液反应60 min,用100 μL 0.2 mol/L 碳酸钠溶液终止反应,室温放置15 min,用酶标仪在405 nm处测定样品吸光度值,按式(6)计算抑制率,并计算IC50。
(6)
式中:
RM——α-糖苷酶活性抑制率,%;
Ak——20 μL磷酸盐缓冲液代替20 μL供试品溶液的吸光度;
Ab——20 μL磷酸盐缓冲液代替20 μLα-葡萄糖苷酶溶液的吸光度。
2 结果与讨论
2.1 刺玫果提取物中4种黄酮类单体成分含量的测定
2.1.1 色谱条件及流动相考察结果 根据紫外分光光度计全波长扫描结果,金丝桃苷、芦丁、槲皮素及木犀草素在204,256,360 nm均具有较大吸收。其中204 nm及256 nm处干扰因素较多,故选择360 nm作为检测波长。对比4种黄酮类单体成分在不同流动相下的分离度、理论塔板数及峰型,结果表明:使用甲醇—0.1%磷酸水作为流动相,金丝桃苷和芦丁相对应的峰重叠,无法分离;乙腈—0.1%磷酸水作为流动相金丝桃苷和芦丁的分离效果较差;最终确定采用乙腈(A)—甲醇(B)—0.1%磷酸水溶液(C)梯度洗脱,洗脱程序见表1。在色谱条件下分别进样混合对照品溶液及供试品溶液,混合对照品溶液和供试品溶液谱图见图1。
2.1.2 线性关系 以混合对照品中4种黄酮类成分质量浓度为横坐标,对应峰面积为纵坐标,绘制标准曲线,结果见表2。

表1 梯度洗脱程序Table 1 Flow phase gradient elution procedure
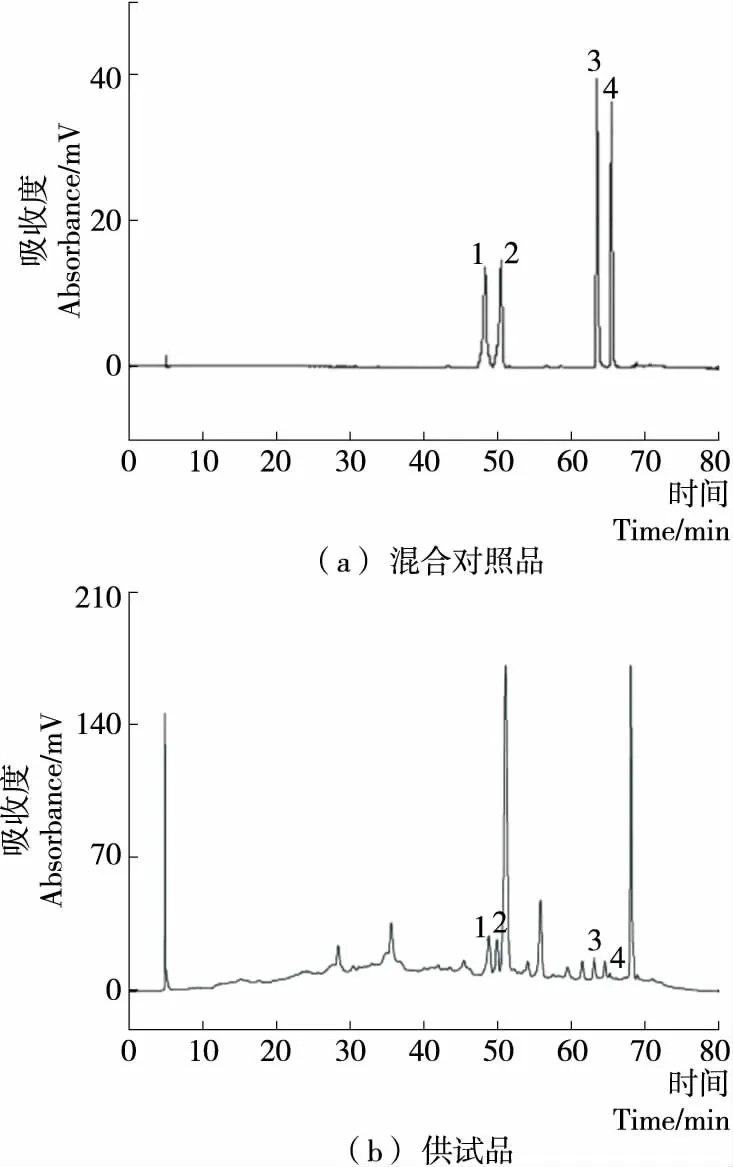
1. 金丝桃苷 2. 芦丁 3. 槲皮素 4. 木犀草素

标准品拟合方程拟合度R2线性范围/(μg·mL-1)金丝桃苷y=51.547x+25.3270.995 32.10~21.0芦丁 y=43.086x+78.2280.995 32.05~20.5槲皮素 y=90.719x+33.2640.999 92.05~20.5木犀草素y=68.102x+34.5851.000 02.05~20.5
表2显示,金丝桃苷在2.10~21.0 μg/mL,芦丁、槲皮素及木犀草素在2.05~20.5 μg/mL浓度范围内与峰面积线性关系良好。
2.1.3 方法学考察 仪器精密度,方法重复性及供试品溶液48 h内稳定性的RSD值均在3%以内,表明仪器精密度,方法重复性以及供试品溶液48 h内稳定性良好,试验结果见表3。

表3 方法学考察试验数据Table 3 Methodological experimental data (n=6) %
2.1.4 加样回收率及含量测定 4种黄酮类单体成分金丝桃苷、芦丁、槲皮素及木犀草素的平均加样回收率分别为98.02%,98.45%,99.15%,98.46%,RSD值分别为0.80%,1.92%,2.12%,2.89%。具体试验结果见表4。含量测定结果显示刺玫果提取物中金丝桃苷、芦丁、槲皮素及木犀草素的含量分别为607.98,450.63,187.32,12.68 μg/g,结果见表5。
2.2 体外活性测试
2.2.1 DPPH自由基清除试验 从图2可以看出,刺玫果提取物、4种黄酮类成分及复方配伍(金丝桃苷、芦丁、槲皮素及木犀草素按质量比为47.9∶35.5∶14.8∶1.0进行混合得到4种黄酮类成分单体复方配伍)均具有一定的清除DPPH自由基活性。其中刺玫果提取物、芦丁、木犀草素及复方配伍的活性弱于VC,槲皮素及金丝桃苷活性强于VC。刺玫果提取物清除DPPH自由基的活性较阳性对照Vc虽然较弱,但是IC50较为接近,与孟永梅等对刺玫果提取液清除DPPH自由基活性的研究结果相当[22],但弱于黄刺玫乙酸乙酯层萃取物[23]。
2.2.2 ABTS自由基阳离子清除试验 从图3可以看出,各样品均具有较强的清除ABTS+.的活性。其中槲皮素的清除能力最强,IC50值为29.5 μg/mL;复方配伍的清除能力最弱,对应IC50值为196.2 μg/mL。槲皮素为五羟黄酮,其2、3位有双键,3、7位有两个羟基,可通过单电子转移直接清除自由基[24],所以具有极强的抗氧化活性。但由于刺玫果提取物中所含有的槲皮素较少,所以刺玫果提取物的抗氧化能力弱于槲皮素。
2.2.3 抗脂质过氧化试验 从图4可以看出,槲皮素具有较强的抗脂质过氧化作用,其活性强于VC,其IC50值为0.058 2 mg/mL。其他成分抗脂质过氧化作用由强到弱的顺序为金丝桃苷、木犀草素、刺玫果提取物、芦丁及复方配伍。复方配伍组活性相较于刺玫果提取物明显降低,说明刺玫果提取物中应该含有其他具有较高体外活性的成分,由于天然产物结构中的酚羟基易被氧化成醌,从而具有较高体外抗氧化的活性,综合分析认为刺玫果提取物中应该含有一定量的多酚类成分。

表4 加样回收率结果Table 4 Result of recovery tests
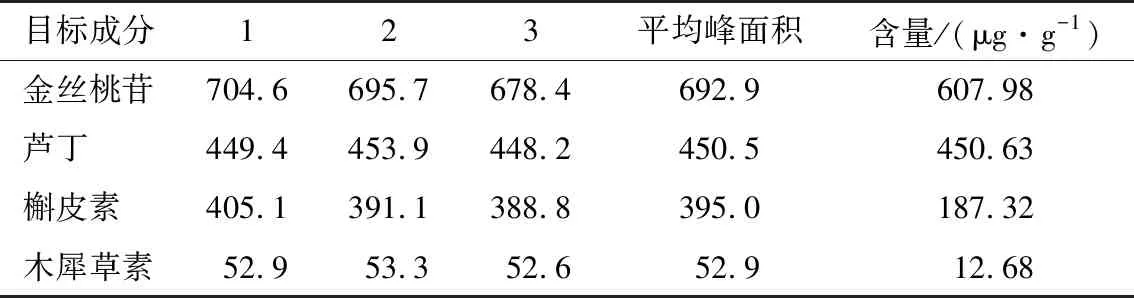
表5 样品测定结果Table 5 Results of samples determination
2.2.4 清除亚硝酸盐及阻断亚硝胺合成活性试验 在体外模拟胃液条件下,分别考察了刺玫果提取物、4种黄酮类单体及复方配伍的清除亚硝酸盐活性和阻断亚硝胺合成活性,试验结果分别见表6、7。
从试验结果可以看出,刺玫果提取物、4种黄酮类成分单体及复方配伍,均具有一定的清除亚硝酸盐及阻断亚硝胺合成活性。其中木犀草素清除亚硝酸盐的活性最强,强于VC的清除活性;复方配伍阻断亚硝胺合成活性为样品中最好的,但弱于VC。刺玫果提取物能有效阻断亚硝胺合成,其活性略低于复方配伍,而复方配伍的活性强于各单体本身,说明配伍后可能存在协同增效作用。
2.2.5α-糖苷酶抑制活性试验 从表5中可以看出,刺玫果提取物、槲皮素及木犀草素的抑制活性优于阿卡波糖,且槲皮素的抑制活性最强;芦丁、金丝桃苷及复方配伍活性低于阿卡波糖,但也具有一定的抑制活性。虽然刺玫果提取物具有较强的体外降血糖活性,且活性强于桑叶总黄酮[25]。槲皮素对α-糖苷酶抑制活性,但刺玫果提取物中槲皮素的含量较低,所以刺玫果提取物中的降糖活性成分及机理还有待进一步研究。
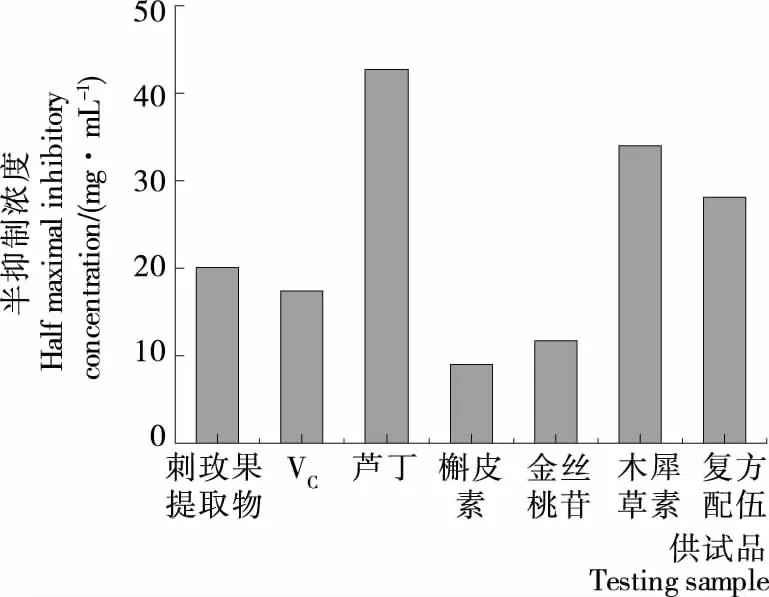
图2 样品对DPPH·清除能力半抑制浓度比较
Figure 2IC50comparisons among clearance rate of DPPH· for the tested sample

图3 样品对ABTS+·清除能力半抑浓度比较
Figure 3IC50comparisons among clearance rate of ABTS+· for the tested sample

图4 各成分抗脂质过氧化作用半抑制浓度比较
Figure 4IC50comparisons among clearance rate of anti-liposome peroxidation effect for the tested sample

表6 清除亚硝酸盐试验结果Table 6 Results of sodium nitrite removal test
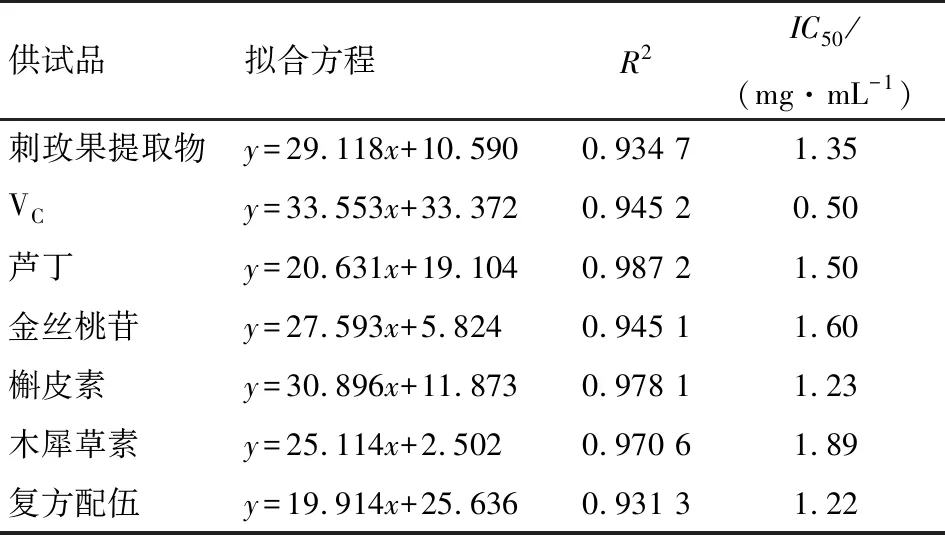
表7 阻断亚硝胺试验结果Table 7 Test results of blocking nitrosamine

表8 抑制α-葡萄糖苷酶试验结果Table 8 Results of inhibiting enzyme activity of α-glucosidase
3 结论
研究建立了HPLC同时测定刺玫果提取物中4种黄酮类成分单体含量的方法,采用该方法测定的刺玫果提取物中金丝桃苷、芦丁、槲皮素及木犀草素的含量分别为607.98,450.63,187.32,12.68 μg/g,研究结果表明建立的高效液相色谱含量测定方法具有良好的精密度,线性关系良好,结果准确可靠,可用于刺玫果提取物中黄酮类成分的含量测定。
大量研究[26-27]证实刺玫果提取物具有较好的体外活性,但均未对提取物与其中的黄酮单体及单体复方配伍的体外活性进行对比研究。体外试验结果表明刺玫果提取物具有较好的体外抗氧化和降糖活性,在天然抗氧剂、降血糖以及保健食品的开发与应用方面具有广阔的发展前景。刺玫果提取物能有效地清除亚硝酸盐,具有较好的阻断亚硝酸盐合成活性,可有效预防致癌、致畸及智力迟钝的发生[28]。刺玫果提取物有中含有较多的活性成分,试验只对其中的4种黄酮类化合物进行了定量分析,尚未对其做进一步的化学成分分离,其主要活性成分有待于进一步研究。
