七氟醚后处理对失血性休克复苏大鼠海马氧化应激及SIRT1/PGC-1α表达的影响
2019-09-24王妍妍黄春霞朱守峰杨青青胡宪文
王妍妍,张 丽,黄春霞,朱守峰,杨青青,胡宪文
(安徽医科大学第二附属医院麻醉与围术期医学科,安徽 合肥 230601)
失血性休克是临床常见的危重症之一,再灌注策略是治疗失血性休克的基本方法,但液体复苏的同时可能会加重缺血组织的功能障碍,诱发缺血/再灌注损伤。脑组织,尤其是海马组织,对缺血缺氧更加敏感,也更易发生缺血/再灌注损伤,而氧化应激是脑缺血/再灌注损伤发生、发展过程中重要的一环[1]。
七氟醚是一种挥发性吸入全身麻醉药物,我们前期的研究表明,七氟醚后处理可通过减轻海马CA1区胆碱能神经元损伤,从而改善缺血/再灌注大鼠空间学习与记忆能力[2]。然而,七氟醚后处理对失血性休克复苏大鼠海马氧化应激的影响尚未可知。有研究表明,上调沉默信息调节因子1 (silent information regulation 1,SIRT1)和过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)蛋白的表达,可减轻氧化应激反应和线粒体功能障碍[3]。本实验拟研究七氟醚后处理对失血性休克复苏大鼠海马氧化应激及抗氧化应激相关蛋白SIRT1和PGC-1α表达的影响,以探讨七氟醚后处理发挥脑保护作用的初步分子机制,为临床预防和治疗脑缺血/再灌注损伤提供新的思路和实验依据。
1 材料与方法
1.1 材料
1.1.1实验动物 健康成年♂ SD大鼠,清洁级,体质量(300~350) g,由安徽医科大学动物实验中心提供,动物合格证号:SCXK(皖)2005-001。自由进食饮水,保持动物房内温度(20~25) ℃,湿度50%~55%,黑暗和光照各12 h。
1.1.2试剂 七氟醚(货号:83291),购自艾伯维公司;线粒体提取试剂盒(货号:GMS10006.2),购自美国GENMED公司;超氧化物歧化酶(superoxide dismutase,SOD)活性测定试剂盒(货号:A001-3),购自南京建成生物工程研究所;丙二醛(malonaldehyde,MDA)检测试剂盒(货号:S0131)、RIPA裂解液(货号:P0013B)、BCA蛋白浓度测定试剂盒(货号:P0012),购自碧云天生物技术有限公司;β-actin单克隆抗体(货号:66009-I-Ig)、PGC-1α单克隆抗体(货号:66369-I-Ig),均购自Proteintech公司;SIRT1单克隆抗体(货号:9475S),购自美国Cell Signaling Technology公司;ECL显影液(货号:34095),购自美国Thermo Fisher Scientific公司。
1.1.3仪器 双向全自动输液泵(美国Genie Touch公司);生物机能系统(上海奥尔科特生物科技有限公司);气体监测仪(深圳迈瑞生物医疗电子股份有限公司);七氟醚挥发罐(Grager公司);多功能酶标仪(美国Thermo Fisher Scientific公司);凝胶成像系统(上海天能科技有限公司)。
1.2 方法
1.2.1动物分组 将大鼠按随机数据表法分为3组(每组12只):假手术组(Sham 组)、失血性休克复苏组(Shock组)、七氟醚后处理组(Sevo 组)。
1.2.2大鼠失血性休克复苏模型的制备 模型制备前,大鼠适应性喂养7 d,术前禁食8~12 h,可自由饮水。称重后,腹腔注射3%戊巴比妥钠(50 mg·kg-1)麻醉,仰卧位固定于实验台,经口气管内插管,保持自主呼吸。消毒后,取颈正中切口,分离出右颈总动脉和左颈静脉后,分别向近心端置入PE50管,连接三通后连接生物机能系统,监测平均动脉压(mean arterial pressure,MAP)。通过颈静脉输注肝素500 U·kg-1,观察10 min后,利用双向全自动输液泵经右颈总动脉持续匀速抽血30 min,抽出的血液存储于无菌10 mL注射器中,抽血量为大鼠总血容量的40%。抽血结束后1 h,于30 min内经左颈静脉回输全部抽血量,建立失血性休克复苏模型。Sham组动静脉置管等手术操作同Shock组,但不放血。
1.2.3七氟醚后处理 参照文献[4]介绍的方法实施七氟醚后处理。将即将接受血液回输的大鼠置于自制半密闭有机玻璃容器(30 cm×20 cm×20 cm)内,容器相对的两面各留一直径约2 cm的圆孔,分别作为进气孔和出气孔。出气孔接呼气末麻醉药浓度监测仪,持续监测七氟醚、O2及CO2的浓度。容器底部铺上适量钠石灰,利用(95% O2,5% CO2)混合气体带动七氟醚通过进气孔进入有机玻璃容器内,调节七氟醚挥发罐,使七氟醚呼气末浓度达到2.4%,并维持30 min。Sham组和Shock组在相应时间点被放入容器内,吸入95% O2,5% CO2混合气30 min。
1.2.4MAP的监测 监测并记录放血即刻(T0)、放血结束即刻(T1)、血液回输即刻(T2)和血液回输结束即刻(T3)三组的MAP。
1.2.5血气分析 在上述T0、T1、T2、T3时间点,取0.2 mL动脉血进行血气分析,记录血pH值、碱剩余(base excess,BE)和乳酸(Lac)浓度。从动脉抽取0.2 mL血的同时,经静脉输注0.2 mL生理盐水,以作补充。
1.2.6海马线粒体的提取 自体血回输24 h后,各组随机选取6只大鼠,按50 mg·kg-1剂量腹腔注射3%戊巴比妥钠,迅速断头取脑,分离出海马组织。称重后剪碎,加入按照线粒体分离试剂盒说明书配制的海马线粒体裂解液,研磨后,将混合物置于1.5 mL EP管中,4 ℃、1 500×g离心10 min后取上清,10 000×g离心10 min,弃上清,所得沉淀即为线粒体,加入储存液,重悬混匀后,置于4 ℃冰上待用。
1.2.7海马线粒体SOD活性检测 取上述提取的海马线粒体,利用BCA试剂盒测定线粒体蛋白浓度后,根据SOD测定试剂盒说明书,依次加样对照孔、对照空白孔、测定孔、测定空白孔,37 ℃孵育20 min,测定各孔在450 nm处的吸光度,再根据相应公式计算出相应线粒体样品的SOD活性。
1.2.8海马组织MDA含量测定 自体血回输结束24 h后,取各组剩余的6只大鼠的海马组织,保存于-80 ℃冰箱备用。将适量海马组织剪碎后,置于玻璃匀浆器中,加入RIPA裂解液,研磨充分后冰浴30 min;混合物4 ℃、13 200 r·min-1离心30 min后,取上清。留部分上清做BCA蛋白定量,剩下部分上清液依据MDA检测试剂盒说明书,基于MDA和硫代巴比妥酸反应产生红色产物的显色反应,通过比色法,用酶标仪分别测定不同浓度标准品和各样品在532 nm的吸光度,计算各样品中的MDA含量。
1.2.9Western blot法检测SIRT1和PGC-1α蛋白的表达 取上述提取的剩余各组海马组织蛋白,加入上样缓冲液,100 ℃变性10 min,保存于-20 ℃。取蛋白进行8% SDS-PAGE电泳分离,并转移至PVDF膜上,5%脱脂牛奶室温封闭1 h,TBST洗涤后,分别加入β-actin一抗(稀释度1∶10 000)、SIRT1一抗(稀释度1∶1 000)、PGC-1α一抗(稀释度1∶1 000),4 ℃孵育过夜。次日TBST洗涤,用辣根过氧化物酶标记的二抗室温孵育1 h,TBST漂洗后,在暗室进行ECL显影。采用凝胶成像系统拍照,通过Image J软件测定蛋白条带灰度值,以目的蛋白条带灰度值与β-actin条带灰度值的比值,反映目的蛋白的相对表达水平。
2 结果
2.1 各组不同时间点MAP的变化如Tab 1所示,T0时和T3时3组大鼠MAP比较无明显差异(P>0.05);与Sham组比较,Shock组和Sevo组在T1和T2时MAP降低(P<0.05)。
Tab 1 MAP during hemorrhagic shock and resuscitation
2.2 各组动脉血气分析结果如Tab 2所示,T0时和T3时3组大鼠pH值、BE和Lac值比较,差异无统计学意义(P>0.05);与Sham组比较,Shock组和Sevo组在T1和T2时pH值降低,BE值降低,Lac升高(P<0.05),且两组间无明显差异(P>0.05)。
2.3 七氟醚后处理对失血性休克复苏大鼠海马线粒体SOD活性的影响SOD活性检测结果显示(Fig 1),与Sham组相比,Shock组海马线粒体SOD活性明显降低(P<0.05);与Shock组相比,Sevo组SOD活性增加(P<0.05)。

Fig 1 Effects of sevoflurane postconditioning on activity of SOD in mitochondria isolated from hippocampus
2.4 七氟醚后处理对海马MDA含量影响MDA检测结果显示(Fig 2),与Sham组相比,Shock组MDA含量明显增加(P<0.05);与Shock组相比,Sevo组MDA含量降低(P<0.05)。
2.5 七氟醚后处理对失血性休克复苏大鼠海马SIRT1和PGC-1α蛋白表达的影响Western blot检测结果显示(Fig 3),与Sham组相比,Shock组SIRT1和PGC-1α表达增加(P<0.05);与Shock组相比,Sevo组SIRT1和PGC-1α表达增加(P<0.05)。
3 讨论
七氟醚是近年来临床常用的吸入麻醉剂,基础和临床研究证实,七氟醚预处理和后处理均能发挥脑保护作用。在Dang等[5]的研究中,七氟醚预处理可以影响脑缺血/再灌注后早期小胶质细胞/巨噬细胞的迁移、吞噬和增殖,从而改善脑神经功能。也有实验表明,七氟醚后处理可以抑制线粒体膜通透性转换孔的开放,缩短缺血/再灌注大鼠在水迷宫实验中的逃避潜伏期,下调促凋亡蛋白Bax,上调抗凋亡蛋白Bcl-2的表达,提示七氟醚后处理可以通过减轻线粒体功能障碍,减轻脑缺血/再灌注损伤[6]。
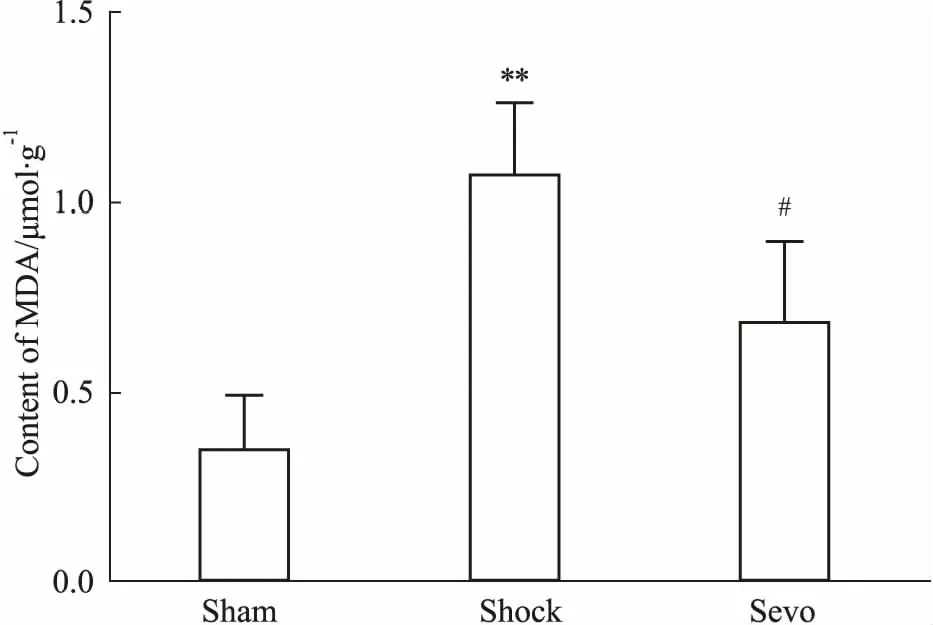
Fig 2 Effects of sevoflurane postconditioning on content of MDA in hippocampus
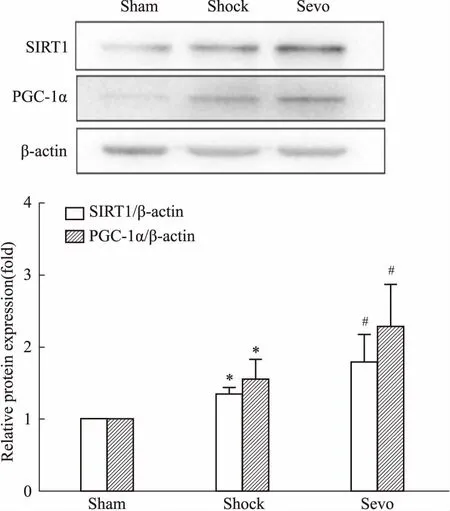
Fig 3 Effects of sevoflurane postconditioning on expression of SIRT1 and PGC-1α
本实验采用经右颈总动脉放血30 min,缺血1 h后,在30 min内回输全部自体血的方法,制备大鼠失血性休克复苏模型,模拟全身性缺血/再灌注过程。结果表明,与Sham组比较,Shock组和Sevo组放血后MAP明显降低,pH值和BE降低,Lac升高,提示大鼠失血性休克模型制备成功。回输自体血后,MAP升高,pH值、BE和Lac与放血前无明显差异,且大鼠均存活,提示复苏成功。

Tab 2 Arterial blood gases results
脑缺血/再灌注损伤是一个多因素参与的病理生理过程,包括炎症反应、细胞内钙离子超载、兴奋性氨基酸毒性作用,以及与ATP生成减少、活性氧(ROS)蓄积、线粒体功能障碍等有关的氧化应激[7-8]。MDA是机体内氧化应激损伤的产物之一,对细胞的代谢和功能均有明显的影响,其含量的高低也能体现机体受ROS攻击和损伤的程度[9]。本实验中,Shock组大鼠海马组织MDA含量明显增加,其原因可能是失血性休克复苏增加了大鼠脑内ROS的产生,蓄积的ROS引发了脂质过氧化反应。而七氟醚后处理减少了MDA的产生,改善了脑组织氧化应激损伤。SOD是机体关键的抗氧化超氧歧化物酶类,其水平可以间接反映机体抗氧化应激能力[10]。检测失血性休克与复苏大鼠海马线粒体SOD活性发现,与Sham组相比,其活性明显降低,而七氟醚后处理可以增加线粒体SOD活性,表明七氟醚后处理可能通过线粒体相关信号途径,提高机体抗氧化应激能力。
为了进一步探讨七氟醚后处理减轻失血性休克复苏大鼠氧化应激可能的分子机制,本实验采用Western blot法检测海马组织中SIRT1和PGC-1α蛋白的表达。SIRT1是NAD+依赖的组蛋白去乙酰化酶,在抵抗氧化应激、抑制细胞凋亡及神经细胞保护等方面发挥调控作用[11]。PGC-1α是SIRT1的作用底物之一,参与线粒体生物合成及功能维持,是在抗氧应激作用中有重要作用的转录因子。研究表明,SIRT1表达增加可以激活PGC-1α的转录,从而增加线粒体密度,进而通过诱导抗氧化酶的表达、清除活性氧、抗线粒体损伤等,提高机体抗氧化应激能力[12-13]。本研究发现,与Shock组相比,Sevo组SIRT1和PGC-1α蛋白表达增加,表明七氟醚后处理可以促进SIRT1和PGC-1α蛋白的表达,增强机体抗氧化应激能力。而Shock组的SIRT1和PGC-1α表达量高于Sham组,可能是失血性休克复苏刺激了内源性SIRT1和PGC-1α的表达,以抵抗缺血/再灌注损伤过程中的氧化应激等损伤。
综上所述,七氟醚后处理可以通过上调SIRT1、PGC-1α蛋白的表达,减轻失血性休克复苏大鼠海马的氧化应激反应。有研究证实[14],PGC-1α可与下游的核呼吸因子1结合,再激活线粒体转录因子A,产生更多的生物学效应。本课题组也将深入研究SIRT1/PGC-1α及下游分子在七氟醚后处理减轻脑缺血/再灌注损伤中的作用。