新型PPARγ激动剂CMHX008对高糖诱导人肾小管上皮HK-2细胞纤维化的影响及机制
2019-09-24刁俊玲黄荣凤廖茂霖陈春秀李佳渝李继斌肖晓秋
刁俊玲,伍 敏,黄荣凤,廖茂霖,陈春秀,,李佳渝,李继斌,肖晓秋
(重庆医科大学1. 附属第一医院重大代谢性疾病转化医学重庆市高校重点实验室、2. 公共卫生与管理学院,重庆 400016)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病的主要并发症之一,易导致慢性肾衰竭,我国已进入DN发病的高发期[1-2]。肾脏纤维化是肾损伤的最终途径,在肾小管上皮细胞向间质转化的调节过程中,涉及了上皮细胞黏性的丢失,α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的表达增加,肌动蛋白重组,肾小管基底膜被破坏,以及细胞迁移和侵袭能力增强[3]。转化生长因子β1(transforming growth factor β1,TGF-β1)是促纤维化的关键因子。过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)主要通过抑制在高糖条件下培养的肾小管细胞和糖尿病大鼠肾小管细胞中的TGF-β1/Smad3信号通路,进而减缓肾小管间质纤维化的发生[4]。
2型糖尿病是导致DN的主要原因[1]。经典的噻唑烷二酮类药物(thiazolidinediones,TZDs),如罗格列酮、吡格列酮等,作为口服治疗2型糖尿病的主要药物,在发挥治疗作用的同时常伴随较多严重的不良反应[5]。通过对罗格列酮的结构进行改造,我们合成了新型TZDs类PPARγ激动剂CMHX008(Fig 1),其对PPARγ的激动能力较罗格列酮弱,但具有与罗格列酮相似的胰岛素增敏和促进脂肪细胞分化的作用[6]。Choi等[7]研究表明,在高脂条件下,小鼠脂肪细胞中细胞周期蛋白依赖性蛋白激酶5 (cyclindependent kinase 5,CDK5)介导的PPARγ的磷酸化明显增加,抗糖尿病药物罗格列酮通过抑制小鼠脂肪细胞中CDK5介导的PPARγ Ser273位点的磷酸化,来增加胰岛素对葡萄糖的敏感性,进而发挥体内维持正常葡萄糖水平的作用。研究发现,CMHX008可以抑制肥胖小鼠脂肪组织中PPARγ丝氨酸273位点的磷酸化,引起骨量丢失的程度较罗格列酮明显减轻[8],且对高脂饮食诱发的糖尿病小鼠的肾脏功能减退也有明显的改善作用[9]。那么,在DN中,PPARγ部分激动剂CMHX008对肾脏功能的改善是否与PPARγ丝氨酸273位点的磷酸化有关。因此,本研究旨在将罗格列酮作为阳性对照,采用高糖诱导的人肾小管上皮HK-2细胞为模型,阐明CMHX008对DN的改善作用与PPARγ丝氨酸273位点的磷酸化的关系。
1 材料
1.1 细胞与试剂人肾小管上皮细胞HK-2,购自中科院上海细胞所,按ATCC官网培养方法培养。D-(+)-葡萄糖(Sigma,G7021);D-甘露糖醇(Sigma,M1902);Keratinocyte-SFM(Gibco,10725018);牛脑垂体提取物(bovine pituitary extract,BPE)(Sciencell,0703);重组人表皮生长因子(recombinant human epidermal growth factor,rh-EGF)(Peprotech,96AF10015100);罗格列酮(重庆太极集团);CMHX008(专利号:201210202455.2),由本校药学院合成,纯度99%;CCK-8试剂盒(日本同仁,CK04);PPARγ(3025T)、E-钙黏蛋白(E-cadherin)抗体,均购自CST公司;p-PPARγ(上海户实,HK-5769);α-SMA(ab5694)、TGF-β1(ab64715)、Na+-葡萄糖协同转运蛋白2(sodium-dependent glucose transporters 2,SGLT2,ab58298)抗体,均购自Abcam公司;β-actin抗体(Sino Biological,100166-MM10);α-tubulin抗体(Proteintech,66031-1-1-lg);TRIzol(Invitrogen,15996026);RNA逆转录试剂盒(Roche,7912455001);SYBER(Roche,06924204001);BD基底膜基质胶(BD,356234);小室(Millipore,MCEP24H48)。

Fig 1 The chemical structure of TZDs rosiglitazone and CMHX008
1.2 仪器1-15PK型低温离心机(Sigma公司);VERITI型梯度PCR仪(Applied Biosystems公司);ND-2000型分光光度计、1510型全波长酶标仪(Thermo Scientific公司);CFX96型实时荧光定量PCR仪(Bio-Rad公司);DM40008型生物显微镜(Leica公司);FUSION-FX5 Spectra型凝胶成像图像分析系统(Vilber Lourmat 公司)。
2 方法
2.1 细胞培养HK-2细胞培养于Keratinocyte-SFM培养基(含0.05 g·L-1BPE、5 μg·L-1EGF、0.9 mmol·L-1CaCl2、D-(+)-葡萄糖5.5 mmol·L-1),放置于37 ℃、5% CO2孵箱中培养。采用0.05%胰酶消化,每5 d按1∶3比例传代。将传代细胞在5.5 mmol·L-1葡萄糖中培养作为空白对照组(Control组);在30 mmol·L-1甘露醇中培养为高渗组(M组);在30 mmol·L-1葡萄糖中培养为高糖组(HG组);高糖培养基分别同时加入1、3、10 μmol·L-1罗格列酮或CMHX008处理作为HR1、HR3、HR10或HC1、HC3、HC10组。
2.2 CCK-8法检测细胞活性取对数生长期的细胞,配制100 μL的细胞悬液,以5×103个/孔的密度接种于96孔板,置于37 ℃、5% CO2中培养24 h后,进行药物处理,设置不含细胞和药物的培养基组,含细胞的培养基组,高糖组(D-(+)-葡萄糖 30 mmol·L-1),不同浓度的罗格列酮组(1、3、10 μmol·L-1)和CMHX008组(1、3、10 μmol·L-1)。将培养板放在培养箱中分别孵育24、48、72 h后,向每孔加入10 μL CCK-8溶液,在培养箱内孵育1~4 h,用酶标仪检测450 nm处的吸光度。
2.3 免疫印迹法用已加入蛋白酶抑制剂和磷酸酶抑制剂的RIPA常规裂解HK-2细胞,提取总蛋白。采用BCA法测定蛋白浓度,进行蛋白定量,取20 μL蛋白上样,用SDS/PAGE凝胶电泳分离蛋白,电转蛋白至PVDF膜,5% BSA常温封闭2 h,用1∶1 000稀释的一抗PPARγ、p-PPARγ、α-SMA、E-cadherin、TGF-β1、SGLT2、β-actin、α-tubulin 4 ℃孵育过夜,次日加入辣根过氧化物酶标记的二抗室温孵育1 h,显影,结果用Fusion软件进行分析。
2.4 实时荧光定量PCRTRIzol裂解液用于常规裂解HK-2细胞,提取总RNA,用分光光度计检测RNA浓度。采用20 μL逆转录体系于梯度PCR仪进行逆转录,并获得模板cDNA,加入180 μL DEPC水,补齐至200 μL。取2.5 μL cDNA,加入5 μL SYBER、1.5 μL DEPC水、上下游引物各0.5 μL,补齐至10 μL,于qPCR仪中进行扩增。PCR扩增目的基因上、下游引物序列见Tab 1。

Tab 1 Primer sequence for real-time PCR
2.5 划痕实验将HK-2细胞种于6孔板,在高糖条件下用罗格列酮和CMHX008处理7 d,待长到80%后,用200 μL枪头在细胞底部轻轻划上一条直线,用PBS轻洗2遍后,在倒置显微镜下采集0 h的图像,采集完毕后,用无血清培养基培养24 h后采集图像。
2.6 Transwell实验取25 μL Matrigel基底膜基质胶用无血清K-SFM培养基梯度稀释后混匀,取50 μL稀释后的Matrigel胶加入小室后铺匀,显微镜下观察无气泡,放入孵箱待成胶。过夜后,将用罗格列酮和CMHX008在高糖条件下处理7 d的HK-2细胞消化后,用无血清培养基制成1×109·L-1细胞悬液,在上室加入200 μL细胞悬液,下室加入750 μL完全培养基,将细胞放入细胞培养箱中培养24 h。24 h后取出小室,用棉签轻轻擦拭上室内底面,擦掉未穿过膜的细胞,用PBS洗3次,多聚甲醛固定10 min后,结晶紫染液染色5 min,PBS洗3次,晾干后拍照。
3 结果
3.1 高糖条件下肾小管上皮细胞出现明显的纤维化将HK-2细胞在30 mmol·L-1葡萄糖的高糖环境中培养7 d后,采用免疫印迹法检测发现,高糖处理后HK-2细胞中TGF-β1的表达明显增加,HK-2细胞显示出明显的纤维化,而采用等浓度的甘露醇处理的HK-2细胞中,TGF-β1的表达与空白对照组比较差异无显著性(Fig 2)。通过检测HK-2细胞中SGLT2和葡萄糖转运蛋白4(glucose transporter type 4,GLUT4)mRNA的水平,发现SGLT2、GLUT4 mRNA表达水平均明显降低,HK-2细胞的纤维化引起肾小管上皮细胞膜转运功能障碍(Fig 3)。在高糖条件下,检测到HK-2细胞p-PPARγ(Ser273)增加,而采用等浓度的甘露醇处理的HK-2细胞与空白对照组比较,p-PPARγ(Ser273) 差异无显著性(Fig 2)。以上结果表明,人肾小管上皮HK-2细胞在高糖环境中发生明显的纤维化,肾小管上皮细胞的膜转运功能明显减弱,而PPARγSer273位点的磷酸化表达明显增加。
3.2 罗格列酮和CMHX008能抑制高糖引起的肾小管上皮细胞纤维化的发生采用1、3、10 μmol·L-1的罗格列酮和CMHX008对HK-2细胞分别进行24、48、72 h的处理,通过CCK-8法检测发现,72 h后细胞活性显示出明显差异。如Fig 4所示,HR3组和HC3组(后面称为HR、HC组)细胞存活率与对照组差异无显著性,细胞状态较为稳定,因此,我们选用了3 μmol·L-1罗格列酮和3 μmol·L-1CMHX008进行高糖条件下的给药处理。在30 mmol·L-1葡萄糖浓度下,分别给予3 μmol·L-1罗格列酮和CMHX008作用于HK-2细胞。如Fig 5所示,高糖条件下,纤维化标志蛋白TGF-β1、α-SMA的表达明显升高,E-cadherin表达明显下降;给予PPARγ激动剂罗格列酮和CMHX008后,HK-2细胞中TGF-β1、α-SMA表达明显降低,E-cadherin表达明显升高。在高糖条件下,细胞的迁移能力和侵袭能力都明显增强,而同时给予罗格列酮和CMHX008后,明显抑制HK-2细胞的迁移和侵袭能力(Fig 6、7)。以上结果表明,罗格列酮和CMHX008对HK-2细胞的纤维化有明显的抑制作用。有文献表明[3],纤维化会导致肾小管膜转运功能障碍,引起SGLT2蛋白表达减少,因此,我们检测了HK-2细胞中SGLT2蛋白,发现高糖诱导的HK-2细胞中SGLT2明显减少,而给予罗格列酮和CMHX008后,SGLT2蛋白的表达未明显增加(Fig 5)。
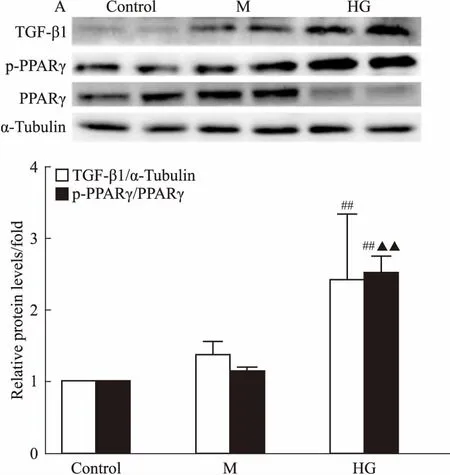
Fig 2 Expression of TGF-β1,p-PPARγ(Ser273)and PPARγ protein levels in HK-2 cells cultured with high concentration of mannitol or glucose
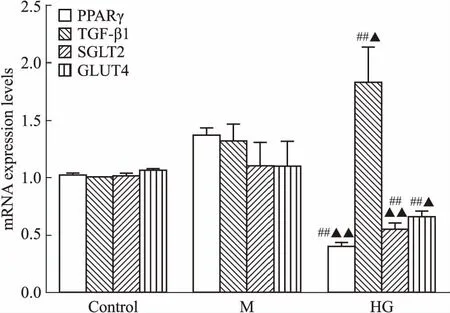
Fig 3 Related mRNA expression levels in HK-2 cells cultured with high concentration of mannitol or glucose
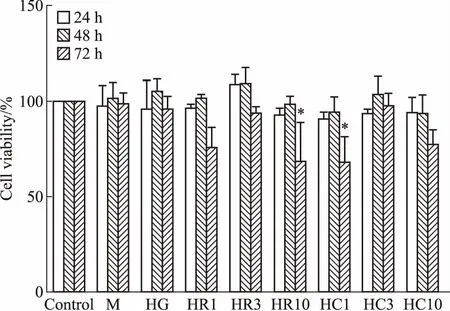
Fig 4 Cell viability of different drug concentrations by CCK-8
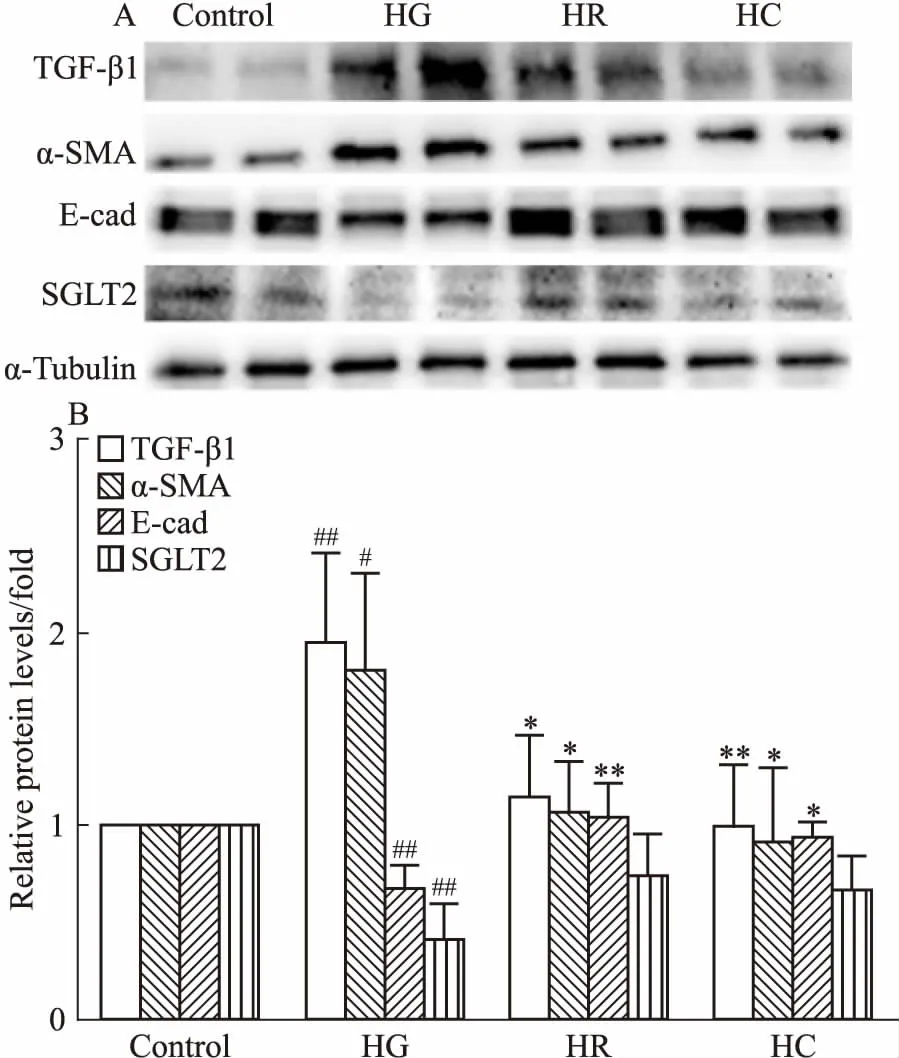
Fig 5 Renal fibrogenic marker expression levels in HK-2 cells treated with drugs
3.3 罗格列酮和CMHX008下调HK-2细胞PPARγ Ser273位点的磷酸化罗格列酮和CMHX008可以逆转高糖诱导的人肾小管上皮细胞纤维化的发生,在高糖环境中培养的HK-2细胞给予3 μmol·L-1罗格列酮和3 μmol·L-1CMHX008处理后,HR组和HC组p-PPARγ(Ser273)的表达明显减少(Fig 8)。提示罗格列酮和CMHX008对肾小管上皮细胞纤维化的改善作用与抑制PPARγ Ser273位点磷酸化的上调有关。
4 讨论
高血糖作为糖尿病的标志,如果长期不加以控制,会对身体各器官造成损伤,甚至造成威胁生命健康的并发症,如心血管疾病、神经性疾病、眼病、肾病等。其中,糖尿病并发症肾病的发生率不断增加,影响了多数糖尿病患者[2]。DN的主要特征是肾脏功能的丢失,导致肾脏组织大面积的纤维化。据文献报道,病理因素刺激的肾小管上皮细胞α-SMA呈时间依赖性递增,上皮标志蛋白如角蛋白表达等则逐渐减弱,至d 7时,α-SMA表达强度很高,而角蛋白等上皮细胞标志蛋白的表达很弱或者消失[10]。高糖环境与肾小管的结构和功能变化有密切联系[3]。在本研究中,人肾小管上皮HK-2细胞在高糖环境下处理7 d后,纤维化标志因子TGF-β1蛋白的表达明显升高。GLUT4是受胰岛素调节的葡萄糖转运蛋白,在肾脏中有表达,而在实验性糖尿病情况下表达会减少[11]。我们检测发现,高糖环境下肾小管中GLUT4水平有明显下调。

Fig 6 Migrated distance of HK-2 cells in four groups by wound healing assay vs control group;**P<0.01 vs group HG

Fig 7 Invaded ability of HK-2 cells in four groups by transwell assay vs control group;**P<0.01 vs group HG

Fig 8 The p-PPARγ(Ser273) protein expression levels of HK-2 cells treated by drugs
对于2型糖尿病的发生,如果改变生活方式不足以控制血糖,口服药物如双胍类、磺酰脲类、TZDs、SGLT2抑制剂等为治疗2型糖尿病的主要途径。其中,TZDs为2型糖尿病患者主要的口服降血糖药物,但在临床上出现较多严重不良反应,最常见的有水钠潴留、体质量增加、骨折风险增加,以及罗格列酮心血管方面的影响等[5]。因此,研究者致力于研究较弱激动能力的PPARγ部分激动剂,如KY-201、SR1664,发现它们也具有与罗格列酮相似的胰岛素增敏作用[12-13]。之前的研究已表明,化合物CMHX008不仅能有效维持肥胖小鼠体内正常血糖稳态,促进脂肪细胞的分化,而且相比罗格列酮,骨量的丢失明显减少[6,8]。近年来,有文献报道,在DN大鼠的肾脏中PPARγ表达的增加,抑制了发挥促纤维化关键基因如TGF-β1、胶原蛋白、纤黏蛋白的下调,PPARγ完全激动剂吡格列酮可以抑制在高糖条件下肾小管上皮细胞纤维化的发生,显示出抗肾脏纤维化的作用[14-15]。因此,我们对具有较弱PPARγ激动能力的CMHX008化合物与DN的关系进行了研究。给予PPARγ激动剂罗格列酮和CMHX008处理后,高糖环境培养的HK-2细胞中纤维化标志蛋白TGF-β1、α-SMA的表达明显减少,E-cadherin蛋白表达明显增加。结果表明,CMHX008对人肾小管上皮细胞纤维化的发生有明显的抑制作用,CMHX008可以改善糖尿病患者肾脏的纤维化。
Choi等[7]在2010年提出,CDK5介导的PPARγ的磷酸化,是抗糖尿病PPARγ配体的直接靶标,而PPARγ丝氨酸273位点的磷酸化,为脂肪生成和脂肪细胞基因表达的主要调节因素,减少胰岛素敏化脂肪因子和脂联素的表达,而罗格列酮可以阻断CDK5介导PPARγ磷酸化的过程。我们之前的研究发现,长期高脂饮食的小鼠给予CMHX008后,小鼠脂肪细胞中PPARγ丝氨酸273位点的磷酸化明显减少,骨量丢失明显减少[8]。本实验在高糖环境中培养的HK-2细胞中发现,PPARγ丝氨酸273位点的磷酸化明显增加,当HK-2细胞在高糖条件下同时给予罗格列酮和CMHX008处理后,PPARγ蛋白丝氨酸273位点的磷酸化均明显减少。高糖环境会诱发人肾小管上皮HK-2细胞PPARγ丝氨酸273位点磷酸化的上调,给予罗格列酮和CMHX008处理可以抑制PPARγ丝氨酸273位点的磷酸化。
虽然PPARγ激动剂罗格列酮可促进脂肪的分化,增强外周组织对胰岛素的敏感性,但是由于其不良反应限制了在临床中的使用,而CMHX008具有类似的胰岛素增敏作用,并且已证明可以减少骨量的丢失,不引起体质量的增加[6,8]。因此,本研究旨在以糖尿病的高糖环境为诱发DN的主要因素,发现了激动能力较弱的PPARγ激动剂CMHX008可以减少人肾小管上皮细胞的纤维化,对肾脏有明显的保护作用,其与PPARγ丝氨酸273位点磷酸化的抑制有关。DN为普通糖尿病人群主要的并发症,有效避免治疗糖尿病的药物所带来的不良反应是预防糖尿病并发症的主要途径,这一发现为未来CMHX008用于预防DN的发生、糖尿病并发肾脏疾病的治疗提供了一定的理论基础。