AZD8055抑制胆管癌细胞HuCCT1的迁移及EMT进程的机制研究
2019-09-24毕宇宁闫文帝匡子藤林贞花任香善
王 雪,毕宇宁,闫文帝,张 鑫,董 颖,匡子藤,林贞花,任香善
(延边大学1. 肿瘤研究中心、2. 医学院病理学教研室、3. 吉林省科技厅重点实验室,吉林 延吉 133002)
胆管癌是源自胆管上皮细胞的恶性肿瘤,具有易发生转移、预后差等特点[1]。目前,其治疗手段以外科手术切除为主,辅以放化疗[2],但常规放化疗方法具有毒副作用大、易耐药等缺点。近年来,分子靶向治疗是一种快速发展的治疗方法,可特异性的结合肿瘤细胞并诱导其凋亡,但不会伤及肿瘤周围的正常组织细胞,因此,分子靶向治疗也被称为“生物导弹”。
研究表明[3],在胆管癌中,Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路异常激活,并与肿瘤的侵袭和转移等恶性进程呈正相关。mTOR在体内以mTORC1和mTORC2两种复合物的方式存在[4]。研究发现,mTORC1的特异性靶向药物雷帕霉素,易出现负反馈作用,导致Akt的磷酸化[5]。AZD8055是一种新型的mTORC1和mTORC2双重抑制剂(结构见Fig 1A),能有效抑制mTORC1复合物引起的Akt负反馈活性。在肝癌、神经母细胞瘤等多种肿瘤中,AZD8055通过抑制细胞增殖和/或诱导细胞凋亡,从而达到抗肿瘤作用[6-8],但在胆管癌中的抗肿瘤作用及其分子机制尚未见报道。
原癌基因DEK是一种染色质调节蛋白,在胆管癌中呈高表达[9],可通过调节Akt/mTOR信号通路、转录因子等多种途径,促进肿瘤细胞生长、浸润等过程[10-11],提示DEK可作为抗肿瘤的靶点。因此,本研究旨在探讨AZD8055对胆管癌细胞HuCCT1的抑制作用,阐明其分子机制,为胆管癌的临床治疗提供新的实验依据及理论基础。
1 材料
1.1 细胞株人胆管癌HuCCT1细胞,购自美国模式培养物保藏所(American Type Culture Collection,ATCC)细胞库。
1.2 试剂AZD8055,购自美国Selleck Chemicals公司(批号:S1555),用DMSO配制成1 mmol·L-1的浓缩液,分装保存于-20 ℃冰箱;胎牛血清(fetal bovine serum,FBS)、Opti-MEM培养基,均购自美国Gibco公司;RPMI 1640培养基,购自美国Corning公司;p-4EBP1、4EBP1、p-S6、S6、p-Akt、Akt、上皮型钙黏蛋白(E-Cadherin)、波形蛋白(Vimentin)、转录因子Snail抗体,均购自美国Cell Signaling Technology公司;DEK抗体,购自美国BD公司;β-actin抗体,购自美国Abcam公司;MTT、二甲基亚砜(Dimethyl sulfoxide,DMSO),均购自美国Amresco;吉姆萨(Gimesa)染色液,购自日本Wako;DEK小干扰RNA(small interfering RNA,siRNA)试剂,购自广州市锐博生物科技有限公司;Lipo 3000购自美国Invitrogen。
1.3 仪器光学倒置相差显微镜、奥林巴斯BX53显微镜(日本Olympus公司);全波长多功能酶标仪(瑞士Tecan公司);凝胶成像仪、电泳仪(Bio-Rad公司)。
2 方法
2.1 细胞培养HuCCT1细胞用RPMI 1640完全培养液(含10% FBS和1%青-链霉素)培养,于37 ℃、5% CO2细胞培养箱中常规培养。
2.2 MTT实验取对数生长期的HuCCT1细胞,以5×103个(100 μL)接种于96孔板,实验设置对照组、AZD8055组(50、100、200、400 nmol·L-1),每组设置6个平行孔。每组细胞培养24、72、120 h后,每孔加入100 μL MTT(1 g·L-1)溶液,继续培养4 h,小心吸弃上清,加入100 μL的DMSO充分振荡,用全波长分光光度计,在490 nm处检测吸光度(OD)值。AZD8055对HuCCT1细胞的生长抑制率=(1-用药组OD值/对照组OD值)×100%。
2.3 平板集落形成实验取对数生长期的HuCCT1细胞,以每孔100个的细胞密度接种于6孔板中,次日更换为完全培养液及分别含AZD8055(25、50、100 nmol·L-1)的培养液,置于37 ℃、5% CO2细胞培养箱中培养14 d,肉眼可见含有50个以上的细胞集落时,用PBS缓冲液清洗2次,室温下4%多聚甲醛固定,Giemsa染液染色,自然干燥后,进行拍照,用ImageJ软件进行分析。
2.4 划痕愈合实验取对数生长期的细胞接种于6孔板中,待细胞生长至80%~ 90%融合后,用不含血清的培养液饥饿处理细胞6~8 h。用200 μL的灭菌枪头呈“1”字形进行划痕,PBS清洗后,对照组和用药组分别更换为完全培养液和浓度为100、200、400 nmol·L-1的AZD8055工作液,继续培养,在0、12 h拍照,记录划痕宽度,根据公式计算划痕愈合率:划痕愈合率=(0 h划痕宽度-12 h划痕宽度)/0 h划痕宽度×100%。
2.5 Transwell小室迁移实验取对数生长期的HuCCT1细胞,用含1% FBS的培养液制备2×109·L-1的细胞悬液,取100 μL接种于Transwell小室中,待细胞贴壁后,上室分别加入用1% FBS配制的培养液及AZD8055工作液(100、200、400 nmol·L-1),下室加入600 μL含10% FBS的完全培养液。继续培养24 h后,取出小室用4%多聚甲醛固定,结晶紫染色,双蒸水脱色,棉签擦净未迁移的细胞,将小室薄膜切下,铺于载玻片,封片,拍照观察并统计。
2.6 数据库分析登陆STITCH在线数据库(http://stitch.embl.de),选择Multpile names,输入DEK基因及AZD8055,选择人类种属Homo Sapiens,确认信息后即可显示分析结果;登陆GeneMANIA在线数据库(http://www.genemania.org),选择人类种属Homo Sapiens,输入DEK、Akt/mTOR信号通路的相关基因,确认信息后即可显示分析结果。
2.7 Western blot实验细胞常规培养,消化接种于60 mm培养皿,待细胞贴壁后,分别用AZD8055工作液(0、100、200、400 nmol·L-1)处理24 h后提取总蛋白,待检测Akt/mTOR信号通路及DEK蛋白;常规细胞培养,用AZD8055(0、400 nmol·L-1)分别处理0、6、12、24 h后提取总蛋白,待检测EMT相关蛋白。收集各组细胞,用TEPER裂解液提取总蛋白,BSA蛋白定量试剂盒测定蛋白浓度,取40 μg蛋白行8%~10% SDS-PAGE电泳,电转至PVDF膜上,用5%脱脂奶粉封闭1 h,分别加入一抗(1∶1 000)4 ℃孵育过夜,次日,洗膜,加HRP标记二抗(1∶3 000)室温孵育2 h,ECL法显影、曝光,用ImageJ软件进行分析。
由此,通过增加电路状态方程的阶数,解决了改进型文氏桥混沌振荡器的数学建模问题。在式(2)中引入新的无量纲变量,并对电路参数作归一化处理,即
2.8 siRNA基因沉默实验取对数生长期的细胞接种于6孔板,分别设control组、negative control(NC)组及si-DEK组,次日待细胞生长至30%~50%,control组加入2 mL正常完全培养液,negative control组与si-DEK组分别加入含2 mL混合液(含1.74 mL的无双抗有血清RPMI 1640培养液、250 μL Opti-MEM培养基、5 μL的Lipo 3000和5 μL的50 nmol·L-1的siRNA),继续培养48 h,待确认沉默效果后,进行MTT实验、划痕愈合实验、Transwell小室迁移实验、Western blot实验。本文使用的有效siRNA序列为siDEK4(5′-TGTCCTCATTAAAGAAGA A-3′)。
3 结果
3.1 AZD8055明显抑制胆管癌细胞增殖活力与集落形成能力MTT结果显示(Fig 1B),与对照组相比,AZD8055(50、100、200、400 nmol·L-1)组细胞增殖活性明显受到抑制,且呈时间-浓度依赖性(P<0.05)。平板集落形成实验结果提示(Fig 1C),AZD8055处理HuCCT1细胞14 d后,与对照组相比,AZD8055(25、50、100 nmol·L-1)组细胞克隆形成能力明显减弱,且呈剂量依赖性(P<0.05),提示AZD8055可明显抑制HuCCT1细胞的增殖活性。
3.2 AZD8055抑制胆管癌细胞的迁移能力Fig 2A的划痕愈合实验结果发现,AZD8055(100、200、400 nmol·L-1)作用细胞12 h后,与对照组相比,药物处理组细胞横向迁移距离明显缩短。Fig 2B的Transwell实验结果发现,AZD8055(100、200、400 nmol·L-1)处理HuCCT1细胞24 h后,其纵向细胞迁移能力明显受到抑制(P<0.05),提示AZD8055可抑制胆管癌细胞的横向及纵向迁移能力。
3.3 AZD8055抑制Akt/mTOR信号通路相关蛋白的表达及EMT进程Western blot结果显示,AZD8055(100、200、400 nmol·L-1)作用于胆管癌细胞24 h后,Akt/mTOR信号通路相关蛋白Akt、S6、4EBP1蛋白的磷酸化水平明显下降(Fig 3A)。经400 nmol·L-1的AZD8055处理6、12、24 h后,上皮标志物E-cadherin蛋白表达升高,间质标志物Vimentin、Snail蛋白表达下降(Fig 3B),提示AZD8055抑制Akt、S6、4EBP1的磷酸化水平及EMT进程。
3.4 AZD8055通过调控DEK抑制胆管癌细胞的增殖及迁移能力为了检测AZD80055抑制胆管癌细胞的增殖和迁移的机制,用STITCH数据库分析AZD8055与DEK蛋白之间的相关性(Fig 4A)。STITCH数据库分析结果显示,AZD8055与DEK蛋白之间具有相关性。以上提示,DEK蛋白可作为AZD8055与Akt/mTOR信号通路的枢纽蛋白,参与AZD8055抑制胆管癌细胞HuCCT1的增殖、迁移及EMT进程的调控过程。
Western blot结果发现,AZD8055(100、200、400 nmol·L-1)作用于胆管癌细胞24 h后,DEK蛋白表达明显受到抑制(Fig 4B),表明AZD8055可调控DEK蛋白的表达,与STITCH数据库结果一致。筛选DEK基因沉默序列,结果表明,si-DEK4沉默效果最为明显(Fig 4C),后续实验选择si-DEK4作为沉默序列。基因沉默48 h后,胆管癌细胞的增殖能力与迁移能力明显受到抑制(P<0.05)(Fig 4D~4F),提示AZD8055可靶向DEK蛋白,抑制胆管癌的增殖与迁移。

Fig 1 Effect of AZD8055 treatment on proliferation and colony of HuCCT1 cells
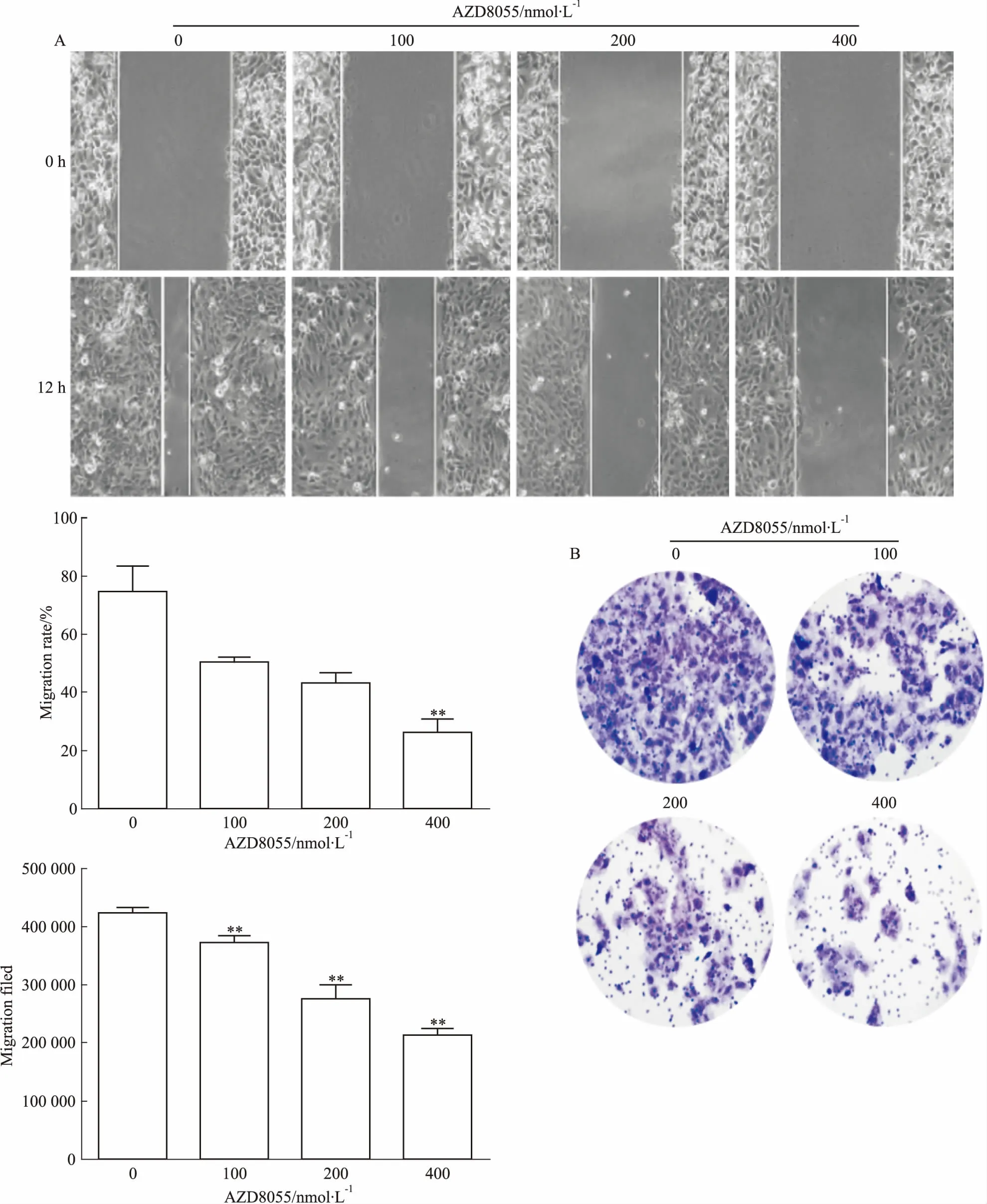
Fig 2 Influence of AZD8055 on HuCCT1 cell migration

Fig 3 Blockade of Akt/mTOR pathway and process of EMT by AZD80055 in HuCCT cells
Western blot结果显示,DEK基因沉默48 h后,Akt、S6、4EBP1蛋白的磷酸化表达水平明显下调(Fig 5B),且上皮标志物E-cadherin表达上调,间质标志物Vimentin、Snail表达下调(Fig 5C)。上述结果提示,AZD8055靶向DEK,抑制Akt/mTOR信号通路的磷酸化水平,并抑制胆管癌细胞的EMT进程。
4 讨论
胆管癌是消化道恶性程度较高的肿瘤,死亡率居高不下[1]。多项研究证实,AZD8055可作为一种新型抗肿瘤药物,通过抑制增殖与诱导凋亡,达到良好的体内外抗肿瘤作用[4,12]。本实验通过MTT法检测AZD8055对胆管癌细胞HuCCT1增殖的影响,结果显示,不同浓度的AZD8055能够有效抑制胆管癌的增殖活性,呈剂量-时间依赖性;进一步的克隆结果显示,AZD8055可以明显减少HuCCT1细胞的集落数量。李鹏等[7]的研究表明,AZD8055可以通过调节AMPK蛋白的磷酸化水平,抑制肝癌细胞的增殖和克隆形成能力。划痕愈合实验和Transwell小室迁移实验结果显示,AZD8055明显抑制胆管癌细胞的横向与纵向迁移能力。这与Giubellino等[13]的研究中,AZD8055可以通过Akt/mTOR信号通路,抑制嗜铬细胞瘤迁移能力的结果相一致。
Akt/mTOR信号通路是肿瘤发生的一个重要信号通路,在多种肿瘤中异常激活[14],与肿瘤细胞的增殖、凋亡、自噬与转移等过程密切相关。Western blot结果显示,AZD8055处理细胞后,Akt、S6和4EBP1的蛋白磷酸化水平均受到明显抑制,提示AZD8055可通过抑制Akt/mTOR信号通路,调控HuCCT1细胞的凋亡、增殖和迁移。
DEK作为一种原癌基因参与多种生物进程,如增殖、衰老、凋亡、分化和转化蛋白。通过STITCH数据库分析结果显示,AZD8055与DEK蛋白之间具有相关性。进一步的GeneMANIA数据库发现,DEK与Akt/mTOR信号通路存在交互关系。本实验结果表明,不同浓度AZD8055处理HuCCT1细胞24 h后,可明显抑制DEK蛋白的表达水平,而沉默DEK基因明显抑制了Akt、S6、4EBP1蛋白的磷酸化表达水平,并明显降低胆管癌细胞增殖及迁移。Wu等[11]研究证实,下调DEK基因抑制胰腺导管癌的增殖和转移,与我们的研究结果相符。本课题组前期的研究证实,DEK作为Akt的上游因子,参与和调控Akt信号通路[9]。
EMT是指上皮细胞失去细胞极性向间质细胞表型转化的现象。当细胞发生癌变时,上皮细胞间的细胞连接减弱,从而促进细胞迁移和侵袭能力。Nörz等[15]的研究结果发现,AZD8055联合MK-2206可抑制Akt/mTOR信号通路的活性,从而抑制黑色素瘤细胞的EMT进程。本研究结果也显示,胆管癌细胞经AZD8055处理后,E-cadherin表达上调,Vimentin、Snail表达下调。Yang等[16]的研究证明,沉默乳腺癌细胞中的DEK基因后,E-cadherin表达上调,Vimentin、基质金属蛋白酶(matrix metalloproteinases,MMPs)中的MMP-2和MMP-9表达下调。本实验结果表明,当HuCCT1细胞中DEK基因沉默后,上皮标志物E-cadherin表达上调,间质标志物Vimentin、Snail表达下调。
综上所述,AZD8055可有效抑制HuCCT1胆管癌细胞的迁移及EMT进程,这与降低DEK蛋白表达水平,抑制Akt/mTOR信号通路相关。本研究将为AZD8055应用于胆管癌的临床治疗提供新的理论依据。

Fig 4 Proliferation and migration of cholangiocarcinoma cells inhibited by AZD8055 via regulating DEK gene

Fig 5 AZD8055 targets DEK to regulate Akt/mTOR signaling pathway to inhibit EMT progress of cholangiocarcinoma cells