力达霉素对人宫颈癌Hela细胞周期、凋亡、自噬和上皮细胞间质转化能力的影响
2019-09-24刘钰妮王世恩杨建林王艳林曹春雨
徐 珊,周 游,刘钰妮,王世恩,杨建林,王艳林,曹春雨
(1. 三峡大学医学院,肿瘤微环境与免疫治疗湖北省重点实验室,湖北 宜昌 443002;2. 宜昌市疾病预防控制中心,健康管理服务中心,湖北 宜昌 443000)
力达霉素(lidamycin,LDM)是一种大分子烯二炔类抗肿瘤抗生素,它由我国科学家首先发现于湖北省潜江县土壤中分离出的一株链霉菌(StreptomycesglobisporusC-1027)中。LDM对大多数革兰阳性菌有抑菌作用,但对革兰阴性菌和分枝杆菌无效。进一步研究发现,LDM对多种肿瘤细胞具有强大的杀伤作用,在肿瘤临床治疗中具有重要的应用前景[1]。目前,已经证实其在体内外对多种肿瘤细胞具有杀伤力,并且其杀伤力远高于常用化疗药[2],但其对宫颈癌细胞作用的机制研究报道不多。本研究以宫颈癌Hela细胞为研究对象,分析LDM对宫颈癌细胞的影响及其作用的分子机制,为将LDM用于宫颈癌的临床治疗提供实验依据。
1 材料
1.1 细胞株人宫颈癌Hela细胞株,购自武汉细胞典藏中心,由本实验室传代保存。
1.2 试剂LDM,由北京协和医科大学甄永苏教授惠赠;二甲基亚砜(dimethyl sulfoxide,DMSO),购自美国Sigma公司;DMEM培养基,购自美国Gibco公司;胎牛血清、青霉素/链霉素双抗,购自天津灏洋生物;BSA蛋白定量试剂盒、凋亡试剂盒(Annexin Ⅴ-FITC、PI Staining Solution),购自南京诺唯赞生物科技有限公司;ECL超敏显影液,购自美国Thermo Scientific公司;逆转录试剂盒、实时定量PCR试剂盒、RNase,购自日本TaKaRa宝生物公司;结晶紫、RIPA组织/细胞裂解液,购自北京索莱宝(Solarbio)科技有限公司;Dioc6购自美国Thermo Fisher公司;Cyclin B1、Cyclin D1、p21、Bax、Bcl-2、Beclin-1抗体,均购自Proteintech公司;PARP、p62、LC3A/B、E-cadherin、MMP-9抗体,均购自Cell Signaling Technology公司;N-cadherin抗体,购自BD Transduction Lab公司;Vimentin抗体,购自Santa Cruz公司;MMP-2、LSD1抗体,均购自Abcam公司;β-actin抗体,购自北京科美博瑞公司。
1.3 仪器TE2000-S荧光倒置显微镜(日本Nikon公司);全波长酶标仪(美国Thermo公司);凝胶电泳仪、电转仪(Bio-Rad公司);化学发光成像系统(BIOSHine公司);BDFACSVerse流式细胞仪(美国BD公司);NanoDrop 2000核酸分析仪(美国Thermo Fisher公司);ABI StepOne Plus实时荧光定量PCR仪(美国应用生物系统公司)。
2 方法
2.1 MTT法分析细胞增殖收集对数生长期细胞,调整细胞浓度至3.5×107·L-1。将细胞悬液加入96孔培养板,每孔100 μL(约3 500个细胞/孔)。将培养板置37 ℃、5% CO2培养箱中培养过夜。用DMEM完全培养基倍比稀释药物,按每孔100 μL的量将其加入相应孔中(每个药物浓度设置6个复孔),置37 ℃、5% CO2培养箱中分别继续培养24、48、72 h。吸除培养基,加MTT试剂(终浓度0.2 g·L-1),37 ℃、5% CO2培养箱中培养4 h后,吸除培养液,每孔加入DMSO 150 μL, 低速振荡15~30 min,待结晶物充分溶解后,在全波长酶联免疫检测仪上测量各孔的OD490值。细胞生长抑制率计算公式:抑制率/%=[1-(药物处理组OD值-试剂对照孔OD值)/(无药物处理组OD值-试剂对照孔OD值)]×100%。药物的IC50值经由GraphPad Prism5统计软件计算得出。
2.2Transwell法分析细胞迁移分别收取不同浓度药物处理的细胞,用无血清DMEM培养液调整细胞浓度至4×108·L-1。向Transwell小室中加入无血清DMEM培养基(50 μL/小室),37 ℃平衡5 min。将调整好浓度的细胞悬液垂直缓慢加入小室中(100 μL/小室),并将小室置于加有600 μL DMEM完全培养基的培养板下室中,37 ℃、5% CO2培养箱中培养24 h。取出小室,PBS清洗小室2~3次。将小室置于800 μL固定液中,室温固定30 min,PBS清洗小室2~3次。将小室置于800 μL结晶紫染色溶液中,室温染色30 min,清水清洗3~4遍后,吸干小室内液体,用蘸湿的棉棒轻轻擦去上室内部细胞,PBS清洗小室2~3次。将小室小心放置于滴有PBS的干净玻片上,显微镜下随机取3个视野进行拍照,并计数细胞。
2.3 Transwell法分析细胞侵袭向Transwell小室加入无血清DMEM培养基(50 μL/小室),37 ℃平衡5 min后弃去。将基质胶原液用无血清DMEM培养基1∶8稀释后,垂直加入小室中(80 μL/小室),置37 ℃、4 h静待其凝固。分别收取不同浓度药物处理的细胞,用无血清DMEM培养基调整细胞浓度至2.5×108·L-1。将调整好浓度的细胞悬液垂直缓慢加入小室中(100 μL/小室),并将小室置于加有600 μL DMEM完全培养基(含12%小牛血清)的培养板下室中。37 ℃、5% CO2培养箱中培养24 h。余下操作同上述细胞迁移分析。
2.4 Western blot法检测蛋白表达分别收取经不同浓度药物处理的细胞,用含蛋白酶抑制剂的RIPA液裂解细胞(100 μL/孔)后,12 000 r·min-1、4 ℃离心15 min,将上清转移至新的EP管。用BCA法测定细胞裂解液中的蛋白浓度,取适量上清液(含50 μg蛋白),加入1/4体积的5×loading buffer,100 ℃保温10 min。所得样品经SDS-PAGE分离,电转移至PVDF膜。膜用5%脱脂牛奶(TBST配制)室温封闭2 h后,TBST洗膜10 min×3次。加一抗4 ℃孵育过夜,TBST洗膜10 min×3次;再加二抗室温孵育2 h,TBST洗膜10 min×3次,最后用ECL化学发光法显影并记录结果。
2.5 流式细胞术检测细胞周期分别收取不同浓度药物处理的细胞,1×PBS洗涤细胞1次,1 000 r·min-1离心5 min,弃上清。用4 ℃预冷的75%乙醇(1×PBS配制)重悬细胞,固定过夜。2 000 r·min-1离心5 min,弃上清,用1 mL 1×PBS重悬细胞,2 000 r·min-1离心5 min,弃上清。细胞沉淀用500 μL 1×PBS(含50 mg·L-1RNase和0.1% TritonX-100)重悬,加20 μL 0.5 g·L-1PI,37 ℃水浴避光染色30 min。细胞样本过滤后,上流式细胞仪分析。
2.6 流式细胞术检测细胞凋亡分别收集药物处理后的细胞,PBS洗涤1次,1 000 r·min-1离心5 min,弃上清。参照试剂盒说明书,每个样品用100 μL Binding Buffer重悬细胞后,分别加入Annexin Ⅴ-FITC(5 μL/管)和PI Staining Solution(5 μL/管)。充分混匀,避光静置10 min。每管加入400 μL Binding Buffer,轻轻混匀,1 h内进行流式细胞仪分析。
2.7 流式细胞术分析细胞线粒体膜电位检测收集相应处理后细胞于EP管中,用PBS洗洗涤细胞1次,1 000 r·min-1离心5 min,弃上清。预先将Dioc6储存液用无血清DMEM培养基稀释至工作浓度(40 nmol·L-1),每管用1 mL Dioc6工作液重悬细胞。避光37 ℃、20 min,中途弹悬1次。然后以1 000 r·min-1离心5 min,弃上清,用PBS洗涤细胞1次,1 000 r·min-1离心5 min,弃上清。每管用500 μL PBS重悬细胞后,进行流式细胞仪分析。
2.8 qPCR检测mRNA的表达用1 mL TRIzol试剂裂解培养于6孔板中的细胞,并将细胞裂解液转移至EP管中,每管加入氯仿300 μL,涡旋震荡15 s,冰置10 min,13 000 r·min-1、4 ℃离心10 min。将上清转移至新的EP管,每管加入异丙醇300 μL,颠倒混匀。冰置15 min,13 000 r·min-1、4 ℃离心10 min。弃上清,用75%的乙醇(DEPC水配制)600 μL洗涤沉淀,13 000 r·min-1、4 ℃离心10 min。该步骤重复操作一遍。弃去上清液,在无菌台内静置10 min待残余乙醇挥发,每管加入20 μL DEPC-水溶解RNA沉淀。参照逆转录试剂盒说明书操作,将样品中的mRNA逆转录成cDNA。然后以β-actin为内参基因,实时定量PCR法检测目标mRNA的相对表达水平。引物序列见Tab 1。

Tab 1 Primer sequence of LSD1 and β-actin
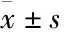
3 结果
3.1 LDM能有效抑制宫颈癌Hela细胞增殖LDM(0、5、10、20、40、80 μg·L-1)处理Hela细胞24、48、72 h,MTT法检测分析LDM对细胞增殖的影响,每组设置6个复孔。Fig 1结果显示,LDM对宫颈癌Hela细胞的增殖有明显性抑制作用,且呈浓度与时间依赖性。经GraphPad软件统计分析,LDM对Hela细胞的IC50(95%可信区间)值为:24 h组,19.24 μg·L-1(7.684~48.16 μg·L-1);48 h组,6.678 μg·L-1(3.494~12.76 μg·L-1);72 h组,3.221 μg·L-1(1.397~7.429 μg·L-1)。

Fig 1 Proliferation of Hela cells inhibited by LDM
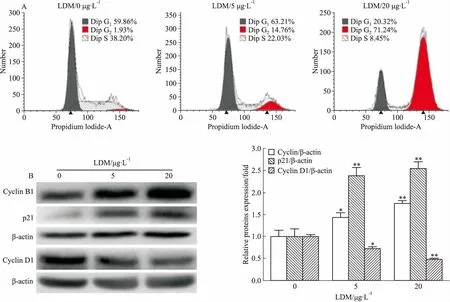
Fig 2 Hela cells arrested by LDM on G2/M stage

Fig 3 Effect of LDM on apoptosis of Hela cells
3.2 LDM诱导宫颈癌Hela细胞发生G2/M周期阻滞LDM(0、5、20 μg·L-1)处理细胞24 h后,收集细胞进行流式细胞分析。结果显示,与对照组相比,LDM处理组G1期、S期细胞比例降低,G2期细胞比例明显性增加,提示LDM能将Hela细胞周期阻滞在G2/M期,并且呈浓度依赖性(Fig 2A)。Western blot结果也显示, 与对照组相比,LDM处理组的细胞周期相关因子Cyclin B1与p21表达升高,而Cyclin D1表达降低,且呈浓度依赖性(Fig 2B)。该结果进一步验证LDM能通过对细胞周期相关蛋白因子表达的影响,改变Hela细胞周期和抑制细胞增殖。
Fig 4 Effect of LDM on expression of apoptosis-related proteins and change of MMP of Hela cells
3.3 LDM诱导宫颈癌Hela细胞凋亡LDM(0、5、10、20、40、80 μg·L-1)处理细胞24、48 h后,收集细胞进行流式细胞分析。结果显示,LDM能有效诱导Hela细胞发生凋亡,且呈浓度依赖性。与对照组相比,LDM处理24 h的细胞凋亡率从3.87%增加到11.38%;而LDM处理48 h的细胞凋亡率从4.27%增加到29.54%(Fig 3)。Western blot分析结果显示,与对照组相比,LDM处理组(24 h)的细胞中凋亡底物蛋白PARP的切割活化产物蛋白(c-PARP)与凋亡促进蛋白Bax表达增加,但凋亡抑制蛋白Bcl-2的表达下降,Bax/Bcl-2的比值明显升高,且以上变化均呈浓度依赖性(Fig 4A)。
线粒体膜通透性增加和膜电位下降是线粒体途径细胞凋亡发生的早期事件之一。为了进一步验证LDM对宫颈癌Hela细胞的细胞凋亡的诱导作用,本实验用LDM(0、5、20 μg·L-1)处理细胞48 h后,收集细胞并用Dioc6染色,然后用流式细胞术检测细胞内线粒体膜电位的变化。结果显示,与对照组相比,LDM处理组的细胞绿色荧光强度均值增加,峰顶值右偏,且高浓度组较低浓度组变化更明显,提示LDM处理可导致线粒体膜通透性增加和膜电位降低(Fig 4B)。
3.4 LDM影响宫颈癌Hela细胞自噬用LDM(0、5、20 μg·L-1)处理细胞24 h后,制备细胞裂解液进行Western blot分析。结果显示,与对照组相比,低浓度LDM处理使自噬底物蛋白p62蛋白表达水平下降,而自噬标志蛋白Beclin-1和LC3B表达水平升高;但高浓度LDM处理时,p62蛋白表达水平无明显改变,而Beclin-1和LC3B的表达水平明显下降(Fig 5)。提示LDM在低浓度时可使Hela细胞自噬水平增加,而在高浓度时可降低Hela细胞的自噬水平。
3.5 LDM抑制宫颈癌Hela细胞迁移和侵袭分别用LDM(0、5、10、20、40、80 μg·L-1)处理对数生长期的Hela细胞24 h,然后用Transwell法分析细胞的迁移能力。结果显示,LDM能明显抑制宫颈癌Hela细胞的迁移能力,且呈浓度依赖性(Fig 6A、6C)。进一步分析LDM对Hela细胞侵袭能力影响。用LDM(0、5、20 μg·L-1)处理对数生长期的Hela细胞24 h后,基质胶-Transwell法分析细胞的侵袭能力。结果显示,LDM能够有效抑制宫颈癌Hela细胞侵袭,且呈浓度依赖性(Fig 6B、6D)。
随后分析LDM对Hela细胞内EMT相关因子表达的影响。用LDM(0、5、20 μg·L-1)处理细胞24 h后,制备细胞裂解液,Western blot法分析细胞内EMT相关蛋白表达的水平。结果显示,与对照组相比,LDM处理组细胞的上皮细胞标志蛋白E-cadherin表达升高,间质型细胞标志蛋白N-cadherin与Vimentin表达降低,且高浓度组较低浓度组变化更明显;与对照组相比,LDM处理细胞中基质金属蛋白酶MMP-2与MMP-9表达降低,且高浓度组较低浓度组变化更明显(Fig 7)。上述结果提示,LDM能够抑制宫颈癌Hela细胞发生EMT和抑制细胞侵袭转移。

Fig 5 Effect of LDM on autophagy of Hela cells n=3)
3.6 LDM对宫颈癌Hela细胞内LSD1表达水平无明显影响用LDM(0、5、20 μg·L-1)处理细胞24 h后,分析细胞内LSD1 mRNA和蛋白的表达。Fig 8结果显示,与对照组细胞相比,LDM处理组细胞的LSD1 mRNA及蛋白表达水平无明显改变。
4 讨论
肿瘤细胞对LDM处理的反应,因其组织来源和遗传背景不同而有所差异。目前报道的LDM抑制肿瘤细胞增殖和杀伤肿瘤细胞的机制主要包括:① 与肿瘤细胞DNA双螺旋的小沟结合,引起DNA双链断裂和脱碱基化,从而抑制细胞增殖;② 抗肿瘤血管生成;③ 诱导肿瘤细胞发生凋亡、裂亡,以及出现衰老样表型;④ 诱导肿瘤细胞发生G1或G2/M细胞周期阻滞;⑤ 干扰与肿瘤生长相关信号通路的活性,如K-ras、Akt、NF-kB和MAPK信号通路等[2]。
本研究发现,LDM在低浓度下即能高效抑制Hela细胞的增殖,处理24、48、72 h的IC50值分别为19.24、6.678、3.221 μg·L-1。细胞周期分析发现,LDM能将Hela细胞阻滞于G2/M期,同时上调细胞周期调控因子Cyclin B1和p21,但下调Cyclin D1的表达水平。在高浓度处理组(20 μg·L-1)细胞中,上述现象尤为明显。这一结果提示,LDM导致细胞周期调控因子异常表达可能是其抑制细胞周期的重要分子基础[2,3]。
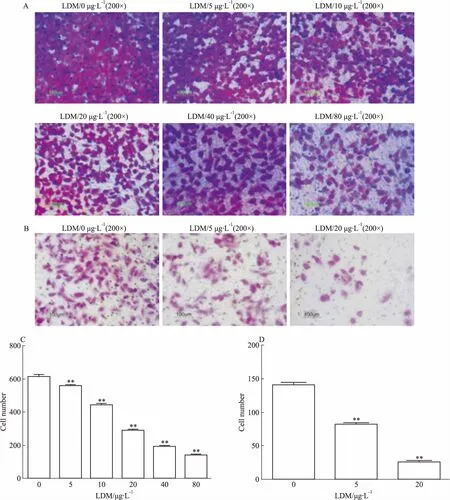
Fig 6 Effect of LDM on migration and invasion abilities of Hela cells
细胞的凋亡与自噬分别被称为细胞的I型程序性死亡和Ⅱ型程序性死亡[4]。本研究发现,LDM可诱导Hela细胞发生凋亡,表现为LDM可使细胞中凋亡底物蛋白PARP的切割活化产物c-PARP与凋亡促进蛋白Bax表达增加,而凋亡抑制蛋白Bcl-2的表达下降,Bax/Bcl-2的比值明显升高,且以上变化均表现出浓度依赖性。进一步对线粒体膜电位的分析提示,LDM能诱导Hela细胞发生线粒体依赖性的内源性细胞凋亡。

Fig 7 Effect of LDM on EMT-related proteins in Hela cells
LDM对Hela细胞自噬的影响因药物浓度的不同而有所差异,低浓度LDM(5 μg·L-1)能诱导Hela细胞发生自噬,这可能是药物应激条件下细胞的自我保护性反应。但在高浓度(20 μg·L-1)时,LDM能明显抑制Hela细胞的自噬能力,由此导致的应激保护能力下降可能进一步增强Hela细胞对药物的敏感性,对自噬的抑制可能与高浓度LDM能更明显地抑制细胞增殖、抑制细胞周期和诱导细胞凋亡密切相关。
侵袭和迁移是所有恶性肿瘤的特征性生物学行为,其过程机制复杂,密切关系着疾病的发展与预后。肿瘤细胞的上皮-间充质转化(epithelial-mesenchymal transition,EMT),即具有上皮表型的肿瘤细胞转化为具有间充质表型的肿瘤细胞,是上皮肿瘤获得侵袭转移能力、以及药物抗性的关键性步骤,由此成为抗癌治疗的重要靶点[5-7]。本研究发现,LDM对宫颈癌Hela细胞的侵袭和迁移能力均有明显抑制作用,且呈浓度依赖性。LDM可上调Hela细胞中上皮细胞标志蛋白E-cadherin,但抑制间质型细胞标志蛋白N-cadherin与Vimentin的表达水平,同时使具有促侵袭转移功能的基质金属蛋白酶MMP-2与MMP-9表达降低,且高浓度药物处理的细胞中上述变化更为明显。上述结果提示,LDM能够抑制宫颈癌Hela细胞发生EMT和抑制细胞侵袭和转移。
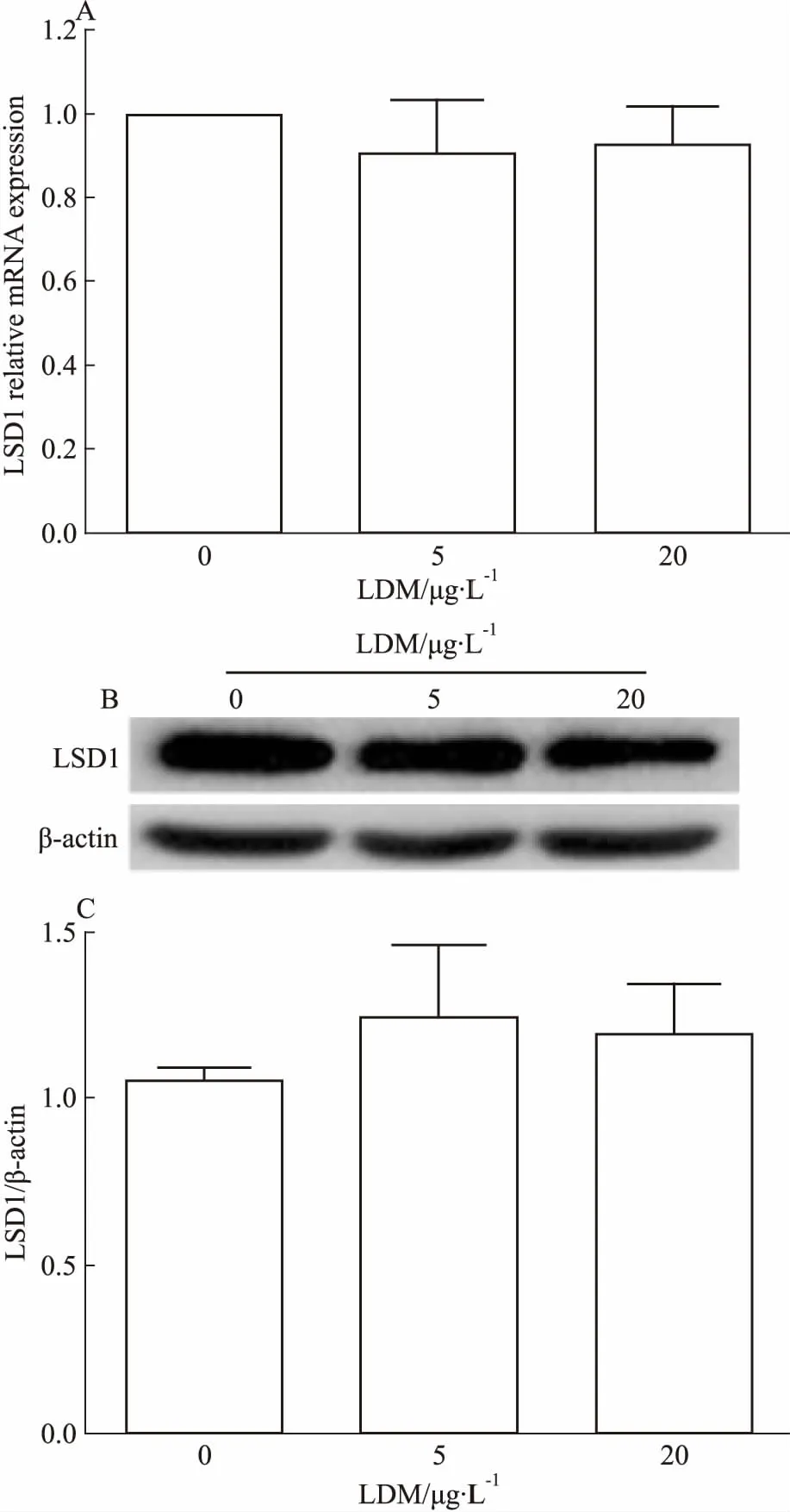
Fig 8 Effect of LDM on expression of LSD1 mRNA(A)and protein(B, C) of Hela cells
有研究发现,赖氨酸特异性去甲基化酶1(lysine specific demethylase 1,LSD1)能结合到E-cadherin基因的启动子上,并与HDAC1/2、PRC2、G9a、Suv39H1和DNA甲基转移酶等因子协同作用,引起的该基因表达沉默[8-9]。这提示LSD1在介导E-cadherin基因表达沉默过程中发挥重要作用,而敲除LSD1基因能逆转其对E-cadherin基因的转录抑制作用,进而上调E-cadherin的表达水平[10-11]。
为探索LSD1是否也在LDM诱导Hela细胞发生EMT的过程中发挥作用,本研究分析了LDM对宫颈癌Hela细胞中LSD1表达的影响。结果发现,LDM对Hela细胞中LSD1的表达水平无明显影响。提示LDM对宫颈癌Hela细胞EMT的抑制作用与LSD1无关,LDM上调Hela细胞中E-cadherin基因表达的机制有待进一步研究。
综上所述,本研究结果证明,LDM能够有效抑制宫颈癌Hela细胞的增殖和侵袭转移,其作用机制可能与阻遏细胞周期、诱导细胞凋亡、干扰细胞自噬和抑制EMT密切相关。上述研究结果提示,LDM有用于宫颈癌临床治疗的潜在价值,该研究为LDM的临床应用提供了基础研究支撑。