沙眼衣原体pORF5质粒蛋白通过HMGB1抑制细胞凋亡机制的初步研究
2019-09-24雷文波何蓓聂倩文雅婷赵钰琦李忠玉
雷文波 何蓓 聂倩 文雅婷 赵钰琦 李忠玉
南华大学衡阳医学院病原生物学研究所 特殊病原体防控湖南省重点实验室,湖南衡阳421001
沙眼衣原体(Ct)是一种严格细胞内寄生的原核细胞型微生物,抑制宿主细胞凋亡是Ct完成细胞内生长发育的必要条件[1-2]。线粒体是细胞凋亡调控的活动中心,Bcl-2蛋白家族在线粒体介导的细胞凋亡中发挥重要的调控作用。Ct通过多种机制调控Bcl-2蛋白家族的表达进而调节线粒体功能抑制宿主细胞凋亡[3-5]:Sharma等[3]研究发现,缺氧诱导因子1α通过上调Bcl-2抗凋亡家族蛋白Mcl-1抑制Ct感染的细胞凋亡;Rajalingam等[4]发现Ct通过激活Raf/MEK/ERK和PI3K/AKT信号通路,稳定和上调Mcl-1蛋白表达水平,从而保护Ct感染的细胞免受凋亡刺激因子引起的凋亡。
pORF5是Ct质粒编码的一种分泌性蛋白[6],本课题组前期研究证实,pORF5能促进宿主细胞高迁移率族蛋白1(HMGB1)表达上调[7],HMGB1是一种高度保守的核内非组蛋白,在调控细胞凋亡过程中发挥重要作用[8-9]。为探讨pORF5质粒促进HMGB1表达对细胞凋亡的影响及机制,我们用pORF5质粒蛋白刺激HMGB1 shRNA干扰的HeLa细胞,通过对线粒体膜电位、细胞色素c(Cyt c)的释放以及Bcl-2、Bax、胱天蛋白酶3(caspase-3)等凋亡相关分子的检测,综合分析pORF5质粒蛋白抗凋亡的分子机制,为Ct感染性疾病的防治提供实验依据。
材料与方法
一、主要实验试剂与细胞
兔抗Bcl-2、Bax和caspase-3多克隆抗体产自美国Cell Signaling Technology公司;兔抗Cyt c多克隆抗体产自美国Abcam公司;甘油醛-3-磷酸脱氢酶(GAPDH)抗体、Cy3标记的羊抗兔IgG抗体和辣根过氧化物酶标记羊抗兔抗体产自美国Proteintech公司;JC-1线粒体膜电位检测试剂盒来自上海碧云天公司;凋亡诱导剂碳酰氰基-对-氯苯腙(CCCP)为美国Sigma公司产品;HeLa细胞株、HMGB1干扰的HeLa细胞(shHMGB1-HeLa)和对照RNA干扰的HeLa细胞(对照RNA-HeLa)为本研究所保存[10]。
二、细胞培养与分组
用含10%胎牛血清的DMEM培养基在37℃、5%CO2的环境中培养HeLa细胞。当HeLa细胞处于对数生长期时,将其分成2组,一组用10μmol/L CCCP处理30 min作为对照组,另一组为pORF5与CCCP共处理组,即用10 mg/L pORF5蛋白(本课题组通过原核表达制备保存)刺激18 h后,再用10μmol/L CCCP处理30 min。为了分析HMGB1是否参与pORF5质粒蛋白的抗凋亡作用,部分实验中用pORF5质粒蛋白和CCCP共刺激shHMGB1-HeLa和对照RNA-HeLa细胞,刺激方法同上。
三、间接免疫荧光检测Cyt c释放情况
取生长状态良好的HeLa细胞、shHMGB1-HeLa细胞和对照RNA-HeLa细胞,0.25%胰蛋白酶消化后制成细胞悬液,将细胞密度调整为5×105个/ml后接种于24孔细胞培养板中,过夜培养,待生长至融合度约80%时,按照上述分组方法处理细胞后,去除细胞培养基,PBS洗涤细胞,依次经4%多聚甲醛固定30 min、0.5%Triton X-100透膜10 min、血清封闭30 min,再加入1∶1 000稀释的兔抗Cyt c抗体孵育2 h后,加入Cy3标记的羊抗兔荧光二抗孵育2 h,加入4′,6-二脒基-2-苯基吲哚染色1 h,封片后荧光显微镜观察细胞内Cyt c的分布情况。
四、JC-1荧光染色检测线粒体膜电位
用PBS洗涤经CCCP单独或与pORF5共处理的HeLa细胞、shHMGB1-HeLa细胞和对照RNAHeLa细胞后,加入1 ml JC-1染色工作液,置于细胞培养箱中37℃避光孵育20 min,用JC-1染色缓冲液洗涤3次,荧光显微镜观察结果,根据红色与绿色荧光强度比率来判断线粒体膜电位变化。
五、Western印迹检测凋亡相关蛋白的表达
收集经上述处理的HeLa细胞、shHMGB1-HeLa细胞、对照RNA-HeLa细胞并用RIPA裂解液裂解细胞,离心收集蛋白,BCA法测定蛋白浓度。取30μg蛋白加入上样缓冲液,混合均匀后煮沸5 min,将样本经十二烷基硫酸钠聚丙烯酰胺凝胶电泳分析后转移至聚偏二氟乙烯膜上,5%脱脂牛奶封闭2 h,分别以兔抗Bcl-2、Bax和caspase-3抗体作为一抗,辣根过氧化物酶标记羊抗兔抗体作为二抗进行Western印迹检测,用ECL试剂显影,以目的蛋白与GAPDH蛋白的灰度值之比表示蛋白表达水平。
六、统计学分析
结 果
一、pORF5质粒蛋白拮抗CCCP诱导的线粒体膜电位下降
见图1。CCCP处理后HeLa细胞线粒体膜电位较低,红/绿荧光强度比率为0.4±0.1;而CCCP与pORF5质粒蛋白共处理后,线粒体维持较高的膜电位,细胞主要发出红色荧光,红/绿荧光强度比率为1.7±0.3,显著高于对照组(t=6.95,P<0.01)。
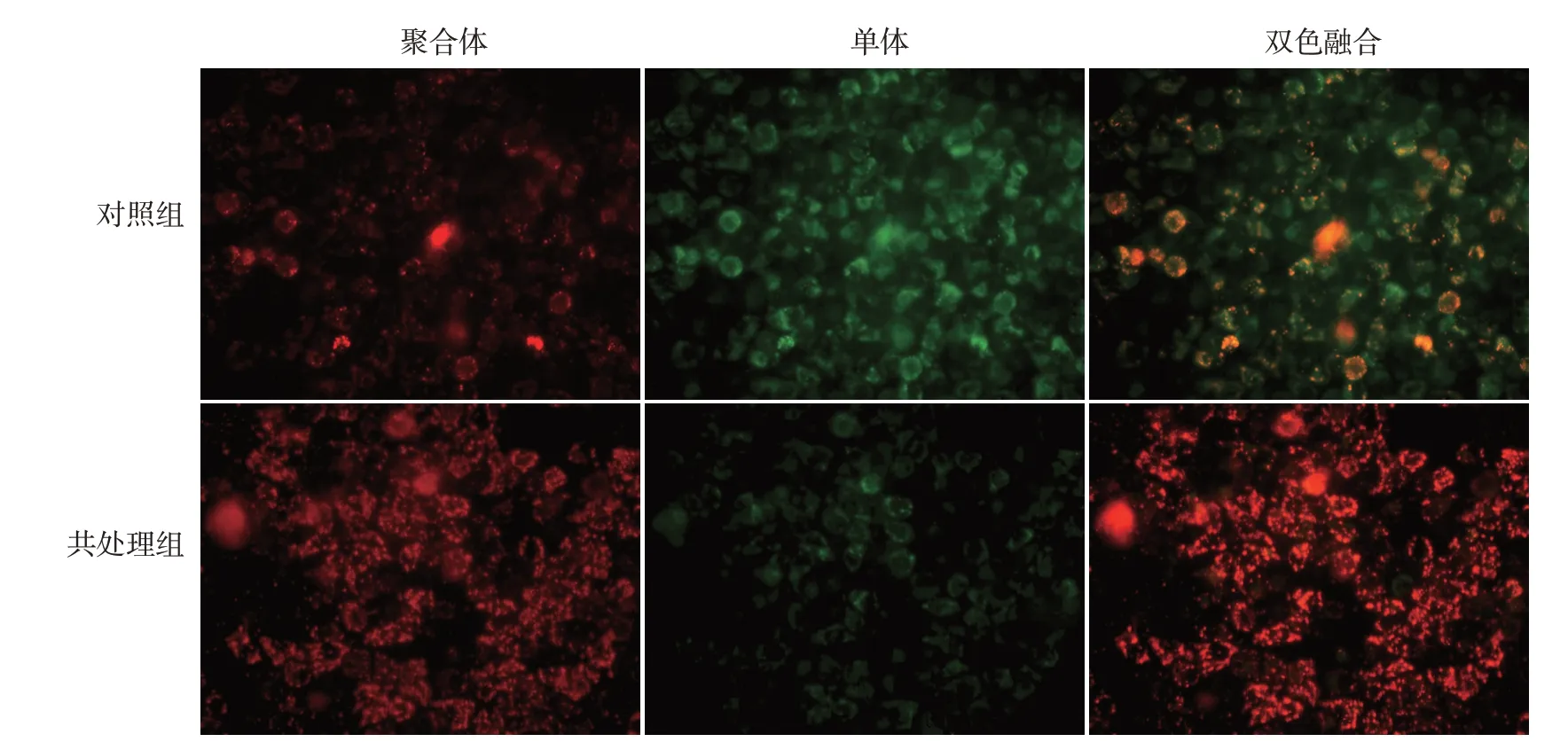
图1 JC-1荧光探针分析pORF5对HeLa细胞线粒体膜电位的影响
二、pORF5质粒蛋白对凋亡相关蛋白表达的影响
与对照组比较,共处理组HeLa细胞Bcl-2蛋白的表达水平增加(5.3±0.6)倍(t=8.62,P<0.01),Bax平均表达水平降低79%±10%(t=9.23,P<0.01),caspase-3活化片段P17平均含量减少75%±8%(t=4.26,P<0.05)。见图2。
三、间接免疫荧光法检测Cyt c释放情况
对照组HeLa细胞胞质Cyt c呈均匀弥散红色荧光,而pORF5质粒蛋白处理组Cyt c呈点状分布(图3)。
四、pORF5质粒蛋白通过上调HMGB1的表达抑制细胞凋亡
经pORF5质粒蛋白和CCCP共处理后,JC-1荧光探针检测显示,对照RNA-HeLa细胞存在大量红色荧光,红/绿荧光强度比率为1.2±0.2;而shHMGB1-HeLa细胞表现出去极化的线粒体膜电位,红色荧光信号明显减少,绿色荧光信号增强,红/绿荧光强度比率为0.3±0.1,显著低于对照RNAHeLa细胞(t=11.23,P<0.01)。见图4。
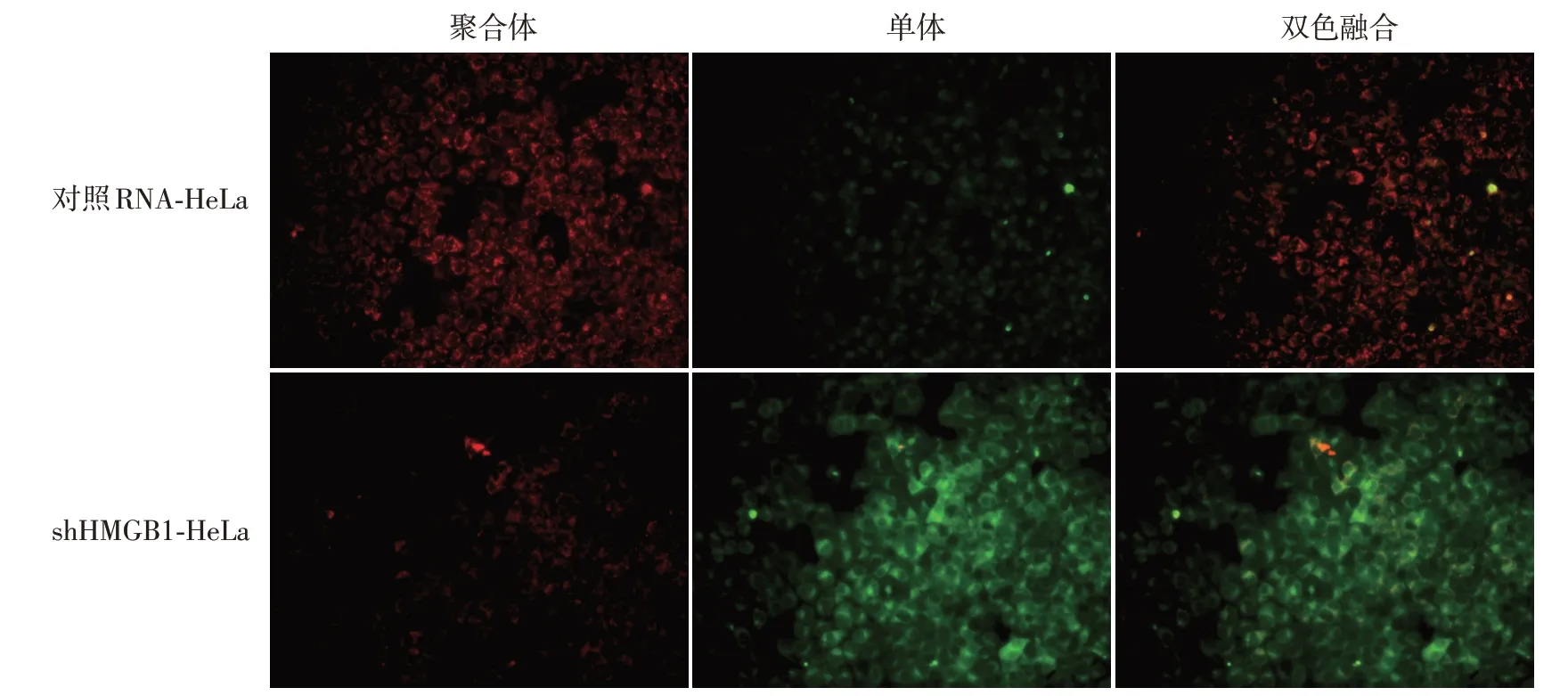
图4 JC-1荧光探针分析HMGB1对shHMGB1-HeLa和对照RNA-HeLa细胞线粒体膜电位的影响
Western印迹结果显示,shHMGB1-HeLa细胞中Bax平均表达水平较对照RNA-HeLa细胞增加(1.2±0.2)倍(t=13.06,P<0.01),Bcl-2平均表达水平较对照RNA-HeLa细胞降低56%±7%(t=7.19,P<0.05)(图5)。间接免疫荧光法显示,与对照RNA-HeLa细胞比较,shHMGB1-HeLa细胞中Cyt c从线粒体释放量增加,见图6。
讨 论
Ct的生长繁殖需要宿主细胞提供生存环境及营养物质,为顺利完成在细胞内的发育周期,Ct通过多种机制调控宿主细胞[1-5]。线粒体膜电位变化是细胞凋亡级联反应过程中最早发生的事件,也是细胞凋亡发生的一个重要步骤。Ct pORF5具有抑制细胞凋亡、促进炎症反应等多方面功能[11-13]。为进一步分析pORF5抗凋亡分子机制,我们用pORF5蛋白和凋亡诱导剂CCCP联合处理细胞,发现pORF5能拮抗CCCP诱导的线粒体膜电位下降,初步证实pORF5可通过保护线粒体功能抵抗凋亡诱导剂诱导的细胞凋亡。
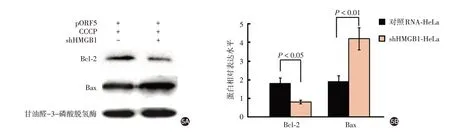
图5 HMGB1对shHMGB1-HeLa和对照RNA-HeLa细胞Bcl-2和Bax蛋白表达的影响
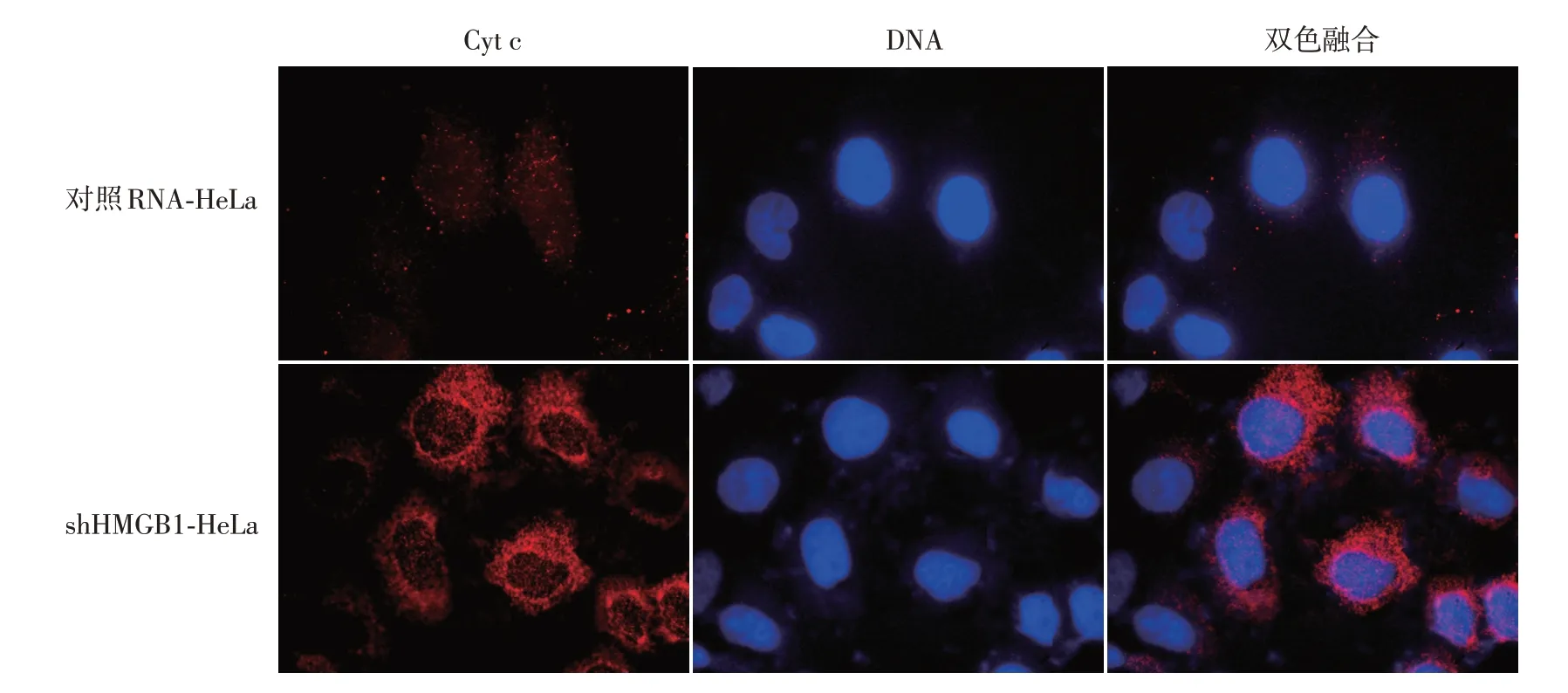
图6 间接免疫荧光技术检测HMGB1对HeLa细胞细胞色素c(Cyt c)释放的影响
Bcl-2家族蛋白可通过调控线粒体结构与功能的稳定性调节细胞凋亡。当细胞受到凋亡诱导因子刺激后,促凋亡蛋白Bax和Bak被激活,并在线粒体外膜上发生寡聚化,Bax/Bak复合体与线粒体上的电压依赖性离子通道相互作用,致线粒体通透性增加,促进Cyt c从线粒体上释放,释放的Cyt c激活caspase-3,使无活性的caspase-3前体裂解为有活性的P17和P15两个亚单位,从而启动细胞凋亡,但抗凋亡蛋白Bcl-2、Bcl-xL可阻断Bax/Bak激活的通道抑制细胞凋亡[14]。本实验显示,pORF5能降低Bax和活化caspase-3的表达,促进Bcl-2蛋白的表达,并能显著抑制Cyt c释放。提示pORF5质粒蛋白通过上调抗凋亡蛋白Bcl-2、下调促凋亡蛋白Bax的表达,抑制线粒体介导的凋亡途径从而发挥抗凋亡作用。
HMGB1是一种DNA结合蛋白,具有调节基因转录,参与DNA重组修复和复制等作用[15-16];在细胞损伤和炎症反应时,HMGB1可分泌到细胞外,介导炎症和细胞增殖、凋亡抑制等多种生物学功能[8-9,17]。前期研究发现,pORF5质粒蛋白能上调宿主细胞HMGB1的表达[7],本研究中我们用RNA干扰技术干扰HMGB1表达后,HeLa细胞线粒体膜电位显著降低,细胞凋亡相关蛋白Bax的表达水平增加,而抑制细胞凋亡的Bcl-2表达水平降低,Cytc从线粒体释放量增加,提示HMGB1在pORF5质粒蛋白抗凋亡作用过程中发挥重要作用。
综上,我们通过pORF5质粒蛋白体外刺激HeLa细胞,发现pORF5可调控Bcl-2和Bax等凋亡相关蛋白的表达,并抵抗CCCP诱导的线粒体膜电位下降和Cyt c释放,初步证实pORF5可抵抗线粒体途径介导的细胞凋亡;并发现HMGB1敲低能显著抑制pORF5质粒蛋白抗凋亡能力,证实pORF5通过HMGB1调控宿主细胞凋亡。促进HMGB1表达进而调节宿主细胞死亡信号通路可能是有助于Ct建立对自身生长发育有利环境的一个重要生物学事件。本研究可丰富Ct抗凋亡分子机制,为Ct感染性疾病的预防和治疗提供实验依据。
利益冲突所有作者均声明不存在利益冲突
