捻转血矛线虫Hc-FAR-4蛋白的表达特性及其与配体结合能力分析
2019-09-23韦海典陈学秋黄艳时恒枝周静茹吴飞杜爱芳杨怡
韦海典,陈学秋,黄艳,时恒枝,周静茹,吴飞,杜爱芳,杨怡
捻转血矛线虫Hc-FAR-4蛋白的表达特性及其与配体结合能力分析
韦海典,陈学秋,黄艳,时恒枝,周静茹,吴飞,杜爱芳,杨怡
(浙江大学动物科学学院/浙江省动物预防医学重点实验室,杭州 310058)
【】捻转血矛线虫()寄生在牛羊等反刍动物的皱胃中,引起的捻转血矛线虫病在我国呈全国性流行。文章通过研究脂肪酸与视黄醇结合相关蛋白Hc-FAR-4的表达特性及配体结合能力,以了解其在捻转血矛线虫生长、发育、繁殖过程中的作用。对进行克隆、并且构建原核表达载体pET-30a-,pET-30a-重组质粒经过PCR与双酶切鉴定准确无误之后转化到BL21感受态细胞中,用0.1 mmol·L-1IPTG(isopropyl-β-d-thiogalactoside)进行重组蛋白的诱导表达。收集重组蛋白rHc-FAR-4,利用荧光分析法,研究rHc-FAR-4蛋白与DAUDA、视黄醇、油酸的结合能力。配体结合试验是依据荧光物质retinol与脂肪酸类似物DAUDA在极性和非极性溶液中,在某一波长的激发光激发下,所发出的荧光光谱随之变化的特性,判断rHc-FAR-4蛋白是否具有与DAUDA、retinol结合的能力。再在体系中加入非荧光长链脂肪酸油酸,根据荧光光谱的变化情况判定油酸能否分别与DAUDA、retinol竞争目的蛋白的脂肪酸结合位点,间接说明目的蛋白能否与非荧光脂肪酸油酸结合。同时制备鼠源多克隆抗体,利用ELISA技术检验免疫后小鼠的抗体效价,抗体效价合适即可收集小鼠血清。收集的血清用于免疫组织荧光(IHF)试验,探究Hc-FAR-4的表达部位,从而推测其功能。该试验过程为:对捻转血矛线虫进行石蜡包埋,石蜡切片,抗原修复,3%的BSA 于4℃封闭过夜,自制鼠源多克隆抗体作为一抗孵育1 h; Alexa Fluor® 488 nm羊抗鼠IgG作为二抗避光孵育1 h,DAPI染色30 min,激光共聚焦显微镜检查染色情况。利用荧光定量PCR技术分析在捻转血矛线虫各个主要阶段的表达特性。成功克隆目的基因,测序结果与Sanger数据库中捻转血矛线虫基因序列(>HCISE00908800.t1)相似度为 99.9%;重组质粒pET-30a-在BL21中成功表达,在诱导8 h后达到峰值。经过ELISA检测,结果显示制备的鼠源多克隆抗体效价达到1﹕1 024 000—1﹕2 048 000,可用于后续试验。Western Blot鉴定结果显示rHc-FAR-4重组蛋白带有His标签,并且条带大小为25 kD,结果符合预期。制备的鼠源多克隆抗体经过Western Blot鉴定,能够与天然Hc-FAR-4 蛋白结合,说明该抗体可用于IHF试验。配体结合试验结果表明 rHc-FAR-4蛋白具有结合脂肪酸与视黄醇的能力。荧光定量PCR分析表明,在四期幼虫中的转录水平最高;IHF试验表明,Hc-FAR-4主要表达在捻转血矛线虫的肠壁、性腺中。综上推测Hc-FAR-4蛋白主要在寄生生活阶段参与了转运脂肪酸与视黄醇,为捻转血矛线虫的生长发育与生殖提供营养物质。捻转血矛线虫 FAR-4 蛋白能够结合脂肪酸类似物DAUDA和视黄醇,但是与油酸的结合能力较弱,主要表达在肠壁,在性腺、角皮中也有少量表达,其基因在进行营寄生生活阶段时表达量达到峰值。
捻转血矛线虫;;表达特性;配体结合能力;脂肪酸
0 引言
【研究意义】捻转血矛线虫()成虫寄生在牛羊等反刍动物的皱胃中是反刍动物常见的胃肠道线虫之一,属毛圆科()、血矛属(),其引起的捻转血矛线虫病主要症状为贫血、消瘦,感染严重可引起患病动物大批死亡[1-2]。捻转血矛线虫病在我国全国性流行,其感染率为26.4%—80%[3-4]。目前防控捻转血矛线虫病的方法仍是以药物防控为主,但抗药性问题日益凸显[5]。在世界范围内,越来越多的抗药虫株被相继报道[6-8]。因此,需要研发新型抗线虫药,而药物作用靶标的筛选已成为药物开发的主要方向,并且理想的药物靶标通常为病原体感染、存活以及繁殖过程中所必需,而与宿主有明显区别的代谢通路中[9-11]。捻转血矛线虫生长经历两个阶段,第一个是需氧的自由生活阶段,第二个是微氧的寄生生活阶段。这两个阶段生活条件的不同决定了其有不同的能量代谢与脂肪酸代谢方式。这独特的能量代谢方式为新型药物的研发提供了潜在的药物靶位点。【前人研究进展】在线虫体内存在两类特有的与脂结合有关的蛋白,脂肪酸视黄醇结合蛋白(fatty acid- and retinol-binding proteins,FARs)和线虫聚合蛋白抗原(Nematode polyprotein allergens/antigens,NPAs)[12]。其中第一个FAR蛋白是在旋盘尾丝虫()中发现的,其被命名为,之后学者对其结构和功能进行了研究[13-14]。接下来在犬钩口线虫、秀丽隐杆线虫、锡兰钩口线虫等线虫体内相继发现了FAR蛋白[15-17]。直到2009年,框丽萨利用蛋白组学和生物信息学技术分析,才发现在捻转血矛线虫体内也存在FARs蛋白并且预测在捻转血矛线虫体内至少存在6种脂肪酸视黄醇结合蛋白[18]。【本研究切入点】目前对捻转血矛线虫Hc-FAR-4蛋白的功能研究较少,本研究拟利用荧光分析法、荧光定量PCR技术、免疫组织荧光技术对Hc-FAR-4蛋白的生物学功能进行探讨。【拟解决的关键问题】对原核表达的 rHc-FAR-4 蛋白进行体外配体结合试验,确定 rHc-FAR-4 蛋白的脂肪酸与视黄醇结合能力;利用荧光定量PCR技术对捻转血矛线虫生长发育过程中各个时期的转录水平进行检测,并制备鼠源多克隆抗体,对Hc-FAR-4蛋白在捻转血矛线虫中的表达特性进行探讨。研究结果将为进一步研究的生物学功能奠定基础。
1 材料与方法
试验于2017年3月至2018年9月在浙江大学预防兽医研究所寄生虫病理生物学研究室进行。
1.1 虫体、菌株与质粒
捻转血矛线虫ZJ株成虫在桐乡屠宰场获得并由浙江省动物预防医学重点实验室保存;TOP10菌株、BL21(DE3)菌株和 pET-30a(+)vector质粒由本实验室制备并保存;pMD19-T vector质粒购买于TaKaRa。
1.2 试剂与试剂盒
限制性内切酶HI和dIII、T4 DNA连接酶、 LA TaqTM酶等均购自宝生物工程(大连)有限公司(TaKaRa)。DNA 凝胶回收试剂盒、质粒抽提试剂盒购自Axygen 公司。DAUDA购买自Cayman公司。Bio-Rad 蛋白浓度测定试剂盒、Millipore 超滤管(Promega)。Ni-NTA 亲和色谱树脂、考马斯亮蓝购自 Qiagen 公司。油酸、视黄醇、HRP标记的山羊抗小鼠IgG抗体、抗His标签鼠源单克隆抗体、羊抗鼠IgG H&L(Alexa Fluor® 488)均购自美国Sigma公司。
1.3 捻转血矛线虫Hc-far-4 基因的克隆
根据序列设计特异性扩增引物,引物序列为-F:CGCATGATCCGTCCGGTTGCTGCT(下划线HI的识别位点)R:CCCCTAGTTGTTGATCAGCATCCTCGCCT(下划线为dIII的识别位点),生工生物工程(上海)有限公司负责合成。提取捻转血矛线虫成虫 RNA,并反转录为cDNA作为扩增模板,用 LA TaqTM酶进行特异性扩增,PCR 反应程序:95℃ 3 min;95℃ 30 s,60℃ 30 s,72℃ 1 min ,共30个循环;72℃ 10 min。回收并纯化后PCR 产物与pMD19-T载体进行过夜连接,然后转入TOP10 感受态细胞中挑取阳性克隆送到测序公司进行测序分析。
1.4 捻转血矛线虫 Hc-FAR-4 原核表达载体的构建及原核表达
用限制性内切酶HI和dIII同时对测序准确pMD19-T-质粒与原核表达pET-30a 质粒进行双酶切,T4 DNA 连接酶过夜连接,转入TOP10 感受态细胞,挑取阳性克隆进行双酶切鉴定。鉴定准确的原核表达质粒转化至BL21(DE3),挑取阳性克隆,-80℃冻存。保存的BL21菌液1﹕100比例加入600 ml的含卡那霉素的 LB培养液中,37℃恒温摇床培养大概3 h到对数期,OD值0.6。IPTG(1 mol·L-1)按照1﹕1000的比例稀释并添加到600 ml LB液体培养基中,摇床200 r/min,37℃,诱导6 h。在4℃条件下 8 000×g 离心 5 min富集、去上清。用5×PBS缓冲液(pH = 7.4)重悬细菌,冰浴下进行超声波破碎。12 000×g,4℃离心 10 min,收集上清。取10 μL上清进行 SDS-PAGE 电泳检测诱导表达情况。
1.5 捻转血矛线虫 rHc-FAR-4蛋白的分离纯化和Western Blot 鉴定
收集含有 rHc-FAR-4蛋白的上清液,加入镍琼脂糖凝胶柱中,流速约为 1 mL·min-1,过柱3次。用含有不同咪唑浓度的缓冲液进行洗脱,流速约为 2 mL·min-1,收集洗脱液。含有目的蛋白含量最多的洗脱液用超滤管进行超滤除去咪唑并浓缩蛋白,检测蛋白浓度。最后进行Western Blot 鉴定,将纯化后的rHc-FAR-4蛋白经SDS-PAGE电泳后,转至聚偏二氟乙烯膜上,5%脱脂乳(TPST配制)封闭过夜,一抗为抗 His 标签鼠源单克隆抗体(1﹕1 000)室温孵育2 h,二抗为HRP -羊抗小鼠 IgG(1﹕5 000)室温孵育1 h,最后用增强化学发光法(ECL)进行显色。
1.6 重组蛋白与配体的结合能力
根据荧光物质retinol与脂肪酸类似物DAUDA在极性和非极性溶液中,在某一波长的激发光激发下,所发出的荧光光谱随之变化的特性,利用荧光分析法,通过荧光光谱的变化判断rHc-FAR-4蛋白是否具有与DAUDA、retinol结合的能力[18]。再在体系中加入非荧光长链脂肪酸油酸,根据荧光光谱的变化情况判定油酸能否分别与DAUDA、retinol竞争目的蛋白的脂肪酸结合位点,间接说明目的蛋白能否与非荧光脂肪酸油酸结合[19]。用乙醇把DAUDA(Cayman)、油酸(Sigma)、视黄醇(Sigma)配成储存液,浓度为10 mmol·L-1,-20℃保存并且尽快使用。纯化好的蛋白,再用超滤管超滤以除去咪唑。重组蛋白与DAUDA的结合试验分为4个组,一是空白对照组:DAUDA + PBS;二是蛋白配体结合组:DAUDA + rHc-FAR-4 + PBS;三是竞争结合组:DAUDA + rHc-FAR-4 +油酸+ PBS;四是阴性对照组:DAUDA + rTg-PME + PBS。重组蛋白与retinol的结合试验也分为4个组,一是空白对照组:retinol + PBS;二是蛋白配体结合组:retinol + rHc-FAR-4 + PBS;三是竞争结合组:retinol + rHc-FAR-4 + 油酸+ PBS;四是阴性对照组:retinol + rTg-PME + PBS。试验体系为:96孔板中每孔重组蛋白的终浓度为3 μmol·L-1,其他配体的终浓度都为10 μmol·L-1,总体积为100 μL,重复3个复孔,试验重复3次。其中rTg-PME蛋白是来源于弓形虫的一个重组蛋白,其与脂肪酸视黄醇转运无关,故用来做阴性对照。DAUDA由345 nm的激发光进行激发,retinol由350 nm的激发光进行激发[19]。激发之后进行全波长扫描记录发射光谱的变化。实验仪器为荧光酶标仪 Synergy H1(Biotek)。
1.7 不同发育时期表达特性
从浙江桐乡湖羊屠宰场采集湖羊第四胃皱胃,在皱胃壁及胃内容物中挑出捻转血矛线虫成虫。取出捻转血矛线虫雌虫剖开子宫取出虫卵并铺于琼脂板中28℃培养。每天添加适量的D-hank’s液培养。虫卵孵化后为一期幼虫(L1),培养3 d后为二期幼虫(L2),培养7 d后发育为三期幼虫(L3),收集L3幼虫对湖羊进行攻虫,分别剖胃收集四期幼虫(L4)与成虫。收集各个时期的捻转血矛线虫提取RNA并逆转录为cDNA。根据目的基因序列设计荧光定量PCR引物-QF:CGCCTTTGTCTCCTCGTTCA,-QR:CCGTACTTCTTTGCGACCTCC。qRT- PCR(25 μl)使用SYBR Green预混液(TOYOBO)按照说明书进行操作,荧光定量仪为ABI 7300 (Thermo)。荧光定量 PCR 反应程序:50℃ 3 min,95℃ 1 min 1个循环,95℃ 15 s,60℃ 15 s,72℃ 30 s,40个循环,最后一个循环产生熔解曲线。样品设置3个重复,取平均阈值(CT值)进行分析。相对定量计算方法采用CT值比较法。使用Graphpad prism 6.01进行统计分析。内参基因为,其引物序列为:-QF TGTTCCATCACCCAAGGTATCC;-QR TGACAGACACAAGGTGGTTGAGAT。
1.8 多克隆抗体的制备与Western Blot 鉴定
纯化的rHc-FAR-4-His蛋白与弗氏完全佐剂1﹕1混合、手动乳化,免疫昆明小鼠的蛋白用量为50 μg/只,腹部皮下注射进行首次免疫。第7天,将rHc-FAR-4-His蛋白与弗氏不完全佐剂1﹕1混合、手动乳化,终浓度为25 μg/只,腹部皮下注射进行二次免疫。第14天,以同样的方法进行第三次免疫。第21天,采血,ELISA检测血清抗体效价,效价达到要求即可收集血清,-80℃保存。然后进行Western Blot 鉴定,确认制备的鼠源多克隆抗体是否能够特异性识别天然Hc-FAR-4蛋白,并且以鼠源阴性血清作为阴性对照。其过程为,提取捻转血矛线虫全虫蛋白并将全虫蛋白经SDS-PAGE电泳后,转至聚偏二氟乙烯膜上,5%脱脂乳(TPST配制)封闭过夜,一抗为自制鼠源多克隆抗体(1﹕2 000)室温孵育2 h,二抗为HRP -羊抗小鼠 IgG( 1﹕5 000)室温孵育1 h,最后用增强化学发光法(ECL)进行显色。
新闻学产生于19世纪末20世纪初的西方发达资本主义国家。从时间上来看,新闻学还很年轻。但是作为普遍存在的新闻传播活动却早已开始。从最初的口头新闻一直到如今的印刷媒介和电子媒介的新闻,新闻传播经历了漫长的历史过程。美学也有着同样的命运。1750年,德国哲学家鲍姆加登的美学专著《美学》第一卷的出版,使“美学”这一名称逐渐得到了学术界的公认。从此,美学也逐渐成为了一门独立的学科。因此,可以说美学也是一门年轻的学科。但是,人类审美意识和美学思想的历史却十分古老。从考古发现的洞穴壁画到古希腊哲人的思辨再到现如今各种实用美学的兴起,不得不说美学既古老而又年轻。
1.9 石蜡包埋
将捻转血矛线虫雌性四期幼虫用现配的4%多聚甲醛4℃固定 24 h,流水冲洗过夜[20 ]。脱水:50%乙醇溶液脱水30 min、75%乙醇溶液脱水30 min、80%乙醇溶液脱水30 min、95%乙醇溶液脱水30 min、100%Ⅰ乙醇溶液脱水5 min、100%Ⅱ乙醇溶液脱水5 min,逐级脱水。透明:置于二甲苯乙醇(1﹕1)溶液5 min,二甲苯透明 5 min[21-22]。浸蜡:透明好的样品置于液态石蜡中浸泡1—2 h再进行包埋。
1.10 免疫组织荧光
切片:25 μm粗切,切到组织后切换为5 μm细切,将切好的组织放入到42℃的水浴锅中展片,玻片捞取。烤片:切片置于60℃烘箱3—6 h。脱蜡:二甲苯Ⅰ、二甲苯Ⅱ溶液中各浸泡5 min。脱水:酒精逐级脱水。抗原修复:切片烤好后置于0.01 mol·l-1柠檬酸盐缓冲液,开水浴20 min[23]。封闭:3% 的BSA 4℃封闭过夜。一抗孵育:鼠多抗(自制)用PBS 1﹕200 稀释,37℃孵育1 h。洗涤:PBS 缓冲液清洗3次。二抗孵育:Alexa Fluor® 488 nm羊抗鼠IgG用PBS 1﹕400稀释,37℃避光孵育1 h。洗涤:PBS缓冲液清洗3次。核染:DAPI 37℃染色30 min。洗涤:PBS缓冲液清洗3次。封片:激光共聚焦显微镜拍照(Zeiss LSM 780,德国)。
2 结果
2.1 Hc-far-4 基因的克隆及其鉴定
以捻转血矛线虫成虫的cDNA作为扩增模板,进行特异性PCR 扩增片段。1%琼脂糖凝胶电泳结果显示,在500 bp附近有一条清晰的条带(图 1-A)。回收连接后进行测序,结果与 Sanger数据库中公布的序列(>HCISE00908800.t1)相似度为 99.9%。挑选pET-30a-阳性克隆用HI和dIII限制性内切酶进行双酶切鉴定。双酶切后切出一条约500 bp的短片段与约4 000 bp的长片段(图 1-B)。证明已成功转入pET-30a中。

A.Hc-far-4序列扩增结果;B. pET-30a-Hc-far-4酶切鉴定结果。M:DL250 DNA Maker;A-1:Hc-far-4 PCR 产物;B-1:pET-30a-Hc-far-4双酶切产物
2.2 rHc-FAR-4蛋白的表达,纯化及其鉴定
2.2.1 rHc-FAR-4蛋白诱导表达 将含有pET-30a-重组质粒的BL21 扩大培养约600 mL菌液,然后 IPTG在37℃环境中诱导8 h,收集菌,5×PBS(pH7.4)重悬,冰浴条件下超声波破碎,离心收集上清进行SDS-PAGE分析[24](图2)。根据EditSeq软件的蛋白分子量预测与结合pET-30a 质粒图谱推测重组蛋白分子量大小约为25 kD。SDS-PAGE 结果显示蛋白条带大小与推测的结果一致,在上清中表达。

M:蛋白 Marker;1:pET-30a 空白对照;2:pET-30a-Hc-far-4 未诱导阴性对照;3:pET-30a-Hc-far-4 诱导4 h;4:pET-30a-Hc-far-4 诱导6 h;5:pET-30a-Hc-far-4 诱导8 h
2.2.2 rHc-FAR-4蛋白分离纯化及鉴定 rHc-FAR-4 蛋白纯化后用SDS-PAGE进行检测,了解蛋白纯化的情况。经纯化并超滤的 rHc-FAR-4 蛋白如图3-A,蛋白大小为25 kD左右与推测的大小相似。rHc-FAR-4 蛋白以抗His 血清作为一抗进行WB验证,其结果显示该蛋白带有His标签,并且大小与推测的一致约为25 kD(图3-B)。蛋白浓度检测按照试剂盒的操作步骤进行,测得浓缩后rHc-FAR-4 蛋白浓度为2.0 μg·μL-1。
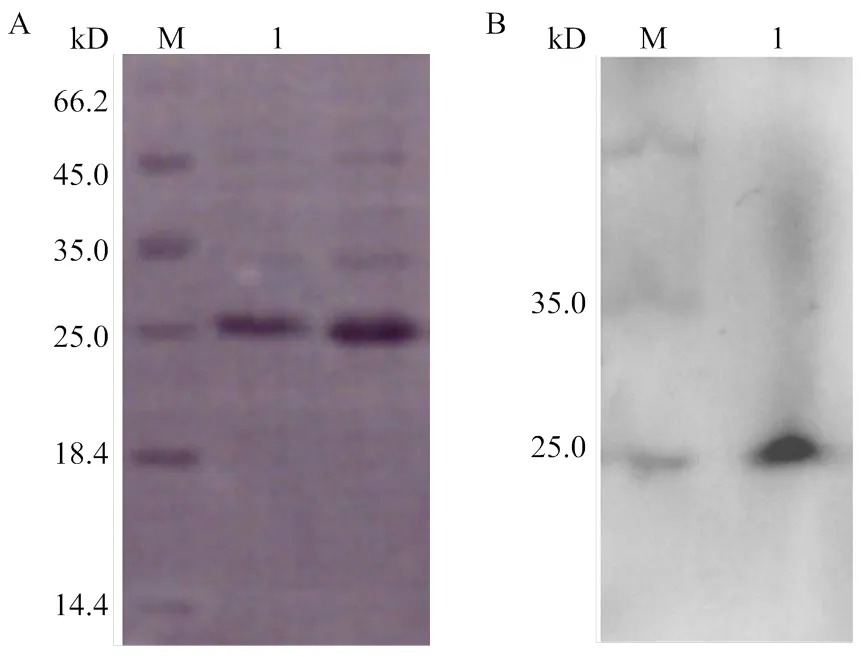
A. Hc-FAR-4重组蛋白的 SDS-PAGE 分析结果;B. rHc-FAR-4 Western Blot 鉴定结果。M:蛋白 Marker;A-1、B-1:rHc-FAR-4 蛋白
2.3 重组蛋白与配体的结合能力
在rHc-FAR-4与DAUDA结合能力的检测中,用 345 nm 激发光激发仅含有 10 μmol·L-1DAUDA 的 PBS 溶液后,发射光谱的波峰位于 570 nm 处,且荧光强度较弱;而当加入 3 μmol·L-1rHc-FAR-4蛋白后,荧光强度对比空白对照组和阴性对照组都明显增强,且波峰移至 488 nm(图4-A);加入油酸和DAUDA竞争与rHc-FAR-4蛋白结合的位点,结果显示加入油酸后荧光强度没有明显变化。在rHc-FAR-4与retinol结合能力的检测中用350 nm 激发光激发PBS+10 μmol·L-1retinol组成的空白对照组,其发射光谱的波峰位于 400 nm 处,且荧光强度较弱,而当加入 3 μmol·L-1rHc-FAR-4蛋白后,发射光谱的波峰右移至420 nm处,荧光强度对比空白对照组增强了但是和阴性对照组的荧光强度差不多;加入油酸和DAUDA竞争与rHc-FAR-4蛋白结合的位点,结果显示加入油酸后荧光强度没有明显变化(图4-B)。
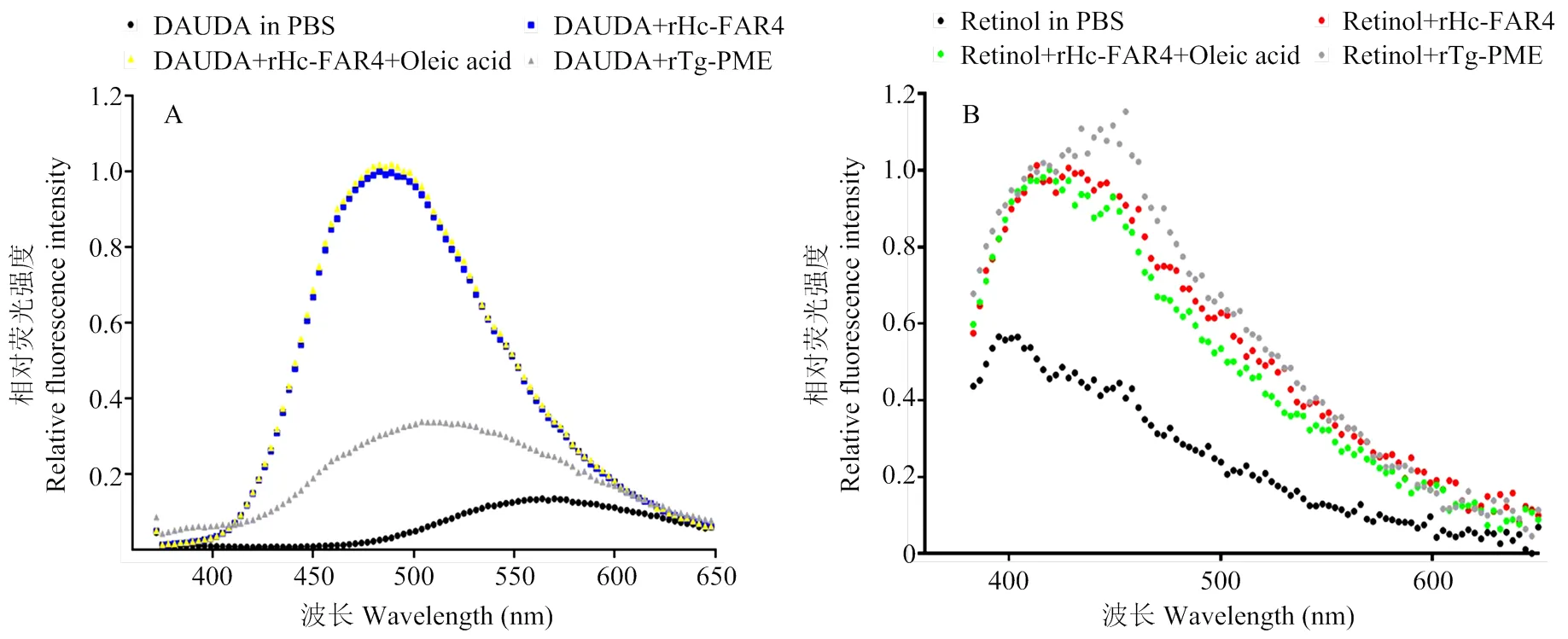
A:DAUDA配体结合试验;B:Retinol配体结合试验
2.4 rHc-FAR-4 鼠多抗的特异性检测
用目的蛋白对昆明小鼠进行三次免疫之后,用间接酶联免疫吸附测定(enzyme-linked immuno-sorbent assay,ELISA)法检测昆明小鼠血清抗体效价,结果显示效价较高达到1﹕1 024 000—1﹕2 048 000,可用于后续试验。收集的多克隆抗体利用Western blot方法鉴定其与全虫蛋白的亲和性,并用鼠阴性血清作为对照(图5)。结果显示制备的多克隆抗体能够识别捻转血矛线虫全虫蛋白中的天然Hc-FAR-4蛋白,条带约为20 kD,比重组蛋白小一些。
2.5 不同发育时期表达特性

A:制备的鼠源多克隆抗体作为一抗;B:鼠源阴性血清作为一抗。M:蛋白marker,A-1、B-1:捻转血矛线虫全虫蛋白

图6 Hc-far-4 在各个时期的转录水平
2.6 免疫组织荧光
为了确定Hc-FAR-4的表达部位,收集转录水平最高的时期即L4期雌虫进行石蜡包埋与切片,然后进行免疫组织荧光染色。由试验结果可以看出Hc-FAR-4的表达部位主要集中在捻转血矛线虫的肠壁中,在其性腺、角皮也有少量表达(图7)。
3 讨论
捻转血矛线虫的生活史存在两个阶段,自由生活阶段与寄生生活阶段。其在寄生生活阶段的营养物质摄取涉及自身能否在宿主体内生存和能否满足自身繁殖需要,所以在营养物质的摄取特别是在寄生生活阶段的营养物质摄取显得尤为重要。其在摄取的营养物质中脂肪酸与视黄醇的吸收与转运意义重大。因为线虫体内缺乏脂肪酸和视黄醇的从头合成能力,因此需要从寄主或环境中获取这些物质,为体内的脂类合成或其它生理活动提供底物和能量[17, 25]。脂结合蛋白历来受到科研人员的重视,其可能对宿主组织进行修饰从而使寄生虫逃避宿主的免疫;除此之外由于脂肪酸视黄醇不易溶于水,而且容易氧化,在游离状态下会对细胞膜造成损害,所以脂肪酸、视黄醇的运输一般都是与脂蛋白结合再进行转运的[19]。脂结合蛋白能够结合宿主体内的视黄醇和长链脂肪酸,促进寄生虫对这些营养物质的吸收,弥补寄生线虫合成长链脂肪酸能力的不足[26]。
本次研究采用了荧光分析法,首次分析了捻转血矛线虫rHc-FAR-4与DAUDA和视黄醇的结合情况,并且对试验方法进行了改良。仪器使用荧光酶标仪H1而不是紫外分光光度计,使试验更加简单便捷的同时,根据配体结合试验中空白对照组DAUDA与retinol的发射光谱进行分析,发现其光谱的峰值分别在570 nm和400 nm处,与文献报道的发射光谱趋势一致[19,25],说明试验方法的改良取得成功。在检验rHc-FAR-4能否与DAUDA结合的试验中,蛋白配体结合试验组荧光强度峰值对比空白对照组和阴性对照组的荧光强度峰值都明显增强,且波峰移至 488 nm(图4-A),这现象说明 rHc-FAR-4蛋白能够结合 DAUDA且结合能力要比rTg-PME强。而蛋白结合试验组与竞争结合试验组的荧光发射光谱并没有明显的差别,说明油酸无法把DAUDA从rHc-FAR-4蛋白结合位点中置换出来,从而说明rHc-FAR-4与油酸的结合能力较弱。在检验rHc-FAR-4能否与retinol结合的试验中,蛋白配体结合试验组荧光强度峰值比空白对照组强且波峰移至420 nm处(图4-A),但是和阴性对照组无明显差别,说明rHc-FAR-4能够与retinol结合,但是结合能力较弱,与rTg-PME的结合能力相近。蛋白结合实验组与竞争结合试验组的荧光发射光谱并没有明显的差别,说明油酸无法把retinol从rHc-FAR-4蛋白结合位点中置换出来,再次验证rHc-FAR-4与油酸的结合能力较弱。这研究结果与脂结合蛋白能够结合宿主体内的视黄醇和长链脂肪酸促进寄生虫对这些营养物质的吸收以弥补寄生线虫合成长链脂肪酸能力的不足,并为体内的脂类合成或其它生理活动提供底物和能量等结论相符[17,25-26]。
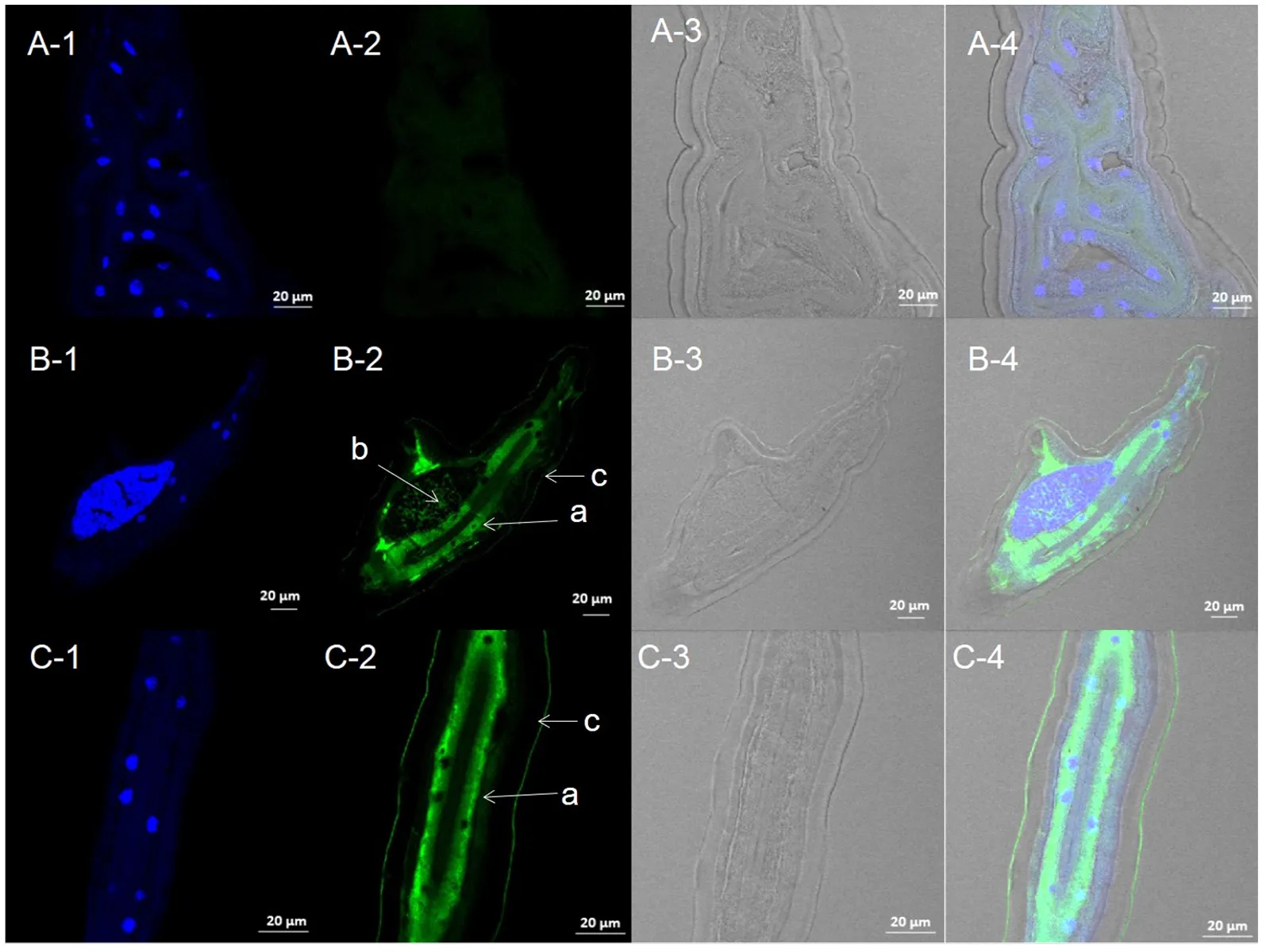
A:阴性对照;B:虫体横切;C:虫体纵切。a:肠壁;b:性腺;c:角皮;列1:DAPI核染色;列2:异硫氰酸荧光素信号;列3:透射光拍照;列4:图片组合
通过荧光定量PCR技术检测了捻转血矛线虫各个发育时期虫体中的转录水平,发现其在营自由生活的虫卵、L1、L2阶段表达量很低,但是在开始营寄生生活前期即L3阶段开始显著增加,在营寄生生活的L4阶段达到峰值,在营寄生生活的成虫阶段表达量也相对较高。说明Hc-FAR-4蛋白在捻转血矛线虫的入侵宿主的过程中扮演重要角色。这与研究报道中的脂结合蛋白能对宿主组织进行修饰从而使寄生虫逃避宿主免疫的推测相吻合[27-28]。
在此之前对捻转血矛线虫体内蛋白定位都是对L1—L3幼虫进行免疫荧光定位的[29-31],因为这些时期的幼虫生活在体外,容易培养与获得。但是存在以下几个弊端:一是有的蛋白在这几个时期表达量不高甚至不表达故无法检测;二是由于捻转血矛线虫虫体有厚厚的鞘所包裹,即使有脱鞘的方法,但是存在较难脱鞘或者是脱鞘不完全情况;三是即使脱掉鞘,进行免疫荧光定位也无法准确指出所表达的具体部位。本次试验对试验方法进行改良,对四期幼虫、成虫甚至L3期幼虫虫体进行石蜡包埋,切片,进行IHF试验,就能探究蛋白在这些时期的表达部位。并且根据组织形态的不同,可以较为准确地指出蛋白的具体表达部位。本试验选择了转录水平最高的四期雌性幼虫进行包埋,探究Hc-FAR-4在这个时期虫体中的定位。在纵切组图与横切组图中,可以看到绿色荧光物质标记了的羊抗鼠二抗主要结合在捻转血矛线虫的肠壁,少量结合在性腺、角皮且对照组并没有发现绿色荧光,说明制备的鼠源多抗能够特异性结合捻转血矛线虫体内的Hc-FAR-4蛋白。推测Hc-FAR-4蛋白主要参与了营寄生生活阶段的脂肪酸与视黄醇的转运,为捻转血矛线虫的生长发育与生殖提供营养物质,同时Hc-FAR-4蛋白在角皮也有表达,可能与防止捻转血矛线虫机体被宿主体内游离的脂肪酸、视黄醇所损伤有关。
4 结论
本研究利用BL21对进行了原核表达,配体结合试验结果表明该重组蛋白rHc-FAR-4能够结合脂肪酸类似物DAUDA和视黄醇,但是与油酸的结合能力较弱。IHF结果表明Hc-FAR-4蛋白主要表达在肠壁,在性腺、角皮中也有少量表达。荧光定量PCR结果显示在进行营寄生生活阶段表达量达到峰值。
[1] WANG C R, QIU J H, ZHU X Q, HAN X H, NI H B, ZHAO J P, ZHOU Q M, ZHANG H W, LUN Z R. Survey ofin adult sheep in Heilongjiang Province, People's Republic of China., 2006, 140: 378-382.
[2] BESIER R B, KAHN L P, SARGISON N D, WYK J A V. The pathophysiology, ecology and epidemiology ofinfection in small ruminants., 2016, 93: 95-143.
[3] 沈效平. 湖南山羊捻转血矛线虫感染调查及 rDNA ITS遗传差异分析[D]. 长沙: 湖南农业大学, 2013.
SHEN X P. Investigating prevalence and researching genetic differences of rDNA ITS offrom goat in Hunan[D]. Changsha: Hunan Agricultural University, 2013. (in Chinese)
[4] 解晓钰. 博州地区羊消化道寄生虫感染调查及冬季驱虫试验研究[D]. 乌鲁木齐: 新疆农业大学, 2009.
XIE X Y. Investigation on the infection of digestive parasites in sheep in Bo-zhou area and winter expel parasites experiment study[D]. Wurumuqi: Xinjiang Agricultural University, 2009. (in Chinese)
[5] 吴震洋, 冉辉, 朱天钧, 李丽. 羊捻转血矛线虫病防控研究进展. 安徽农学通报, 2017(8): 123-124.
WU Z Y, RAN H, ZHU T J, LI L. Advances in the prevention and control ofin sheep.2017(8): 123-124. (in Chinese)
[6] KOTZE A C, PRICHARD R K. Chapter nine–anthelmintic resistance in: history, mechanisms and diagnosis., 2016, 93: 397-428.
[7] ALBUQUERQUE A C A D, BASSETTO C C, ALMEIDA F A D, ALESSANDRO F T A. Development ofresistance in sheep under suppressive or targeted selective treatment with monepantel.2017, 246: 112-117.
[8] LEITE D S, MONTEIRO J, RIBEIRO C, MACEDO F, FILHO A, ANDRE P. High levels of benzimidazole resistance and beta-tubulin isotype1 SNPF167Y inpopulations from Ceara State, Brazil., 2016, 146: 48-52. doi: 10. 1016/j. smallrumres. 2016. 11. 023.
[9] KEARNEY P E, MURRAY P J, HOY J M, HOHENHAUS M, KOTZE A. The ‘Toolbox’ of strategies for managingin goats: What’s in and what’s out.2016, 220: 93-107.
[10] CAMPBELL B E, BOAG P R, HOFMANN A, CANTACESSI C, WANG C K, TAYLOR P. Atypical (rio) protein kinases frompromise as new targets for nematocidal drugs.2011, 29(3), 338-350.
[11] 郑秀平, 丁豪杰, 郭筱璐, 杨怡, 黄艳, 陈学秋, 周前进, 杜爱芳. 捻转血矛线虫基因的原核表达及重组蛋白酶活性测定. 中国农业科学, 2017, 50(8): 1535-1542.
ZHENG X P, DING H J, GUO X L, YANG Y, HUANG Y, CHEN X Q, ZHOU Q J, DU A F. Characteristics ofgene fromcrokaryotic expression and its enzymatic activity., 2017, 50(8): 1535-1542. (in Chinese)
[12] KUANG L, COLGRAVE M L BAGNALL N H, KNOX M R, QIAN M, WIJFFELS G. The complexity of the secreted NPA and FAR lipid-binding protein families ofrevealed by an iterative proteomics-bioinformatics approach., 2009, 168(1): 84-94.
[13] TREE T I M, GILLESPIE A J, SHEPLEY K J, BLAXTER M L, TUAN R S, BRADLEY J E. Characterisation of an immunodominant glycoprotein antigen of, with homologues in other filarial nematodes and., 1995, 69(2): 185-195.
[14] KENNEDY M W, GARSIDE L H, GOODRICK L E, MCDERMOTT L, BRASS A, PRICE N C, KELLY S M, COOPER A, BRADLEY J E. The Ov20 protein of the parasitic nematode: A structurally novel class of small helix-rich retinol-binding proteins., 1997, 272 (47): 29442-294488.
[15] BASAVARAJU S V, ZHAN B, KENNEDY M W, LIU Y, HAWDON J, HOTEZ P J. Ac-FAR-1, a 20 kDa fatty acid- and retinol-binding protein secreted by adulthookworms: gene transcription pattern, ligand binding properties and structural characterisation., 2003, 126 (1): 63-71
[16] GAROFALO A. The FAR protein family of the nematode. Differential lipid binding properties, structural characteristics, and developmental regulation., 2003a, 278 (10): 8065-8074.
[17] FAIRFAX K C, VERMEIRE J J, HARRISON L M, BUNGIRO R D, GRANT W, HUSAIN S Z, CAPPELLO M. Characterisation of a fatty acid and retinol binding protein orthologue from the hookworm.2009, 39(14): 1561-1571.
[18] WANG Y, LUO Z, SHI X, LUO Z P, SHI X L, WANG H, NIE L, HUANG M D. A fluorescent fatty acid probe, DAUDA, selectively displaces two myristates bound in human serum albumin., 2011, 20(12): 2095-2101.
[19] FLORENCIA R B, GABRIELSEN M, FRANCHINI G R. Diversity in the structures and ligand-binding sites of nematode fatty acid and retinol-binding proteins revealed byfrom., 2015, 471(3): 403-414.
[20] ZHANG L, MOU L, CHEN X, YANG Y, HU M, LI X R, SUO X , ZHU X Q, DU A F. Identification and preliminary characterization of, a novel C-type lectin domain-containing gene of the strongylid nematode., 2018, 11(1): 430.
[21] 梁忠泉, 袁昌隆, 张宝贺. 微小组织石蜡切片制作体会. 中国组织化学与细胞化学杂志, 2018(04): 368-373. https://doi. org/10. 16705/j. cnki. 1004-1850. 2018. 04. 012.
LIANG Z Q, YUAN C L, ZHANG B H. Experience in making paraffin sections of microtissues., 2018(04): 368-373. https: //doi. org/10. 16705/ j. cnki. 1004-1850. 2018. 04. 012. (in Chinese)
[22] 刘慧军, 杨海明, 胥蕾, 张李荣, 王志跃. 畜禽肠道组织H. E. 染色石蜡切片制作要点及关键技术. 黑龙江畜牧兽医, 2018(15): 206-210.
LIU H J, YANG H M, XU L, ZHANG L R, WANG Z Y. Key points and key techniques for the preparation of he. staining paraffin sections of animal and poultry intestinal tissues., 2018(15): 206-210. (in Chinese)
[23] 范瑾瑾, 骆宁, 彭文兴, 毛海萍. 石蜡切片多重免疫荧光染色优化条件探讨. 中山大学学报(医学版), 2018, 39(05): 675-681.
FAN J J, LUO N, PENG W X, MAO H P. Discussion on optimal conditions for multiple immunofluorescence staining of paraffin sections.(medical edition), 2008, 39(05): 675-681. (in Chinese)
[24] 阳毅敏, 潘灵韬, 庄浩瀚, 孙洪超, 杨怡, 陈学秋, 杜爱芳. 微小隐孢子虫黏蛋白CGD5_2060原核表达及其黏附功能. 浙江大学学报(农业与生命科学版), 2018, 44(2): 230-236.
YANG Y M, PAN L T, ZHUANG H H, SUN H C, YANG Y, CHEN X Q, DU A F. Prokaryotic expression ofCGD5_2060 and its role in adhesion., 2018, 44(2): 230-236. (in Chinese)
[25] 罗丽莲. 小麦孢囊线虫脂肪酸和视黄醇结合蛋白基因的克隆及表达分析[D]. 武汉: 华中农业大学, 2015.
LUO L L. Cloning and expression analysis of fatty acid and retinol-binding protein genes ofnematode [D]. Wuhan: Huazhong agricultural university, 2015. (in Chinese)
[26] KENNEDY M W. The polyprotein lipid binding proteins of nematodes.2000, 1476(2): 149-164.
[27] RATHORE D K, SUCHITRA S, SAINI M. Identification of a 66kDaexcretory/secretory antigen that inhibits host monocytes.2006, 138(3): 291-300.
[28] ANBU K A, JOSHI P. Identification of a 55 kDaexcretory/secretory glycoprotein as a neutrophil inhibitory factor.2010, 30(1): 23-30.
[29] DING H, SHI H, YU S, GUO X L, ZHENG X P, CHEN X Q , ZHOU Q J, YANG Y, DU A F. Characterization and function analysis of a novel gene,, in the parasitic nematode., 2017, 10(1): 67.
[30] 郭晓璐.基因参与捻转血矛线虫发育过程调控机制[D]. 杭州: 浙江大学, 2017.
GUO X L. The regulatory mechanism of hc-dhs-28 gene involved in the development process of[D] Hangzhou: Zhejiang university, 2017. (in Chinese)
[31] 张玲.基因克隆及其在捻转血矛线虫生长发育和繁殖过程中的调节作用[D]. 杭州: 浙江大学, 2018.
ZHANG L. Cloning ofgene and its regulatory role in the growth, development and reproduction of[D]. Hangzhou: Zhejiang university, 2018. (in Chinese)
The Expression Pattern and Ligand Binding Ability of Hc-FAR-4 Protein of
WEI HaiDian, CHEN XueQiu, HUANG Yan, SHI HengZhi, ZHOU JingRu,WU Fei, DU AiFang, YANG Yi
(College of Animal Science, Zhejiang University/Key Laboratory of Animal Preventive Medicine of Zhejiang Province, Hangzhou 310058)
【】is a parasite mainly settled in the abomasum mucosa of small ruminants. The disease caused byis a national epidemic in China. In this paper, the expression pattern and ligand binding ability of Hc-FAR-4 were studied to understand its role in the growth, development and reproduction of【】The prokaryotic expression vector pET-30a-was constructed, which was identified by PCR and enzyme digestion identification, and then, the recombinant plasmid was transformed intoBL21. The recombinant protein was induced by 0.1 mmol·l-1IPTG (isopropyl-β-d-thiogalactoside). The recombinant protein rHc-FAR-4 was collected and was identified by Western Blot. Fluorescence analysis method, and then, which was used to study the binding ability of Hc-FAR-4 protein with DAUDA, retinol, and oleic acid. The IHF experiment was based on the fluorescent material retinol and fatty acid analogues DAUDA in polar or nonpolar solution, and their excitation spectra characteristics would change when they were excitated by a certain wavelength of exciting light. Using fluorescence analysis method, we could estimate whether rHc-FAR-4 protein contained the ability to bind with DAUDA and retinol by the change of the excitated spectra. When non-fluorescent oleic acid was added into the system, it would compete with DAUDA and retinol to bind with the bind site of rHc-FAR-4 protein, and which would make excitated spectral change, too. According to the changes, we could indirectly judge whether rHc-FAR-4 protein could bind with non-fluorescent oleic acid. At the same time, polyclonal antibodies were prepared by using rHc-FAR-4 protein to immunize mice, and the antibody titer of the immunized mice was tested by ELISA. The serum of the immunized mice would be collected if the antibody titer was appropriate. The collected serum was used in the immunofluorescence (IHF) experiment to explore the expression site of Hc-FAR-4 protein to speculate its function in. The IHF experiment process was as follow: Thewas embedded in paraffin; the paraffin wascut into slices; Antigen was repaired; the slices was incubated by 3% BSA at 4℃ for one night; slices was incubated by anti-Hc- FAR-4 mouse antibody and Alexa Fluor® 488 nm goat anti-mouse IgG antibody for 1 h, and which was done as primary and secondary antibody,respectively; after staining by DAPI, the slices were observed by confocal microscopy. What’smore, the qPCR technology was used to analyze the expression characteristics of【】The target genewas successfully cloned. The recombinant plasmid pET-30a-was successfully expressed inBL21. The recombinant plasmid pET-30a-Hc--4 was successfully expressed inBL21, and the expression level of rHc-FAR-4 protein reached peak after induction for 8h. The result of ELISA showed that the titer of mouse polyclonal antibody was 1:1 024 000—1:2 048 000, which could be used in the following experiments. Western Blot result showed that the rHc-FAR-4 protein contained His tag and the band size was 25 kD, which was consistent with the prediction. The mouse polyclonal antibody was identified by Western Blot and could bind to natural Hc-FAR-4 protein, indicating that the antibody could be used in IHF experiment. The results of ligand binding experiments of rHc-FAR-4 showed that rHc-FAR-4 could bind to fatty acids and retinol. The qPCR analysis showed thatreached the highest transcription level in the fourth stage larvae. Immunohistofluorescence assay showed that Hc-FAR-4 was mainly expressed in the intestinal wall and gland of. To sum up, it could be speculated that Hc-FAR-4 protein might be involved in the transport of fatty acids and retinol, and provided nutrients forto ensure its normal growth, development and reproduction; what,s more, Hc-FAR-4 protein maybe also involved in the process of modifying host tissues to enable the parasite to escape the immunity of host.【】rHc-FAR-4 could bind to DAUDA and retinol, and which was mainly expressed in the intestinal wall, cuticle and gonad. The transcription level ofreached the peak in the fourth stage larvae.
;; expression pattern; ligand binding capacity; fatty acids

10.3864/j.issn.0578-1752.2019.17.013
2018-12-06;
2019-02-26
国家重点研发计划(2017YFD0501200)、国家重点基础研究发展计划(973计划)(2015CB150300)、国家自然科学基金(31602041)
韦海典,E-mail:757559545@qq.com。通信作者杨怡,E-mail:yangyi0607@zju.edu.cn
(责任编辑 林鉴非)
