多溴联苯醚-47对淡水背角无齿蚌热休克蛋白基因表达的影响
2019-09-23薛士鹏宋国英于瑞雪刘庆春王中晓张庆远李冰洁夏西超
王 涵,张 珊,薛士鹏,宋国英,于瑞雪,刘庆春,王中晓,张庆远,刘 丽,李冰洁,夏西超,
(1.南阳医学高等专科学校基础医学部,河南南阳 473061;2.平顶山学院医学院,河南平顶山476000)
热休克蛋白(HSP)是一个超基因家族,在调节机体应激反应和耐受性方面发挥重要作用[1,2]。在正常和应激条件下,HSP帮助蛋白质折叠、膜转位、错误折叠蛋白质降解等方面具有积极作用[3,4]。根据其分子量不同,HSP可以分为HSP100、HSP90、HSP70、HSP60和小分子HSP20等5个家族。HSP60是最为保守且研究相对广泛的家族之一,当生物细胞或个体受到物理、 化学、重金属、有机污染物、病原物等因素胁迫时,HSP60 参与热激反应中的蛋白质合成、线粒体DNA代谢、细胞内多肽折叠、受损线粒体蛋白运输等重要生理过程,以自发减少机体损伤[5,6]。多溴联苯醚(PBDE)是常见淡水持久性有机污染物,具有持久性和高生物蓄积的特点,已经引起学者的极大关注[7]。PBDE-47是水体中最丰富的有机污染物,其生物毒性显著强于其他溴化化合物[8]。前期研究表明,PBDE-47处理可能导致淡水背角无齿蚌(Anodontawoodiana)机体应激反应和急性毒性效应,具体机制有待进一步探究[8]。在本研究中,从背角无齿蚌中克隆出AwHSP60完整基因序列,通过real-time PCR分析AwHSP60表达,为揭示PBDE-47毒性效应奠定理论基础。
1 材料与方法
1.1 背角无齿蚌处理
实验用背角无齿蚌购自南阳市水产市场(壳长6.5±0.5 cm),实验室自动水循环系统中养殖2周。PBDE-47购自Sigma-Aldrich(Sigma-Aldrich,St.Louis,MO),溶解于二甲亚砜(DMSO)中以制备储备液。动物处理实验在长方形塑料盒(40 cm×25 cm;10 cm 高)中进行,饲养采用人工模拟池塘水(每1 L去离子水中含48 mg NaHCO3、33 mg CaCl2·2H2O、60 mg MgSO4·7H2O和0.5 mg KCl)[8]。将来自同一塑料盒5只动物进行解剖,取斧足、鳃、肝胰脏、闭壳肌、心脏、血淋巴和外套膜等组织,并迅速放入液氮保存,用于RNA提取。用同样的方法,将80只河蚌随机饲养于10个塑料盒中,8只/盒,分为对照组和PBDE-47处理组,每组5个盒子。PBDE-47 处理组采用3.36 μg/L的PBDE-47进行处理,对照组用同体积DMSO处理,水中DMSO浓度不超过3‰。第0、1、3、6、9、12 和 15 d从每组中取出5只河蚌,解剖肝胰脏、鳃和血淋巴,液氮速冻,于-80 ℃保存。
1.2 总RNA提取和cDNA第一链的合成
总RNA提取采用TRIzol试剂(宝生物生物有限公司,大连),1.2%琼脂糖凝胶电泳检测RNA质量,具有完整mRNA条带的RNA用于合成cDNA,M-MLV试剂盒合成第一链cDNA,用作PCR反应模板[8]。
1.3 背角无齿蚌AwHSP60核心片段的扩增
简并引物AwHSP61和AwHSP62分离AwHSP60 cDNA保守区域片段,反应条件:94℃ 4 min,1cycle;94℃ 40s,48℃ 40s,72℃ 50s,32cycles;72℃ 10min,1cycle。PCR产物连接至pMDT-19载体,双向测序、NBCI比对确定为HSP60核心片段。确定HSP60部分cDNA序列后,根据部分cDNA序列设计的特异性引物(表1),按照试剂盒要求,5′Race Outerprimer和AwHSP60-5-1进行第一次扩增,以反应产物为模板,反应条件为:94℃ 4min 1cycle;94℃ 40s,58℃ 40s,72℃ 50s,20 cycles;72℃ 10min,1cycle。5′Race Innerprimer和AwHSP60-5-2进行第二次扩增,反应条件为:94℃ 4min 1cycle;94℃ 40s,60℃ 40s,72℃ 50s,30cycles;72℃ 10min,1cycle。3′Race Outerprimer和AwHSP60-3-1进行第一次扩增,以反应产物为模板,反应条件为:94℃ 4min 1cycle;94℃ 40s,58℃ 40s,72℃ 50s,20cycles;72℃ 10min,1cycle。3′Race Innerprimer和AwHSP60-3-2进行第二次扩增,反应条件为:94℃ 4min 1cycle;94℃ 40s,60℃ 40s,72℃ 50s,30cycles;72℃ 10min,1cycle。扩增AwHSP60 cDNA5′和3′区域序列进行双向测序,5′RACE和3′RACE的PCR产物用DNAMAN软件进行拼接。
1.4 序列和系统发育分析
分析AwHSP60序列,通过GenBank 数据库搜索(www.ncbi.nlm.nih.gov/blast)进行BLAST程序比对;根据http://www.cbs.dtu.dk/services/SignalP 预测信号肽;采用Simple Modular Architecture Research Tool(http://smart.embl-heidelberg.de/)预测蛋白质结构域;使用DANMEN分析程序对AwHSP60基因进行多序列比对;通过Swiss-model(http://swissmodel.expasy.org/)预测;AwHSP60的蛋白质三维结构;使用MEGA5.0软件构建系统进化树。

表1 PCR扩增引物序列Tab.1 PCR amplified primer sequences
1.5 AwHSP60 mRNA水平定量检测
为了确定AwHSP60转录水平,采用SYBR Premix Ex TaqTM试剂盒并按照要求进行定量分析。β-actin作为内参基因,根据AwHSP60-F和AwHSP60-R引物常用PCR仪中分离靶基因(表1),琼脂糖凝胶电泳仅检测出一个条带,PCR产物测序,序列鉴别。使用ABI7500实时检测系统(Applied Biosystems,美国)进行real-time PCR,20 μL体系中包括:SYRB Premix ExTaqTM(TaKaRa)10 μL,PCR上下游引物(10 μmol/L)各0.4 μL,cDNA模板2 μL,ROX Reference Dye(TaKaRa)0.4μL,dH2O 6.8μL。反应条件:95℃ 30s, 1cycle;95℃ 5s,60℃ 34s, 40cycles,通过2-△△CT分析AwHSP60表达水平。
1.6 统计学分析
采用SPSS10.0统计软件,AwHSP60 基因表达水平以±s表示,假设检验采用单因素方差分析(ANOVA),组间多重比较采用SNK法,以P<0.05为差异有统计学意义。
2 结果
2.1 背角无齿蚌AwHSP60基因cDNA序列和预测蛋白质序列分析
AwHSP60 cDNA序列由1 940 bp核苷酸序列组成,包含一个69 bp的5′-端非编码区、167 bp的3′-端非编码区和一个1 704 bp的开放阅读框。开放阅读框由一个568个氨基酸组成的多肽,分子量为61.03 kDa,等电点为5.91(图1)。终止信号(AATAAA)位于3′-端非编码区的2 000-2 005位点位置(图1)。AwHSP60氨基酸序列包线粒体定位靶序列(1-MYRLPSILRPVLTRHLAPCLSRAY-24)、HSP60 家族标签序列(428-AAVEEGIVPGGG-439)、三个ATP/ADP 结合位点(52-TMGPKG-57,74-DG VTVAKGI-8,193-RDGVITVKDGKTLHDELEV-210)、Mg2+结合位点(107-AGDGTTAATVL-117),3′末端典型GGM重复基序和负责从中间结构域到顶部转位区(213-EGMKFDRGYISPYFINTQKG-232)等HSP60家族多个保守结构域(图 1)。
2.2 背角无齿蚌AwHSP60 的进化关系
BLAST结果表明,AwHSP60氨基酸序列与其他HSP60家族成员亲缘关系较近,AwHSP60氨基酸序列与淡水三角帆蚌、光滑双脐螺和加州海兔同源性分别为97.71%、80.21%和76.95%。此外,AwHSP60氨基酸序列与模式生物之间也存在高度同源性,与人、小鼠、斑马鱼和果蝇同源性分别为75.74%、76.27%、73.91%和71.18%。从脊椎动物和无脊椎物种选择不同 HSP60家族成员,通过MEGA5.0邻接法构建系统发育树,分析AwHSP60的进化关系。AwHSP60进化上与双壳类和腹足纲动物亲缘关系最近,鱼类和哺乳动物次之,甲壳动物较远,细菌亲缘关系最远(图2)。
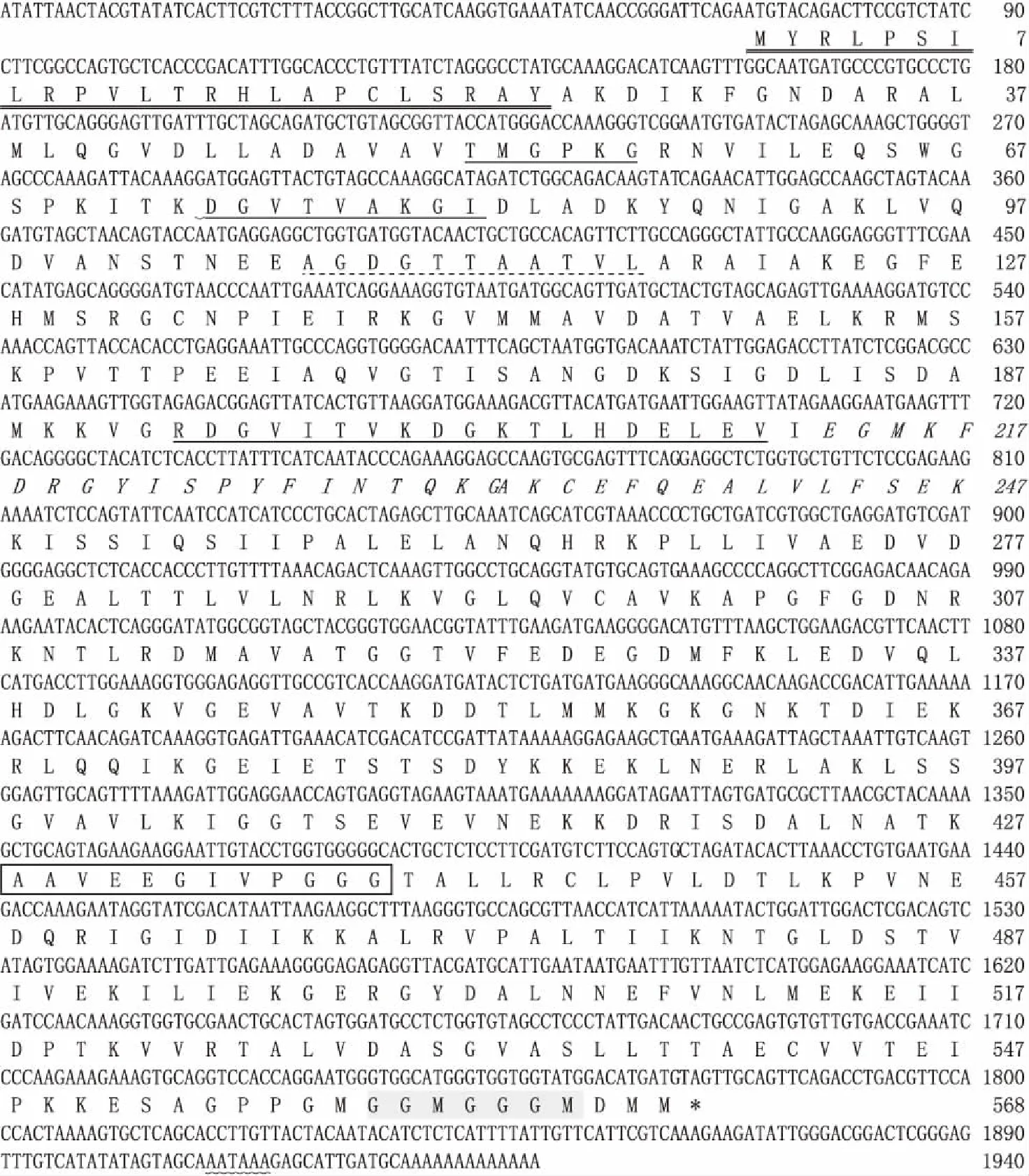
图1 背角无齿蚌AwHSP60基因的cDNA序列和推导的氨基酸序列Fig.1 The cDNA sequences of A.woodiana AwHSP60 gene and deduced amino acid sequences□:HSP60基因标签序列,—:ATP/ADP 结合位点,:线粒体定位序列,……:Mg2+ 结合位点,*:终止密码子,:poly A信号序列
2.3 背角无齿蚌AwHSP60组织分布
Real-timePCR结果显示,AwHSP60广泛表达于背角无齿蚌的斧足、鳃、心脏、肝胰脏、血淋巴、闭壳肌和外套膜(图3)。AwHSP60 mRNA在肝胰脏和鳃中表达水平最高,血淋巴、外套膜和心脏表达水平次之,斧足和闭壳肌中表达水平最低(图 3)。
2.4 PBDE-47 对背角无齿蚌AwHSP60 表达的影响
正常情况下,AwHSP60在动物肝胰脏、鳃和血淋巴稳定表达,PBDE-47处理组后 AwHSP60表达受到显著影响。在第1 d至15 d,PBDE-47处理后肝胰脏中AwHSP60 mRNA水平随时间显著上调(图4);与对照组相比,AwHSP60 mRNA水平在第1d增加了89.9%;第15天,AwHSP60 mRNA水平增加了6.73倍(图4)。与对照组相比,PBDE-47处理后鳃中AwHSP60 mRNA水平在第1天至15天增加了2.09 倍(P<0.01)(图 5)。与对照组相比,PBDE-47处理后血淋巴中 AwHSP60 mRNA水平增加了2.13倍(P<0.05)(图 6)。

图2 根据背角无齿蚌AwHSP60氨基酸序列使用邻接法构建的系统进化树Fig.2 Phylogenetic tree constructed by adjacency method which according to the A.woodiana AwHSP60 amino acid sequences

图3 背角无齿蚌AwHSP60基因的空间表达Fig.3 The spatial expression of A.woodiana AwHSP60 gene每组数据来源于3只动物,重复3次
3 讨论
背角无齿蚌属于淡水底栖生物,以水体的悬浮物质为食物进行滤食生活,是水体污染重要评价生物之一。本研究中,通过分析背角无齿蚌肝胰脏、鳃和血细胞中AwHSP60基因的转录水平,探讨暴露PBDE-47毒性作用机制 。

图4 PBDE-47对背角无齿蚌肝胰腺AwHSP60基因表达的影响Fig.4 The effection of PBDE-47 on A.woodiana hepatopancreas AwHSP60 gene expressionn=5;“*”“**”表示与相应对照组相比有显著或极显著差异(P<0.05,P<0.01),图5,6同
AwHSP60 有一个连续性开放阅读框,包括ATP结合结构域、转换区域和保守结构域。对于多数基因而言,蛋白序列通常与无脊椎动物、植物和细菌存在较高的相似性[9,10]。AwHSP60蛋白序列与软体动物、脊椎动物、甲壳动物和昆虫具有高度同源性,其蛋白质不稳定指数为29.23(<40),提示AwHSP60具有高度稳定性,并排除来自原核生物的可能性。AwHSP60中有一个高度保守的线粒体靶定位序列,提示AwHSP60可能是一个线粒体分子伴侣[11,12]。在 C 末端区域,AwHSP60有一个GGM重复序列,该结构能够提供疏水作用表面,在促进折叠中间体重排过程中发挥积极作用[13,14]。基于AwHSP60与 HSP60家族成员之间存在高度保守相似性,AwHSP60可能在应激环境条件下新生蛋白质折叠过程中发挥作用。序列比对和系统进化分析结果表明,从软体动物到昆虫,到脊椎动物,HSP60结构和进化谱系高度保守。背角无齿蚌和三角帆蚌HSP60基因存在更为亲近进化关系,提示这两个物种来自同一祖先。AwHSP60进化上与双壳类和腹足纲动物亲缘关系最近,鱼类和哺乳动物次之,甲壳动物较远,细菌亲缘关系最远,提示双壳类和腹足纲动物从无脊椎动物分离出来后形成了一个新的分支。背角无齿蚌AwHSP60 mRNA水平具有广泛的分布模式,这种分布模式与AwHSP60参与的环境适应性和耐受性相关。肝胰脏是软体动物主要消化、吸收和分泌器官,对环境变化特别敏感[15]。鳃是环境中污染物进入机体主要入口,并能与其直接接触[16]。双壳类循环系统是一个血液和淋巴液混合在一起的开放式循环系统,血淋巴在淋巴管、血窦和全身软组织中流通。黏膜组织的血淋巴填盈充足,这些器官与周围环境进行氧气的交换或营养素提取有关。血淋巴是应对环境应激一个重要防线[16]。肝胰脏、鳃和血细胞在维护动物稳态方面发挥关键作用,也是环境因素作用的靶点[16]。由此可见,肝胰脏、鳃和血淋巴中AwHSP60高表达与背角无齿蚌应对环境的耐受性密切相关。

图5 PBDE-47对背角无齿蚌腮AwHSP60基因表达的影响Fig.5 The effect of PBDE-47 on A.woodiana gill AwHSP60 gene expression

图6 PBDE-47对背角无齿蚌血淋巴AwHSP60基因表达的影响Fig.6 The effect of PBDE-47 on A.woodiana hemolymph AwHSP60 gene expression
在本研究中,PBDE-47处理可显著诱导肝胰脏、鳃和血淋巴中 AwHSP60表达水平,提示背角无齿蚌能够通过上调AwHSP60表达提高对PBDE-47暴露的耐受能力。背角无齿蚌作为滤食性淡水生物,靠过滤水体中营养物质来维持生存。PBDE具有较高的亲脂性,水中溶解PBDE很容易蓄积在细胞和组织中,导致活性氧(ROS)大量产生和机体氧化应激。正常情况下,ROS会很快被一系列抗氧化酶清除,维持在一个合理水平。氧化应激条件下,过量生成ROS可引起DNA损伤、脂质过氧化和蛋白质糖基化,造成蛋白质错误折叠几率增加。HSP表达上调有助于错误折叠蛋白质进行修复、蛋白质膜转位、错误折叠蛋白质降解,提高环境适应性。相关文献报道,水体柴油污染后能够导致巴西牡蛎的鳃和消化腺中HSP60表达水平显著上调,水体残留的抗抑郁药物氟西汀能够诱导河蚬消化腺中HSP60和HSP70 mRNA水平上调[17]。干扰蛋白质正确折叠是环境污染物影响机体功能重要路径之一,激活HSP表达是动物恢复正常生理功能和提高适应性的关键策略。低等生物缺乏后天免疫系统,软体动物上调HSP60表达应对温度、病原物、重金属和污染物的影响具有重要意义[17]。AwHSP60表达上调是背角无齿蚌应对 PBDE-47引起氧化应激的重要手段之一。
肝胰脏中 AwHSP60 mRNA水平的上调表现出时间依赖性模式,提示这可能与动物机体代偿机制有关。动物长期暴露PBDE-47环境中,机体通过适应性机制处理应激效应,并逐渐恢复细胞稳态。作为一种细胞内分子伴侣,HSP60参与细胞内外免疫调控并保护细胞免受环境应激损害,HSP60常表现出一种时间依赖性表达方式[18,19]。整个实验观察过程中,背角无齿蚌鳃中AwHSP60表达呈倒U型曲线,早期上调,中期达到峰值,后期下降,提示这种现象可能与动物对持续产生氧化应激的耐受能力有关。随着PBDE-47处理时间延长,PBDE-47在体内不断蓄积,将不断产生ROS,导致细胞承受逐渐增加的氧化应激效应,机体通过上调HSP 表达减少错误折叠蛋白质产生,增强耐受性[20]。一旦PBDE-47产生氧化应激水平达到峰值并超出细胞耐受能力,巨大应激效应将导致细胞损伤、炎症反应和细胞凋亡[21,22]。这种情况下,如果动物缺乏产生新细胞去补偿死亡细胞的能力,活细胞数量将逐渐降低[23,24]。值得注意是,肝胰脏、鳃和血淋巴中AwHSP60表达呈现不同的时空特征,提示该表达模式可能组织功能相关。软体动物肝胰脏具有肝脏和胰腺的双重功能,参与消化和中和大量毒素[15]。鳃与外部环境直接接触,作为环境污染物主要入口[16]。蚌类淋巴细胞是抵御病原体入侵的重要屏障[16]。
本研究从背角无齿蚌克隆出AwHSP60全基因序列,该基因包含HSP60家族高度保守的标签序列。PBDE-47处理可显著上调肝胰脏、鳃和血淋巴中 AwHSP60 表达水平,其原因与增强动物对氧化应激的耐受能力有关。
