掺氮WO2.83的制备及其电催化析氢性能
2019-09-21
(浙江工业大学 化学工程学院,浙江 杭州 310014)
由于气候环境的变化和化石能源的日益枯竭,寻找和发展清洁能源在近些年来显得格外重要[1]。氢气是一种具有高能量密度、清洁无污染的能源载体,利用电解水技术获取高纯度的氢气受到广泛的关注[2-3]。然而,目前析氢反应最有效的电催化剂依然为Pt基贵金属,但是受限于其价格高昂、资源稀缺,无法大规模商用化,制备廉价、高活性的电催化析氢材料已成为亟待解决的重大课题[4-6]。大量的过渡金属氮化物[7]、硫化物[8]、磷化物[9]、硼化物[10]和碳化物[11]已经被证实具有优异的催化析氢反应(HER)活性,但是过渡金属氧化物(TMOs)却因为活性位点少、导电性差以及容易团聚等不足而很少被用于催化HER中[12]。因此开发出应用于催化HER的过渡金属氧化物仍然是一个挑战。氧化钨(WO3)是一种重要的n型半导体,其晶格中可容纳一定的氧缺陷而形成非化学计量比的氧化物(WO3-x,0 磷钨酸(PWA)是一种具有Keggin型结构的杂多酸,具有很好的水溶性和强质子酸性。磷钨酸在水溶液中可与阳离子表面活性剂通过静电作用进行分子自组装[33]。笔者利用磷钨酸和十六烷基三甲基溴化铵(CTAB)作为反应物,通过不同方法得到不同的前驱体,再经过一步煅烧法分别制备得到纯相WO2.83和WO2.83|WN,并对其催化HER性能进行探究。结果表明:利用阴离子掺杂策略在WO2.83中引入氮原子,可以提高WO2.83催化HER的活性,10 mA/cm2电流密度下只需过电位116 mV,远高于纯相的WO2.83析氢性能。 磷钨酸(H3PW12O40·xH2O,AR),十六烷基三甲基溴化铵(C19H42NBr,AR),浓硫酸(H2SO4,AR),乙醇(C2H5OH,AR),氯化钾(KCl,AR),氩气(Ar,纯度99.999%),Nafion溶液(Nafion,质量分数5%),异丙醇(C3H7OH,AR),Pt/C(JM)催化剂(质量分数20%)。 开启式真空管式炉(OTF-1200X,合肥科晶材料科技有限公司),CHI 660D(上海辰华仪器公司)。 称取1.09 g CTAB,称取2.88 g H3PW12O40,将上述样品进行物理混合,研磨15 min。称取0.3 g研磨样品置于管式炉中煅烧,煅烧气氛为Ar,条件为5 ℃/min,750 ℃保温2 h。煅烧后将产物置于质量分数为15%的盐酸中刻蚀4 h,再用去离子水洗涤致中性,干燥后得到样品标记为WO2.83。 将CTAB(1.09 g,3 mmol)溶解于10 mL的热水中。再将H3PW12O40(10 mL,2.88 g,1 mmol)溶液滴加到上述溶液中,获得白色沉淀,持续搅拌。所得白色沉淀物水洗两次,异丙醇洗两次,60 ℃真空干燥过夜。研磨后称取0.3 g至于管式炉中煅烧,煅烧气氛为Ar,条件为5 ℃/min,750 ℃保温2 h。煅烧后将产物置于质量分数为15%的盐酸中刻蚀4 h,再用去离子水洗涤致中性,干燥后得到样品标记为WO2.83|WN。 X射线衍射(XRD)分析材料的晶体结构,采用荷兰PANalytical公司生产的X’Pert PRO型X射线衍射仪分析,X射线源为Cu靶Kα辐射(λ=0.154 1 nm),管电压40 mV,管电流40 mA,扫描范围为10°~80°。采用Hitachi S-4700 II型扫描电子显微镜表征样品微观形貌,辐射源为Cu Kα,操作电压为15 kV。透射电子显微镜采用荷兰FEI公司Tecnai G2 F30,配有可分析元素的X射线能量散射谱(EDX)设备。 电化学测试仪器采用CHI 660D电化学工作站(上海华辰),包括稳态极化曲线(LSV)、循环伏安(CV)、双电层电容(Cdl)以及Tafel曲线等。所有电化学测试都在传统的自制三电极体系中进行,涂有催化剂的玻碳电极(直径d=3 mm)作为工作电极,大面积碳棒作辅助电极,饱和甘汞电极(SCE)作参比电极,电解液为0.5 mol/L H2SO4溶液. 催化剂浆液是由5 mg催化剂粉末分散在360 μL 乙醇/40 μL Nafion(质量分数5%)中制备而成,使用移液枪移取6 μL催化剂浆液滴加在玻碳电极上。所述电势均相对于可逆氢电极(vs.RHE),E(RHE)=E(SCE)+(0.242+0.059 pH),所有数据均经过iR较调. 图1为催化剂WO2.83和WO2.83|WN的XRD图。衍射峰位置处于23.48°,33.24°,41.08°,48.07°和54.02°等对应的是单斜晶型WO2.83的(010),(114),(612),(020)和(124)等晶面(JCPDS#036-0103)。衍射峰位置处于37.70°,43.81°,63.68°和76.43°对应的是立方晶型WN的(111),(200),(220)和(311)晶面(JCPDS#065-2898)。两种产物在晶体结构上的差异是因为前驱体的不同,由磷钨酸和CTAB物理混合得到的前驱体中磷钨酸和CTAB之间没有键价连接,导致在高温煅烧过程中氮源不能充分利用,从而导致产物只含有纯相的WO2.83。另一种情况下,磷钨酸在阳离子表面活性剂CTAB溶液中持续搅拌,可自组装形成表面活性剂包覆的杂多酸盐结构(SEPs),其中CTAB的碱性中心N+取代质子氢通过静电作用与磷钨酸的Keggin型结构相连,更加靠近磷钨酸的八面体[33],因此在高温煅烧过程中能充分利用氮源形成氮化钨。如XRD数据所示(图1),笔者成功利用磷钨酸和CTAB,通过不同的前驱体制备方法,成功合成出纯相的WO2.83以及含氮掺杂的催化剂WO2.83|WN。 图1 WO2.83和WO2.83|WN的XRD图Fig.1 XRD patterns of WO2.83 and WO2.83|WN 从图2(a,b)可以看出:WO2.83|WN催化剂呈不规则片状堆积的结构,厚度较薄且结构较疏松。图2(c)是WO2.83|WN催化剂的HRTEM图,其中可清晰发现晶格间距为0.238,0.269 nm,分别归属于WN(111)和WO2.83(114)晶面,这与XRD晶体衍射数据相一致,进一步证明氮掺杂的WO2.83|WN催化剂的合成。 图2 WO2.83|WN的SEM,TEM和HRTEM图Fig.2 SEM,TEM,HRTEM of WO2.83|WN 图3是样品WO2.83|WN的EDX能谱图,可知样品由元素W,O,N和C组成。表1是样品WO2.83|WN中各元素之间的相对含量,金属W元素含量最高,其中,C元素可能来自于碳支持膜。 图3 WO2.83|WN的EDX能谱图Fig.3 EDX of sample WO2.83|WN 元素 质量分数/%摩尔分数/%C(K)9.4632.26N(K)10.3030.11O(K)8.4521.64W(L)71.7615.97 制备得到的电催化剂WO2.83|WN的催化HER性能采用典型的三电极体系进行测试,电解液为0.5 mol/L H2SO4,所有的电位数据相对于可逆氢电极(vs. RHE)。图4(a)所示为iR较调后的稳态极化曲线图,其中20%的商用Pt/C拥有最好的催化析氢性能,起始电位接近于零。其次WO2.83|WN也拥有比较小的起始电位50 mV,同时随着负电位的加大,WO2.83|WN的阴极电流密度迅速增加,10 mA/cm2的电流密度下只需要116 mV过电位。另外,纯相WO2.83在达到相应电流密度下则需较高过电位230 mV,这说明杂原子氮的引入可以显著提高WO2.83的催化HER性能。析氢催化剂拥有较低的Tafel斜率和较高的交换电流密度是催化性能优异的表现[1],为了初步研究催化剂的析氢电极动力学机理,笔者对催化剂的Tafel斜率和交换电流密度(J0)进行计算。如图4(b)所示,商用Pt/C的Tafel斜率为30 mV/dec,这与文献报道值一致[9]。催化剂WO2.83|WN的Tafel斜率为76 mV/dec,比纯相WO2.83的Tafel斜率88 mV/dec要低,但与商用Pt/C还存在一定的差距。通过Butler-Volmer动力学公式可知:Tafel斜率为29, 38,116 mV/dec时分别对应催化HER不同的控速步骤。通过分析,WO2.83|WN对应的催化HER机理为Volmer-Heyrovsky,表明电化学脱附步骤为主要的氢脱附机理。交换电流密度(J0)是通过催化剂Tafel曲线外推法计算得到的。WO2.83|WN的交换电流密度值(J0=0.308 mA/cm2)与商用Pt/C的值(J0=0.389 mA/cm2)比较接近。样品WO2.83|WN的催化HER性能较纯相WO2.83表现优异的主要原因可能是杂原子氮(χ=3.04)的电负性比氧(χ=3.44)的电负性低,较低的电负性表明对电子的吸引能力小,因此杂原子氮的引入可以增强中心金属钨d轨道电子密度,从而较纯相WO2.83有更强的吸附质子氢能力,催化活性增加,最终表现为优异的催化HER性能[34-35]。 图4 催化剂的电化学性能图Fig.4 Electrochemical properties of catalysts 为了得到电化学电容数据,在0.1~0.3 V(vs. RHE)的电位区间内采用6 种不同的扫速(20,40,60,80,100,120 mV/s)进行循环伏安测试。电容电流在没有发生法拉第感应电流的电位区间进行采集,并相对于不同扫速作线性拟合,所得斜率即为催化剂的双电层电容。如图5所示,催化剂WO2.83|WN和WO2.83在不同扫速下的电容电流具有很好的线性关系,且氮掺杂的催化剂WO2.83|WN的双电层电容为22.5 mF/cm2,远远高于纯相WO2.83。电化学活性表面积(ECSA)可由双电层电容通过公式计算得到,其中取单位电容值为40 μF/cm2[36],即 图5 双电层电容以及稳定性图Fig.5 The double-layer capacitance(Cdl)and stability of the catalyst 结果表明:与纯相WO2.83相比,WO2.83|WN因氮原子掺杂而产生了更多的析氢活性位点,因此表现为更高的双电层电容以及电化学活性表面积。电催化剂的稳定性则采用3 000 圈循环伏安前后稳态极化曲线对比的方法进行测试,循环伏安扫描电压为0.1~0.3 V,扫速为100 mV/s。如图4(d)所示,在经过3 000 圈的循环伏安扫描后,催化剂WO2.83|WN的稳态极化曲线前后只发生了极微小的变化,这表明催化剂在酸性体系下具有较好的催化稳定性。 利用磷钨酸和CTAB自组装形成的SEPs结构作为前驱体,得到氮掺杂的电催化剂WO2.83|WN,在不负载贵金属催化剂的情况下讨论了WO2.83|WN的催化析氢性能。通过稳态极化曲线(LSV),塔菲尔曲线(Tafel),双电层电容(Cdl),电化学活性表面积(ECSA)和稳定性测试等结果分析发现:与非氮掺杂的纯相WO2.83|WN相比,WO2.83|WN催化剂在酸性体系下对催化HER显示出很好的催化活性和催化稳定性,其在10 mA/cm2电流密度下所需电位为116 mV,Tafel斜率为76 mV/dec。同时,通过公式由双电层电容计算得到WO2.83|WN的电化学活性表面积是纯相WO2.83的15倍,表明阴离子氮的引入可以增加催化剂的活性位点,从而使得催化HER性能的提高。笔者认为利用氮掺杂的策略有效地提高了WO2.83的催化HER能力,同时为研究过渡金属催化剂的制备方法引入新的思路。1 实 验
1.1 试剂与仪器
1.2 WO2.83催化剂的制备
1.3 WO2.83|WN催化剂的制备
1.4 表征及测试
2 结果与讨论
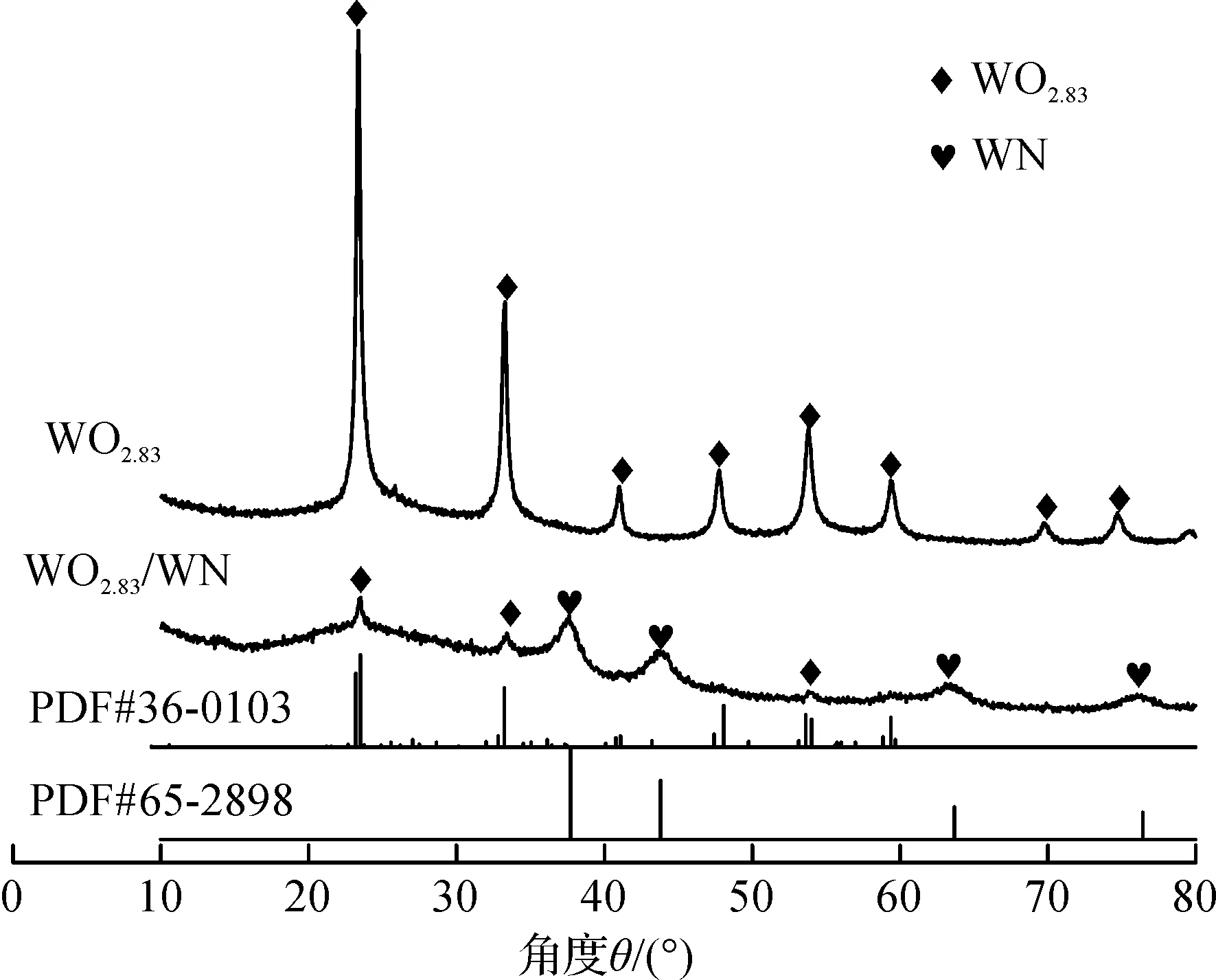
2.1 XRD分析
2.2 形貌表征

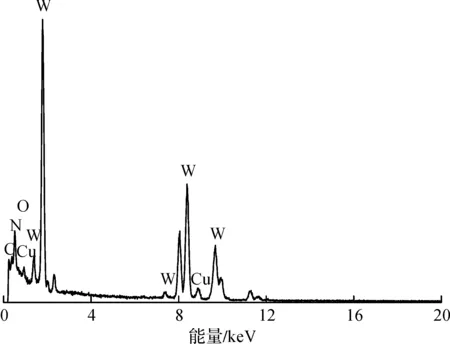
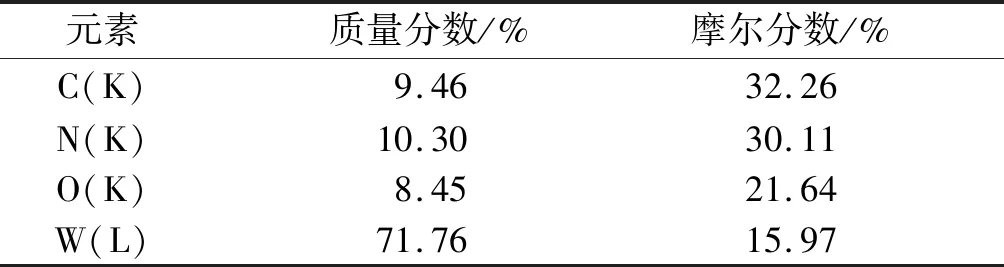
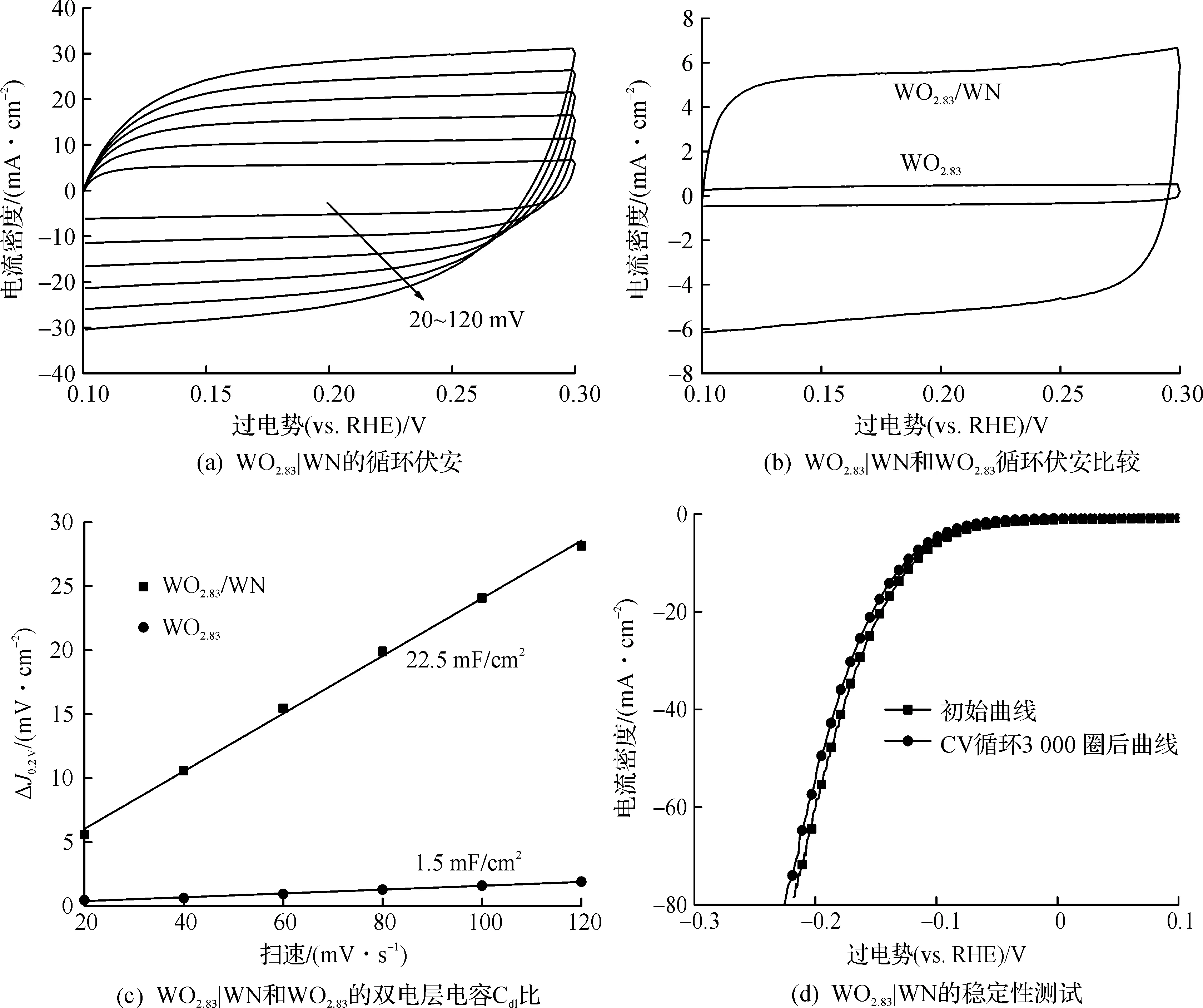
2.3 电化学分析

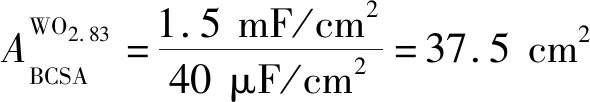
3 结 论
