水蜜桃E3 泛素连接酶PpARI1 基因的克隆及表达载体构建
2019-09-20马方玮李梦云郑伟尉万嗣宝
苑 婕, 马方玮, 李梦云, 曹 庆, 郑伟尉, 万嗣宝
(1. 上海大学生命科学学院上海市能源作物育种及应用重点实验室, 上海200444;2. 浙江农业大学农业与食品科学学院浙江省农产品品质改良技术研究重点实验室, 杭州311300)
泛素/26S 蛋白酶体系统在真核生物中能够修饰蛋白, 从而使蛋白质有选择性地降解[1-2].作为一种强有力的监管调控机制, 泛素/26S 蛋白酶体系统参与细胞周期调控、转录、信号传导、生长与凋亡、生物与非生物胁迫等几乎每一个重要的生命过程[3-5]. 有研究指出, 拟南芥中泛素/26S 蛋白酶体系统涉及到的蛋白超过拟南芥总蛋白的6%[6]. 泛素化是该系统发挥作用所必需的. 这个过程需要3 种酶, 分别是泛素激活酶(ubqiuitin-activating enzyme, 简称El)、泛素结合酶(ubiquitin-conjugating enzyme, 简称E2)、泛素连接酶(ubiquitin ligase, 简称E3)[7].泛素首先被E1 催化, 形成高能硫酯键; 然后被激活的泛素转移到E2 上; 最后通过E3, 在泛素的末端和靶蛋白的赖氨酸残基上形成异肽键[8]. 通过这3 种酶, 将单一或多个泛素偶联到靶蛋白上, 由26S 蛋白酶体复合物将被识别的靶蛋白降解[9].
E3 泛素连接酶是泛素/26S 蛋白酶体系统中最重要的一类酶, 虽然发现最晚, 但种类多样且功能最为复杂[10-11], 其中识别被泛素化的靶蛋白是其最主要的功能. 由于底物的特异性由E3 决定, 所以E3 在整个蛋白质的降解过程中发挥着至关重要的作用[12-13]. 研究表明, E3 泛素连接酶在动植物中可调控多个生理代谢途径. Silvia等[14]研究发现, E3 泛素连接酶PJA1 基因通过对EZH2 蛋白的降解促进细胞分化, 从而促进骨骼肌细胞的生成. Liu等[15]发现, E3 泛素连接酶smurf1 与smurf2 基因能促进成骨细胞分化, 有利于骨折愈合. Wei等[16]研究表明, E3 泛素连接酶YopM 通过作用于NLRP3 蛋白而使病变细胞死亡.Dong等[17]研究表明, E3 泛素连接酶PRT1 基因通过作用于泛素化的DA1 蛋白酶而限制了细胞的无限增殖. E3 泛素连接酶在植物响应胁迫信号的应答过程中也发挥了重要作用. 干旱胁迫处理转紫萼藓DSR7 基因的拟南芥植株, 发现植株的含水率及成活率均高于野生型, 说明该基因能增强植物的抗干旱能力[18]. 在拟南芥中转入棉花SARP1 基因, 在盐胁迫条件下, 发现转基因植株的发芽率低于野生型, 说明该基因负调控植物耐盐性[19]. 在冷害胁迫下, 水稻中的E3 泛素连接酶HOS1 基因的表达量增加[20-21], 说明该基因能提高植物的抗寒性.
本研究以“久保”水蜜桃为实验材料, 利用聚合酶链式反应(polymerase chain reaction,PCR)克隆出水蜜桃E3 泛素连接酶PpARI1 基因序列, 并进行生物信息学分析, 同时成功构建了表达载体pCAMBIAy1300-PpARI1, 为后续的遗传转化实验和该基因的功能分析奠定了基础.
1 实验材料
1.1 实验材料
以上海市浦东新区生产的“久保”水蜜桃(Prunuspersica L. cv. Jiubao)果实为实验材料,取样后立即送回实验室处理.
1.2 菌株、载体和试剂
pGM-T 载体、DNA Marker Ⅲ、大肠杆菌TOP10 感受态细胞、6×DNA Loading Buffer、质粒小提试剂盒、T4 DNA 连接酶, 购自北京天根生化科技有限公司. 表达载体pCAMBIAy 1300 和农杆菌感受态细胞, 由本实验室提供. Reverse Transcription System(Cat.#A3500)试剂盒, 购自普洛麦格(北京)生物技术有限公司. 柱式植物RNAout 2.0 试剂盒、即用型高保真PCR 试剂盒, 购自北京天恩泽基因科技有限公司. Taq DNA 聚合酶, 限制性核酸内切酶Xba Ⅰ与BamH Ⅰ, 购自宝生物工程(大连)有限公司. 柱式DNA 胶回收试剂盒、卡那霉素(Kan)、利福平(Rif)、庆大霉素(Gen), 购自生工生物工程(上海)股份有限公司, 引物也由该公司合成. 其他常规生化试剂均为国产分析纯.
2 实验方法
2.1 PpARI1 基因的克隆
2.1.1 水蜜桃果实总RNA 的提取与PpARI1 基因的扩增
按照柱式植物RNAout 2.0 试剂盒说明书的操作步骤提取水蜜桃果实的总RNA. 参照Reverse Transcription System(Cat.#A3500)试剂盒说明书的操作步骤合成cDNA. 以大豆ARI1 核酸序列(NM 001289243)为探针,在NCBI 网站对桃的核酸数据库进行在线BLAST,搜索到与之同源性为80%的一条具有完整开放阅读框(open reading frame, ORF)的核苷酸序列(XM 007221935). 根据此序列, 用Primier 5.0 软件设计特异性引物, 上游引物为5’-ATGGACTCCGAGGACGATA-3’,下游引物为5’-TCACCGTCGCTGGTGGTGGCACATG-3’. 以水蜜桃果实cDNA 为模板, 进行PCR 扩增. 反应体系如下: 高保真PCR Mix 15 µL,cDNA 2 µL, 上下游引物各1 µL, 加双蒸水至30 µL. 反应程序如下: 94◦C 预变性5 min;94◦C 变性30 s, 50◦C 退火40 s, 72◦C 延伸2 min, 35 个循环; 72◦C 再延伸10 min, 4◦C 终止反应. 取PCR 产物44 µL, 加入4 µL dNTP 和2 µL Taq DNA 聚合酶, 72◦C 孵育45 min, 进行加A 处理.
2.1.2 PCR 扩增产物的回收纯化及测序
PCR 产物经1.1%琼脂糖凝胶电泳检测后切下目的条带, 用胶回收试剂盒对其进行纯化回收, 将回收产物与pGM-T 载体连接. 将连接产物转化大肠杆菌TOP10 感受态细胞, 在含Amp(50 µg/mL)和X-Gal, IPTG 的LB 琼脂平板培养基上进行蓝白斑筛选. 培养12 h 后挑选白色单菌落摇菌. 经PCR 验证后, 选取阳性结果菌液保存, 并送往生工生物工程(上海)股份有限公司进行测序.
2.1.3 PpARI1 基因的序列分析
在GDR 网站(http://www.rosaceae.org/gb/gbrowse/prunus_ persica/)对PpARI1 基因进行染色体定位分析. 进入GSDS 网站(http://gsds.cbi.pku.edu.cn/index.php), 在CDS Sequences 栏输入鉴定出的PpARI1 基因的编码区序列, 在Genomic sequences 栏输入该基因全长序列, 点击左下方处Submit 按钮, 分析PpARI1 序列的外显子和内含子结构. 用EXPASy 网站的ProtParam 在线程序(http://web.expasy.org/protparam/)分析PpARI1 蛋白的分子量、理论等电点以及疏水性情况.
2.2 表达载体的构建
2.2.1 以两端添加Xba Ⅰ与BamH Ⅰ酶切位点的新引物克隆PpARI1 基因
以测序正确的菌液为材料, 重新设计两端添加Xba Ⅰ与BamH Ⅰ酶切位点的引物进行PCR 扩增. 上游引物为5’-GCTCTAGAATGGACTCCGAGGACGATA-3’; 下游引物为5’-CGGGATCC TCACCGTCGCTGGTGGTGGCACATG-3’. 反应体系与程序同2.1.1 节, 回收PCR 产物与pGM-T 载体连接之后, 转化大肠杆菌TOP10 感受态细胞并进行测序.
2.2.2 构建植物高效表达载体
取测序成功后的菌液,用试剂盒提取质粒. 使用Xba Ⅰ与BamH Ⅰ对pGM-T-PpARI1 重组质粒和真核表达载体pCAMBIAy1300 进行双酶切. 回收目的基因片段和真核表达载体片段之后, 用T4 DNA 连接酶16◦C 连接过夜. 将连接产物转化大肠杆菌TOP10 感受态细胞,涂布于含Kan(50 µg/mL)的LB 平板上. 培养12 h 后挑选白色单菌落, 摇菌并提取质粒,经PCR 检测和酶切验证正确后测序.
2.2.3 表达载体转化农杆菌
取含有重组表达载体的质粒5 µL, 加入到处于冰水混合状态的农杆菌中, 用热激法转化后加入800 µL LB 液体培养基, 于28◦C 振荡培养3~4 h. 8 000 r/min 离心后, 留取少量上清液轻轻吹打. 重悬菌块涂布于含50 µg/mL Kan, 50 µg/mL Rif 和50 µg/mL Gen 的YEP 培养基上, 于28◦C 倒置培养2 d. 待平板上长出白色单菌落后, 挑菌培养, 提取重组质粒进行PCR验证.
3 结果与分析
3.1 PpARI1 基因的PCR 扩增
以水蜜桃总RNA 反转录成的cDNA 为模板, 利用桃ARI1 基因特异性引物进行PCR 扩增.经1.1%琼脂糖凝胶电泳检测,扩增产物长度在1 800 bp 左右,与预期的目的基因大小一致,如图1 所示, 其中M 为DNA Marker Ⅲ, 1~3 为扩增产物. 将该片段回收, 与pGM-T 载体连接后转化大肠杆菌TOP10 感受态细胞, 筛选阳性克隆, 进行测序, 得到一条长度为1 764 bp 的基因序列, 命名为PpARI1. 该序列已提交到GenBank, 登录号为KY887584.

图1 目的基因的PCR 扩增产物Fig.1 PCR products of the target gene
3.2 PpARI1 基因的序列分析
3.2.1 比对结果用DNAMAN 软件将测序结果序列与预测序列进行比对, 其核苷酸序列的一致性高达99.83%. 氨基酸序列比对分析结果显示, 二者只存在一个氨基酸的差异, 结果如图2 所示.
3.2.2 PpARI1 的定位及结构分析
根据PpARI1 编码区序列, 在GDR 网站中找到了PpARI1 基因的染色体结合位点. 位点位于scaffol上, PpARI1 基因的碱基序列从16 694 469~16 704 710 bp.
根据PpARI1 基因序列, 在GSDS 网站中检索得到该序列的外显子和内含子结构(见图3).分析序列结果表明, PpARI1 基因具有15 个外显子和14 个内含子.
3.2.3 PpARI1 编码的氨基酸序列分析
使用ExPAsy 网站的在线程序Prot-Param Tool, 分析预测PpARI1 基因编码的蛋白.结果如下: 该蛋白的等电点pI 为5.40, 属于酸性蛋白; 分子量为66 726.45 Da, 蛋白的原子组成为C2883H4408N816O920S47; 带正电的氨基酸(Lys+Arg)数量为69, 带负电的氨基酸(Glu+Asp)数量为90, 不稳定系数为50.08, 推测其蛋白结构不稳定; 总平均疏水指数为-0.682. 由此可见, PpARI1 蛋白为亲水性蛋白.

图2 PpARI1 氨基酸序列与预测桃ARI1 氨基酸序列的多重比对结果Fig.2 Multiple alignment of the amino acid sequences between PpARI1 and the predicted ARI1
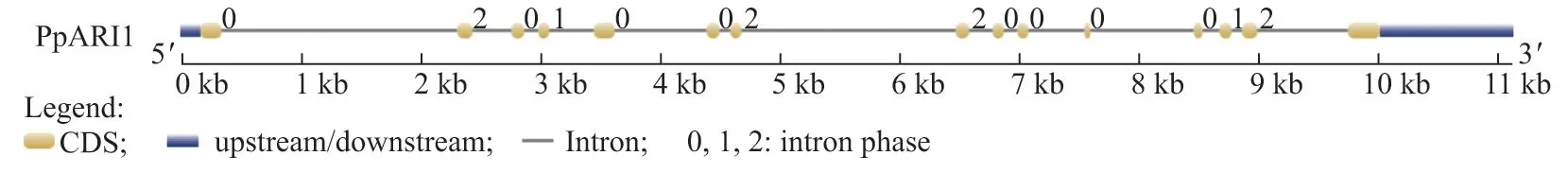
图3 PpARI1 基因的结构分析Fig.3 Structural analysis of PpARI1 gene
3.3 PpARI1 基因正义表达载体的构建
将用新引物扩增的PCR 产物与pGM-T 连接后转入大肠杆菌TOP10 感受态细胞, 测序正确后提取质粒, 用Xba Ⅰ和BamH Ⅰ双酶切pGM-T-PpARI1 质粒, 回收目的基因序列, 如图4(a)所示.
用相同的内切酶对pCAMBIAy1300 质粒进行双酶切, 回收大片段, 并与目的基因序列相连接, 转化大肠杆菌TOP10 感受态细胞. 挑选单克隆用特异性引物进行PCR 鉴定, 鉴定正确的进行摇菌, 提取质粒, 并用Xba Ⅰ和BamH Ⅰ双酶切, 得到约1 800 bp 的小片段, 如图4(b)所示. 测序结果完全正确, 说明表达载体pCAMBIAy1300-PpARI1 构建成功.
3.4 PpARI1 基因的农杆菌转化
采用热激法将pCAMBIAy1300-PpARI1 重组质粒转化农杆菌感受态细胞, 挑取单克隆摇菌并提取质粒. 以质粒为模板进行PCR 鉴定, 得到的条带大小与目的基因大小一致, 如图5 所示. 这表明PpARI1 基因的正义表达载体已经成功转化到农杆菌中.

图4 重组质粒的双酶切验证Fig.4 Double enzyme digestion of the recombinant plasmids

图5 pCAMBIAy1300-PpARI1 重组质粒转化农杆菌的PCR 验证Fig.5 Verification of the recombinant plasmid pCAMBIAy1300-PpARI1 in Agrobacterium by PCR
4 讨 论
水蜜桃果实多汁, 具有润肺、祛痰、清胃等功效, 其蛋白质、铁元素含量高且富含多种维生素, 深受广大消费者喜爱. 然而, 水蜜桃果树开花期易受干旱胁迫, 造成严重减产; 果实在低温运输、贮藏过程中也易发生冷害, 影响货架期. 在植物的发育过程中, E3 泛素连接酶参与了从胚胎发育到花器官产生几乎所有的发育过程, 控制着植物生长发育和逆境胁迫响应等过程中的关键步骤[22].
RING 蛋白家族是E3 泛素连接酶的一类. 在环境胁迫条件下, 很多RING 结构域基因被诱导表达, 增强了植物对逆境的抵抗能力. Qin等[23]从拟南芥中鉴定出ATRF1 基因. 该基因编码的氨基酸含有RING 典型结构域C3HC4, 能被铝离子诱导表达. 将该基因在植物体内过量表达, 发现能明显增强植物的抗铝毒能力. Qi等[24]从番茄中分离出RING 基因. 经检测发现其在野生番茄的所有组织中都能表达. 将该基因转入拟南芥后, 能增强拟南芥的耐盐性. 另有研究表明, 水稻中的CTR1 基因编码一个具有E3 泛素连接酶活性的RING 蛋白. 将植株进行干旱胁迫处理后发现, RING 蛋白的基因表达量明显升高, 再将其转入拟南芥后, 转基因拟南芥植株的抗干旱能力增强[25].
ARI1 基因属于RING 结构域家族, 除了在大豆中发现其具有耐铝毒性外, 其生理功能有待进一步验证. 验证基因功能最有效的方法就是转基因技术. 本实验采用柱式植物RNAout2.0 试剂盒法提取了水蜜桃果实总RNA, 有效避免了基因组DNA 的污染问题, 无多糖、蛋白等杂质, 纯度较高. 由于扩增的目的基因较长, 为保证高准确率, 使用了高保真Pfu DNA 聚合酶. 为使PpARI1 基因能与pCAMBIAy1300 相连, 需要在PpARI1 基因两端添加酶切位点. 由于pCAMBIAy1300 本身含有Kpn Ⅰ, Sac Ⅰ, Xba Ⅰ与BamH Ⅰ4 个酶切位点, 对PpARI1 基因进行酶切位点分析, 发现序列本身含有Kpn Ⅰ, 而pGM-T 载体中又含有Sac Ⅰ, 故选择Xba Ⅰ与BamH Ⅰ. 在pCAMBIAy1300 表达载体中, 这两个酶切位点距离最近, 因此在双酶切定向连接时难度较大, 需要反复实验, 确认体系中质粒与目的基因的浓度比例.
本研究最终得到了转基因工程菌, 为进一步研究PpARI1 基因的分子生物学功能奠定了基础, 进而为选育抗逆水蜜桃品种提供了理论依据.
