电芬顿法降解含酚类有机废水
2019-09-20徐甲慧霍守亮张靖天钱光人许云峰
徐甲慧, 霍守亮, 张靖天, 钱光人, 许云峰, 王 彬
( 1. 上海大学环境与化学工程学院, 上海200444; 2. 中国环境科学研究院, 北京100012)
随着煤化工行业的发展, 所排放的高浓度有机废水所带来的环境问题也日益严重. 原煤大多由多环芳烃类物质构成, 在气化、液化等过程中易转化生成大量的酚类物质[1-2]. 即使是新型煤化工艺, 其生产过程中还是会产生大量成分复杂的工业废水, 含有酚类化合物、杂环化合物、多环芳烃、氨氮、硫化物、氰化物、硫氰酸盐等有毒有害物质, 是典型的难降解、高毒性有机废水[3]. 废水中的COD 浓度一般为2 000~4 000 mg/L, 氨氮浓度为200~500 mg/L, 总酚浓度为300~1 000 mg/L, 挥发酚浓度为50~300 mg/L[4]. 高级氧化技术是处理难降解有机物的有效手段, 降解机理主要是臭氧氧化及羟基自由基氧化[5]. 电芬顿技术是通过阴极还原溶解氧, 原位生成的H2O2在溶液中Fe2+催化作用下, 产生羟基自由基来降解有机物, 因而被广泛应用于难降解有机废水的研究中[6]. 但传统的电芬顿技术由于H2O2产率较低, 以及易生成铁泥的缺点, 使得该技术难于实际应用[7]. 异相电芬顿反应利用固相含铁化合物(含铁矿物或固定化含铁材料)表面催化H2O2产生羟基自由基, 并通过促进Fe3+向Fe2+之间的转换来提高反应速率. 同时固相铁离子的缓释作用减少了铁泥的产生[8-9]. 目前, 已有很多的固相催化剂种类被研究, 例如天然硫铁矿物[10]、零价铁、磁铁矿(Fe3O4)、赤铁矿和针铁矿, 其中纳米Fe3O4中Fe3+与Fe2+并存, 具有稳定性好、重复利用率高的特点, 被认为是最有前途的一种固相催化剂[11]. 三维电极电芬顿(3D electrode/electro-Fenton, 3D-EF)反应通过引入粒子电极到电芬顿体系中, 实现一个反应器内同时进行直接和间接氧化, 极大地提高了处理效率;尤其是复极性粒子电极在通电的条件下还可以同时带正负电荷, 从而提高了阴极还原氧气产生H2O2的产率[12-14].
为探究不同电芬顿技术处理含酚有机废水的降解效果及机理, 本研究对比了纳米Fe3O4构成的异相催化电芬顿(heterogeneous catalytic electro-fenton, HEF)体系和铁碳颗粒构成的3D-EF 体系对苯酚废水的降解效果; 并将3D-EF 体系应用于煤化工废水的处理,考察了该技术工艺条件的影响因素(包括pH 值、粒子电极投加量、粒径和进水COD 浓度), 并采用紫外光谱、三维荧光光谱和傅里叶红外光谱探讨了反应过程中有机物的降解机理.
1 实验材料与方法
1.1 水样来源与水质
本研究以苯酚废水及煤化工废水为研究对象. 苯酚废水的初始浓度为2 g/L; 煤化工废水是在煤化工工厂采集的含酚及含硫废水, 废水的水质如表1 所示, 其中BOD 为生化需氧量(biochemical oxygen demand), TOC 为总有机碳(total organic carbon).
1.2 实验装置
电芬顿反应器的结构如图1 所示. 由图可知, 电芬顿反应器是一个直径为8 cm, 高为11 cm 的圆柱形电解槽, 石墨电极(5 cm×10 cm×5 mm)作为阴极, Ti/IrO2-RuO2电极(5 cm×10 cm×1 mm)作为阳极, 电极有效面积为37 cm2, 在电极板之间加入纳米Fe3O4或铁碳颗粒作为催化材料, 并向反应器中曝入空气.

表1 煤化工废水的水质特征Table 1 Characteristics of the coal liquefaction wastewater
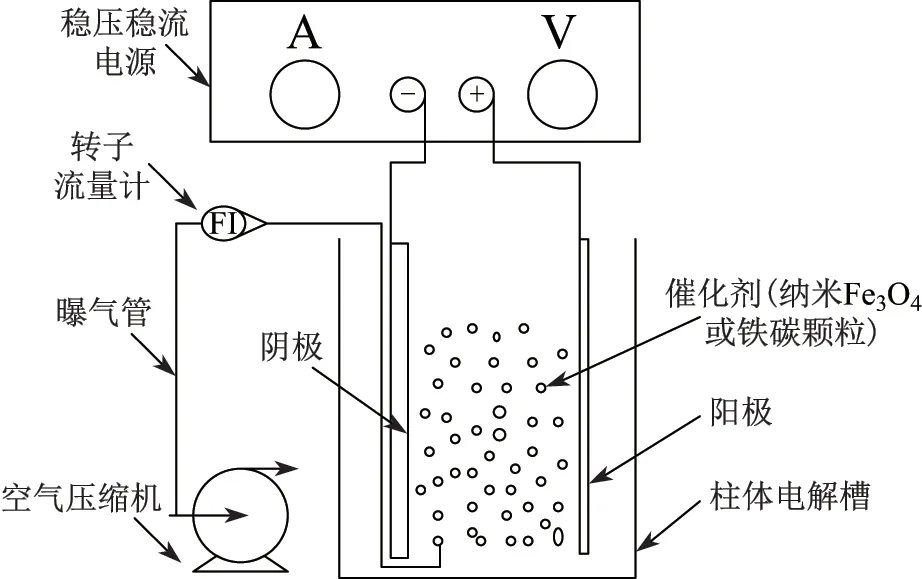
图1 电芬顿反应器结构示意图Fig.1 Structure diagram of the electro-Fenton reactor
1.3 实验方法
1.3.1 苯酚废水的降解实验
(1) 3D-EF 体系.
在室温条件下,分别将150 mL 2 g/L 的苯酚及0.1 mol/L 的NaSO4加入到反应器中,将吸附预处理后的铁碳粒子(3 g/L)作为粒子电极, 阴极曝入空气60 min 后, 用稀硫酸及NaOH 溶液调节pH=3 并接通电源, 使得反应体系在10 V 电压下电解, 在设计的时间间隔进行取样、分析.
实验采用3 组对照实验: 第1 组为3D-EF+H2O2, 先通电反应8 h, 而后加入H2O2继续通电反应15 h; 第2 组为H2O2+3D-EF, 直接加入H2O2持续通电反应23 h; 第3 组为H2O2-D,不通电, 直接加入H2O2, 反应23 h.
(2) HEF 体系.
以采用共沉淀法自制的纳米Fe3O4颗粒(3 g/L)为催化材料, 分别将150 mL 2 g/L 的苯酚和0.1 mol/L 的NaSO4加入到反应器中, 阴极曝气60 min 后, 调节pH=3, 并接通电源, 在一定电压下电解, 定时取样、分析.
实验采用3 组对照实验: 第1 组为HEF+H2O2, 先通电反应8 h, 而后加入H2O2继续通电反应15 h; 第2 组为H2O2+HEF, 直接加入的H2O2持续通电反应23 h; 第3 组为H2O2-H, 不通电, 直接加入H2O2, 反应23 h.
1.3.2 煤化工废水的降解实验
在室温条件下, 分别将150 mL 煤化工废水及0.1 mol/L 的Na2SO4加入到反应器中, 将吸附预处理24 h 的铁碳粒子作为粒子电极, 阴极曝入空气60 min 后, 调节pH 值并通电, 电解电压为10 V. 考察初始pH 值、粒子电极粒径、粒子投加量及进水COD 浓度对该体系降解效果的影响.
(1) 在COD 初始值为2 100 mg/L, Na2SO4浓度为0.05 mol/L 的体系中, 投加10 g 粒径为2 mm<d <5 mm 的粒子电极, 通过稀硫酸及NaOH 溶液, 将废水初始pH 值调至2, 3, 5, 9,研究初始pH 值对该体系降解效果的影响.
(2) 本实验中的粒子电极为不规则的粒状结构, 采用筛分法筛选出不同粒径的粒子电极,分别为d <0.1 mm, 0.1 mm<d <0.5 mm, 1 mm<d <2 mm, 2 mm<d <5 mm 等, 研究粒子电极的粒径对该体系降解效果的影响.
(3) 在pH=3, Na2SO4浓度为0.05 mol/L, 粒子电极粒径为2 mm<d <5 mm 的体系中,分别投加2, 5, 10, 15 和30 g 的铁碳粒子, 研究粒子投加量对该体系降解效果的影响.
(4) 在pH=3, Na2SO4浓度为0.05 mol/L 的体系中, 投加10 g 粒径为2 mm< d <5 mm 的粒子电极, 通过将废水稀释不同的倍数, 得到进水COD 浓度为700, 1 400, 2 100,2 800 和3 500 mg/L 的实验用水, 研究不同进水COD 浓度对该体系降解效果的影响.
1.4 分析方法
1.4.1 理化指标分析
取样后直接测定样品的COD 和BOD5. COD 浓度采用重铬酸钾法测定, BOD5值采用5 日培养法测定.
将原样过0.22µm 滤膜后,采用高效液相色谱技术测定苯酚及其中间产物[15]. 选用C18 色谱柱(150 mm×4.5 mm), 流动相为甲醇-超纯水(0.45∶0.55)[16], 样品进样量为20 µL[17], 流速为1.5 mL/min, 检测波长为270 nm, 柱温为30◦C[8]. 苯酚出峰时间是4.4 s, 保留时间为4.4~4.8 s.
1.4.2 紫外光谱和荧光光谱分析
紫外光谱分析采用UV2802 紫外可见分光光度计, 将煤化工废水处理前后的样品过0.45 µm 滤膜, 稀释相同的倍数, 用紫外分光光度计进行190~700 nm 波长扫描, 扫描间距为0.5 nm.
三维荧光光谱分析采用日本日立公司生产的F-7000 荧光分光光度计. 将煤化工废水处理前及处理30, 300 min 后的样品稀释至COD 浓度为20 mg/L. 测定前对样品进行预处理, 调节样品的pH 值, 使得溶液为中性. 激发波长扫描范围Ex为200~400 nm, 发射波长扫描范围Em为260~500 nm, 狭缝宽带为5 nm, PMT 电压为700 V, 响应时间为0.5 s, 扫描速度为12 000 nm/min. 实验空白为超纯水. 运用Matlab R2009.a 及Orange8.0 软件来分析结果, 在解析三维荧光光谱之前, 既要减掉超纯水的空白, 又要用内插值法修正三维荧光光谱被散射影响的区域, 从而处理得到荧光光谱图.
2 结果与讨论
2.1 苯酚模拟废水降解实验
2.1.1 COD 去除率及B/C 的变化
本工作考察了两种不同体系对苯酚的处理情况. 苯酚废水中的COD 去除率随时间的变化曲线如图2 所示.

图2 3D-EF 和HEF 体系对苯酚废水的COD 去除率变化Fig.2 Change of COD removal rate of the phenol wastewater by 3D-EF and HEF reactor
由图2(a)可见, 在3D-EF 体系中, 当处理时间为1 h 时, H2O2+3D-EF 实验组和H2O2-D 实验组的COD 去除率达到最大, 分别为84%和78%, 且随着处理时间的进一步增加,COD 去除率保持不变; 而3D-EF+H2O2实验组的COD 去除率随着处理时间的延长, 是逐渐增加的, 且当处理时间为9 h 时达到最大, 为80%, 随后一直保持不变. 当处理时间在0~8 h 之间时, 3D-EF+H2O2实验组的COD 去除速率明显低于其他两个实验组; 当处理时间达到23 h 时,COD 去除率没有明显变化. 这说明在3D-EF 体系中, 处理前投加H2O2能够在较短的时间内提高COD 的去除率.
由图2(b)可见, 在HEF 体系中, 当处理时间为1 h 时, H2O2+HEF 实验组的COD 去除率达到23%, 明显高于HEF+H2O2实验组(2%)和H2O2-H 实验组(1%); 随着处理时间的增加, 在8 h 时, HEF+H2O2实验组, H2O2+HEF 实验组和H2O2-H 实验组的COD 去除率分别为73%, 85%和83%. 这可能是纳米Fe3O4的在反应初期释放的Fe2+较少, 而随着反应的进行, 由Fe2+经过芬顿反应生成的Fe3+提高了溶液中铁离子的含量. Fe3+也具有一定的催化活性, 能够促进芬顿反应的快速进行, 提高COD 去除速率. 而后因H2O2及COD 浓度的减少, 减缓了去除速率, 降低了COD 去除率. 这说明在HEF 体系中, 处理前投加H2O2能够在较短的时间内提高COD 去除率.
比较图2(a)和(b)可知, 在同样的实验条件下, 3D-EF 体系中3 组实验的COD 去除率均在80%以上, 而HEF 体系的COD 去除率还不足70%. 这说明3D-EF 体系对苯酚废水的处理效果明显优于HEF 体系.
HEF 和3D-EF 体系处理苯酚废水的BOD5及B/C 变化如表2 所示. 可以看出, 随着处理时间的延长, 两种体系中BOD5值和B/C 逐渐减小. 这是因为在降解苯酚的过程中, 除了大部分会被分解为CO2和H2O 外, 还会被氧化成对苯二酚、邻苯二酚和对苯醌等难降解的中间物质, 从而导致反应体系中BOD5值和B/C 的下降.
2.1.2 高效液相分析苯酚去除率
3D-EF 体系和HEF 体系处理苯酚废水时, 苯酚去除率的变化如图3 所示. 由图可知, 两种体系在前8 h 内的苯酚去除率均达到100%. 这说明仅利用电解过程产生的H2O2或外加的H2O2就能与纳米Fe3O4或铁碳颗粒产生足够的·OH 降解苯酚, 其中H2O2+3D-EF 实验组对苯酚的降解速度最快, 在1 h 内的苯酚去除率就达到100%. 这与COD 去除率的变化相一致.

表2 HEF 和3D-EF 体系处理苯酚废水的BOD5 值及B/CTable 2 BOD5 values and B/C of phenol wastewater during 3D-EF and HEF treatment
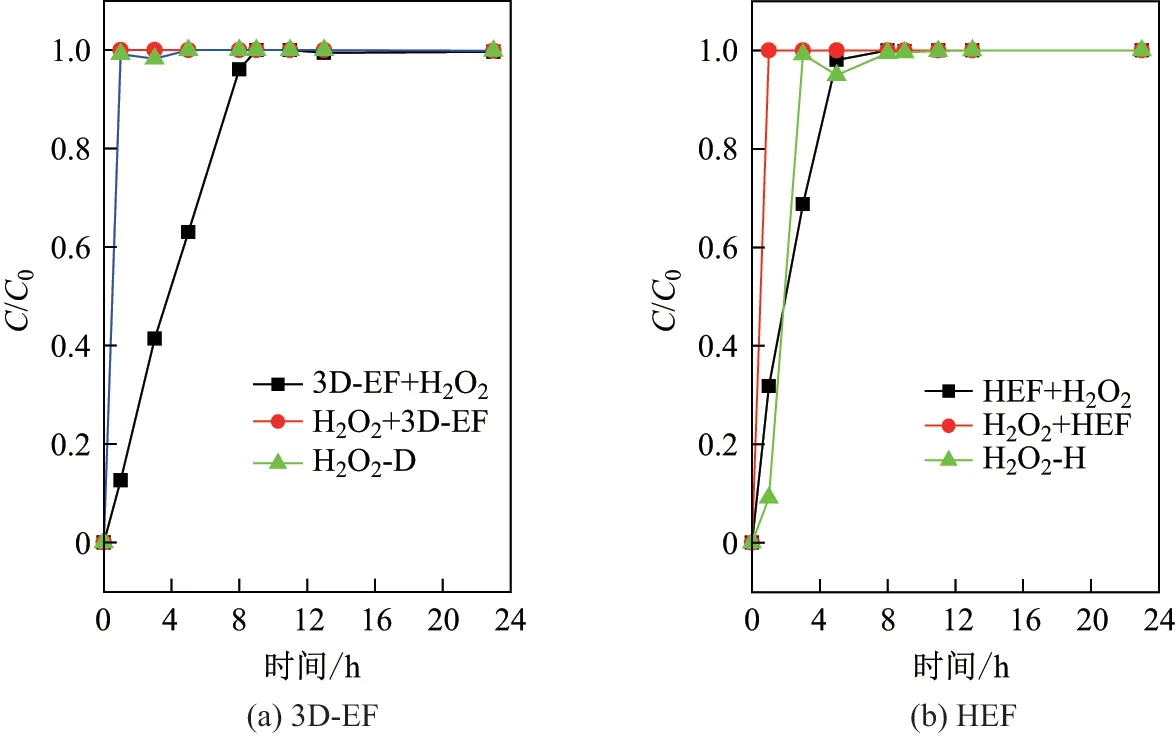
图3 3D-EF 和HEF 体系对苯酚废水的苯酚去除率变化Fig.3 Change of phenol removal rate of the phenol wastewater by 3D-EF and HEF reactor
2.2 3D-EF 体系降解煤化工废水
2.2.1 初始pH 值的影响
图4 为不同pH 条件下有机物的降解情况. 可以看出, 在不同pH 值条件下, COD 去除率都随着处理时间的延长而逐渐增加; 在相同处理时间下, 随着pH 值的减小, COD 去除率增大,且在pH=3 时有最大的COD 去除率. 这说明过酸和偏碱性条件都会抑制有机物的降解. 在过酸条件下, 过量的H+在阴极产生H2, 削弱了阴极的H2O2产生; 而当pH>3 时, 不利于粒子电极Fe2+/Fe3+的析出及芬顿反应的进行.
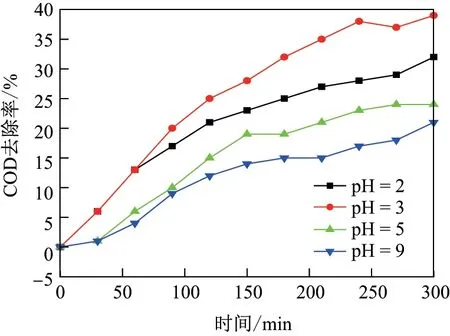
图4 在不同的pH 值条件下有机物降解情况Fig.4 Degradation of organic matter at different pH conditions
表3 列出了不同pH 值条件下, COD 去除率、BOD5值及B/C 的变化情况. 可以看出, 在同一pH 值条件下, 随着处理时间的增加, COD 值逐渐下降, 而B/C 的总趋势是先增大后减小,当pH=2, 3 时, B/C 的最大值出现在240 min 时; 而当pH=5, 9 时, 最大值出现在180 min 时.在pH=3 的条件下, 当处理时间为300 min 时, COD 值为1 299 mg/L, 低于其他pH 降解体系;BOD 值为573 mg/L, 高于其他pH 降解体系. 这表明在初始pH=3 的条件下, 3D-EF 体系能够有效提高废水的可生化性.
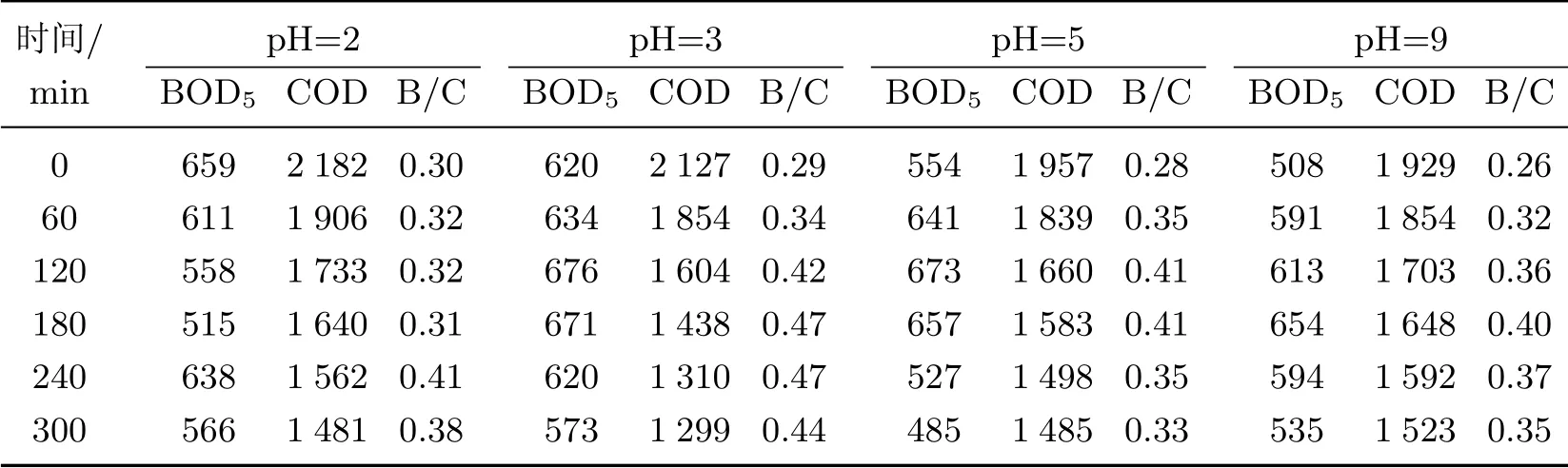
表3 不同初始pH 值下BOD5 值及B/C 的变化Table 3 Change of BOD5 values and B/C at different initial pH values
2.2.2 粒子电极粒径的影响
不同粒径铁碳颗粒下COD 去除率的变化如图5 所示. 可以看出, 随着处理时间的增加, 不同粒径铁碳颗粒下的COD 去除率是逐渐提高的; 随着粒径的增大, COD 去除率也是提高的;最好的是粒径为2 mm<d <5 mm 的粒子电极, 其COD 去除率比0.1 mm<d <0.5 mm 的实验组高46%. 这是因为在3D-EF 体系中, 粒子电极的粒径越小, 其比表面积越大, 在曝气过程中越容易与电极板相接触形成短路, 造成电能的损失, 使反应器的电流利用效率降低, COD 去除率进而降低. 因此粒径2 mm<d <5 mm 为最优粒子电极粒径范围.
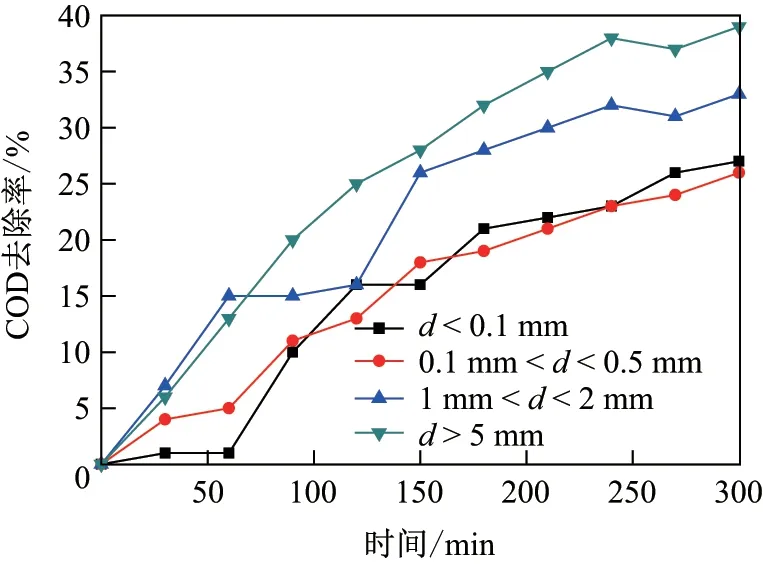
图5 不同粒径铁碳颗粒下, COD 去除率的变化Fig.5 Change of COD removal rates under different iron-carbon particle sizes
2.2.3 粒子电极投加量的影响
以2 mm<d <5 mm 粒径的粒子为粒子电极, 考察了其不同投加量对COD 去除率的影响,结果如图6 所示. 可以看出, 随着处理时间的增加, COD 去除率在不断增加; 随着粒子电极投加量的增加, COD 的去除效果愈发明显. 当粒子投加量为0 g 时, COD 去除率最低, 在25%以下; 当粒子投加量在5, 10 及15 g 时, COD 的去除效果相接近, 在35%~40%之间; 虽然当粒子投加量为30 g 时, COD 去除率最大, 接近50%, 但是考虑到粒子的利用率, 得到最优的粒子电极投加量为10 g.
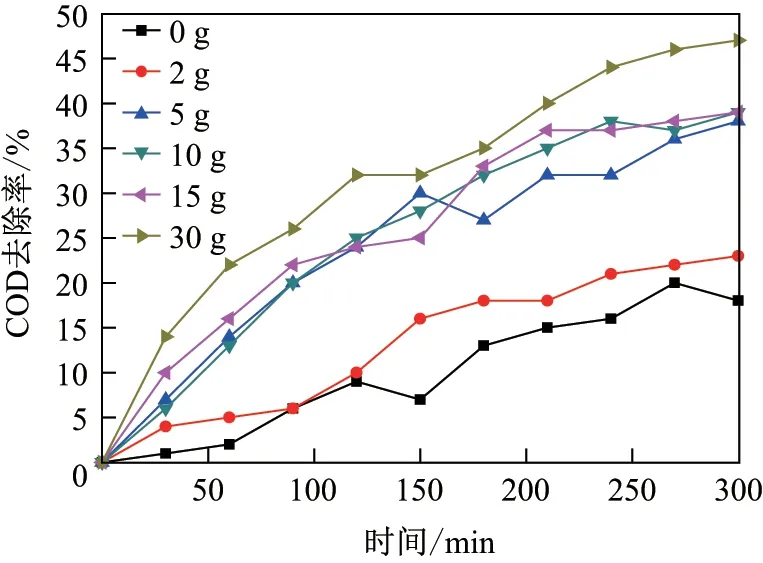
图6 不同铁碳颗粒投加量下, COD 去除率的变化Fig.6 Change of COD removal rates un der different iron-carbon particle dosages
2.2.4 不同的进水COD 浓度的影响
不同的进水COD 浓度对COD 去除率的影响如图7 所示. 可以看出, 相比其他进水COD浓度, 当进水COD 浓度为1 400 mg/L 时, COD 去除率达到最高. 随着处理时间的增加,COD 去除率逐渐提高. 反应300 min 后,当进水COD 浓度为1 400 mg/L 时,COD 去除率最大,为45%; 而当进水COD 浓度为3 500 mg/L 时, COD 去除率最低, 为34%. 因此, 本工作选取1 400 mg/L 为最佳进水COD 浓度.

图7 不同的进水COD 负荷对COD 去除率的影响Fig.7 Change of COD removal rates under different initial COD values
综上所述, 本工作所得3D-EF 体系的最优反应条件如下: pH 值为3, 粒子粒径为2 mm<d <5 mm, 粒子投加量为10 g(33 g/L), 进水COD 负荷为1 400 mg/L. 此条件下处理煤化工废水5 h 后, COD 去除率接近40%.
2.3 煤化工废水特征污染物的成分变化
为了探讨煤化工废水处理机制, 采用紫外光谱、三维荧光光谱和傅里叶红外光谱, 对该工艺条件降解过程中溶解性有机物的变化进行分析.
2.3.1 紫外光谱分析
在最优条件下, 煤化工废水处理前后样品的紫外光谱扫描情况如图8 所示. 可以看出, 处理前(0 min)的样品在270~280 nm 处有一个明显吸收峰, 与苯酚及其降解中间产物的吸收峰相似[18]. 随着处理时间的增加, 样品的紫外吸收强度逐渐减少, 表明有机物得到降解. 反应180 min 后, 280 nm 处的吸光度明显减弱, 特征峰不明显. 这说明废水中的芳香族化合物被降解.
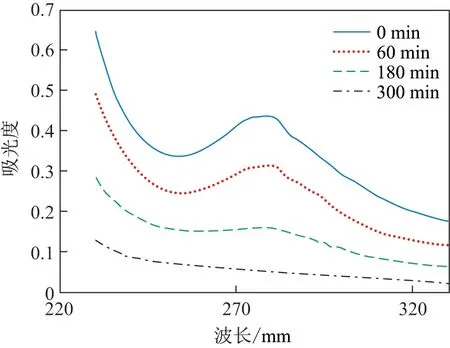
图8 不同处理时间下, 煤化工废水样品的紫外光谱扫描情况Fig.8 UV spectra of coal liquefaction wastewater samples under different degradation time
2.3.2 三维荧光光谱分析
采用区域积分的方法将三维荧光光谱分为5 个区域: Ⅰ,Ⅱ和Ⅲ区激发波长与发射波长的范围为Ex/Em= (200 ~250) nm/(250~330) nm, Ex/Em= (200 ~250) nm/(330~380) nm 和Ex/Em=(200 ~250) nm/(380~550) nm, 分别代表酪氨酸类芳香族蛋白质、色氨酸类芳香族蛋白质、富里酸类物质[19-20]; Ⅳ和Ⅴ区激发波长与发射波长的范围为Ex/Em=(250 ~450) nm/(250~380) nm 和Ex/Em= (250 ~450) nm/(380~550) nm, 分别代表溶解性微生物代谢物、腐殖酸类物质[21].
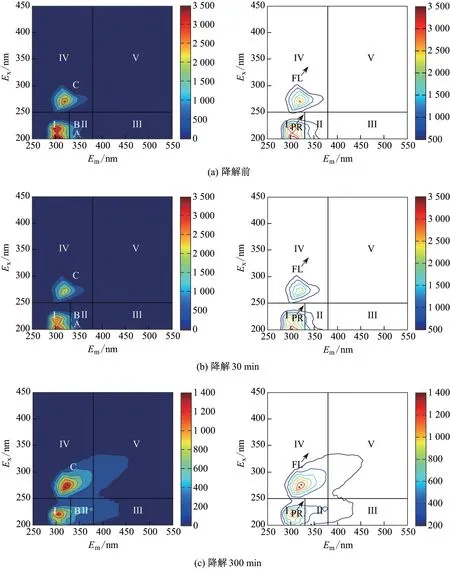
图9 不同降解时间下, 煤化工废水样品的三维荧光光谱图Fig.9 Three dimensional excitation-emission matrix spectra of coal liquefaction wastewater samples under different degradation time
在最优条件下, 煤化工废水样品在处理前后的三维荧光光谱图如图9 所示, 其中色度卡表示荧光强度, 单位为au-nm2-(mg/LC). 可以看出, 在处理前, 煤化工废水样品中存在3 个荧光峰, 即位于Ⅰ区的Peak A(Ex/Em=200 nm/300 nm), Peak B(Ex/Em=235 nm/303 nm), 以及位于Ⅳ区的Peak C(Ex/Em=275 nm/330 nm), 其中Peak A 和Peak B 主要是单环的芳香化合物, 如苯、甲苯、苯酚和苯胺等[22-23], Peak C 则可能与乙苯、二甲苯和萘等物质有关[24].在处理30 min 后,Peak A,Peak B,Peak C 的荧光强度显著下降(见图9(b)). 这说明3D-EF 体系对芳环类化合物具有较好的降解效果. 在处理300 min 后(见图9(c)), Peak A 消失, Peak C 的荧光强度增强. 这说明单环芳香族化合物继续被降解开环的同时, 可能重新聚合成多环有机物.
2.3.3 傅里叶红外光谱分析
傅立叶变换红外光谱可以反映煤化工废水中有机物官能团的变化[25]. 图10 是煤化工废水样品经3D-EF 体系处理前后的傅立叶红外吸收光谱图. 可以看出: 样品在3 300~3 400 cm-1之间存在一个较宽的峰, 是由含有N-H, O-H 伸缩振动和羧酸的氢键的醇类、酚类和羧酸类物质所引起的[26-27]; 在2 240~2 260 cm-1之间的吸收峰, 是由脂肪腈类化合物的C≡N 伸缩振动所引起的; 1 650 cm-1处的宽峰显示了共轭酮的C=O 及酰胺基的C=O 的存在[21,28-29]. 这说明废水中主要的有机污染物为芳香族化合物、酚类、醇类及羧酸类等化合物.经3D-EF 体系处理300 min 后, 1 650 及3 300~3 400 cm-1处峰的强度有减弱的迹象.这表明废水中含共轭C=C 或C=O 官能团的有机物、醇类和酚类等物质, 能够被3D-EF 体系降解.
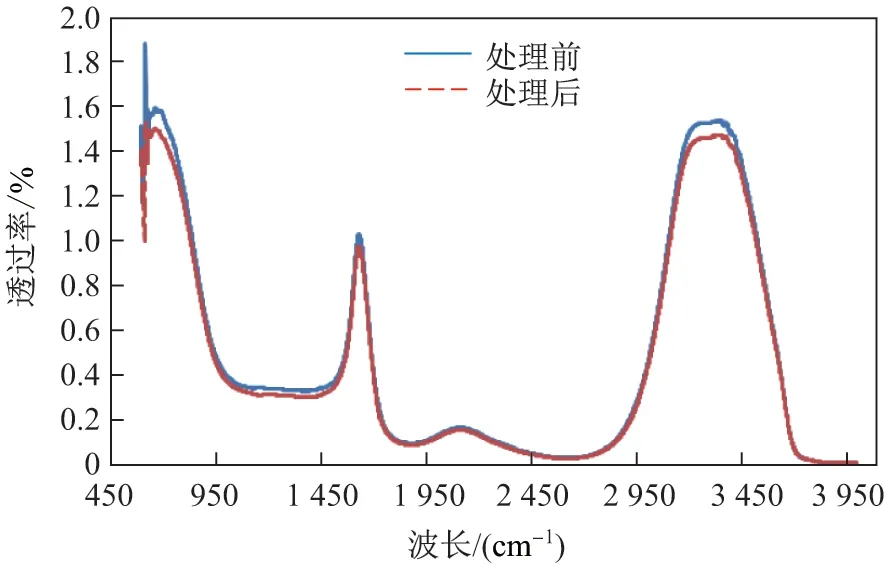
图10 3D-EF 体系处理前后, 煤化工废水样品的傅立叶红外光谱图Fig.10 Fourier transform infrared spectra of coal liquefaction wastewater samples before and after 3D-EF treatment
3 结 论
(1) 3D-EF 体系处理苯酚废水的COD 去除率高达80%, 苯酚在1~8 h 内的降解率达到100%, 明显好于HEF 体系的处理效果.
(2) 初始pH 值和粒子电极投加量对3D-EF 体系的处理效果影响较大, 并得到如下的最优反应条件: pH 值为3, 粒子粒径为2 mm<d <5 mm, 粒子投加量为10 g(33 g/L), 初始进水COD 浓度为1 400 mg/L. 在此条件下反应5 h, 3D-EF 体系对煤化工废水的处理效果最好,COD 去除率接近40%, B/C 提高至0.44.
(3) 紫外光谱和三维荧光光谱的分析结果显示, 3D-EF 体系对煤化工废水中芳香族化合物具有较好的降解效果, 对COD 的去除主要来自对酚类化合物的降解. 傅里叶红外光谱的结果也证明了C=C 和C=O 的存在. 这说明一部分酚类物质的降解产物重新聚合为杂环的大分子物质.
