O3氧化黑碳对SH-SY5Y 细胞的毒性作用
2019-09-20王田田吴美英何慧心
尚 羽, 王田田, 吴美英, 王 璐, 何慧心, 安 静
(上海大学环境与化学工程学院环境污染与健康研究所, 上海200444)
由燃烧排放的BC 颗粒呈蓬松状,比表面积大,具有很强的吸附能力,极易吸附大气中的污染物质, 包括重金属、多环芳烃、多氯联苯、二英、多溴联苯醚等[7]. 大气中BC 颗粒的粒径范围变化较大,从几个纳米到几个微米.粒径小于100 nm 的超细BC 颗粒物可以通过人类呼吸道进入肺组织, 然后通过肺泡上皮细胞进入血液循环, 甚至进入其他器官组织, 例如肝脏等[8].对木材和柴油燃烧产生的颗粒进行毒理学研究发现, 颗粒物表面吸附的有机物, 如PAHs 和水溶性有机物等, 是这些颗粒物产生毒性效应的直接原因, 而燃烧产生的BC 颗粒只作为这些有机物的载体[9-10]. 新鲜排放的BC(fresh BC, FBC)颗粒可被大气氧化剂(如O3, NOx等)氧化, 其表面理化特征和吸附化学物质都将发生改变. 如何表征大气氧化过程对BC 颗粒物化性质及健康影响的作用, 成为近年该领域重点的关注内容.
使用商品化的纳米级BC 颗粒为模型, 通过体内外的动物和细胞研究发现, BC 颗粒可直接造成生物体肺组织和细胞的损伤[11]. 除呼吸系统外, BC 颗粒还能诱发血管内皮细胞毒性和炎症反应[12]. 动物实验发现, 纳米级BC 颗粒暴露可长期活化小鼠大脑内星形胶质细胞, 进而诱发退行性神经系统疾病[13]. 研究在体外培养的星形胶质细胞体系, 发现BC 颗粒可以通过激活连接蛋白通道, 诱导谷氨酸盐和ATP 的释放[14]. 这些研究都说明, BC 颗粒具有神经系统毒性, 但其具体的致毒机制尚未明确.
由于BC 颗粒在大气中的氧化过程比较复杂, 因此关于BC 颗粒经O3氧化后, 其细胞毒性如何发生变化, 目前尚没有定论[15]. 本工作以人神经母细胞瘤细胞SH-SY5Y 作为细胞模型, 探讨经O3氧化过的BC(O3-oxidized BC, OBC)颗粒对神经细胞的毒性作用;应用MTT 方法测定细胞存活率, 探讨OBC 颗粒对细胞增殖能力的影响; 利用乳酸脱氢酶(lactate dehydrogenase, LHD)漏出率表征细胞膜的损伤程度; 利用流式细胞术评估细胞凋亡比例; 通过荧光探针测定细胞内Ca2+浓度. 本工作以期为深入探讨BC 颗粒的神经毒性, 解释大气中BC 颗粒对健康的影响提供基础实验数据.
1 材料与方法
1.1 材料和试剂
SH-SY5Y 为人神经母细胞瘤细胞, 来源于1970 年建立的神经母细胞瘤患者的转移骨瘤细胞SK-N-SH 经3 次克隆后的亚系, 购自美国模式培养物集存库. 纳米级BC 颗粒(Printex U, 粒径30 nm)可以非常好地模拟柴油燃烧排放的焦炭物质[16], 购自Degussa 公司(德国),按照文献[17]的方法进行O3氧化, 获得OBC 颗粒, 氧化过程保持O3浓度为0.01%. 反应时间为120 min. DMEM 购自HyClone 公司(美国). 胎牛血清购自PAA laboratories GmbH 公司(奥地利). LDH 试剂盒, 购自南京建成生物技术有限公司. 细胞培养板、培养皿和培养瓶均购自康宁公司(Corning, 美国). 其他试剂(分析纯)购自上海国药集团化学试剂公司.
本工作所用仪器如下: 正置荧光显微镜(BX51 型, Olympus 公司, 日本); iMark-680 型酶联免疫检测仪(BIO-RAD公司, 美国); 高速分选型流式细胞仪(Beckman coulterter, 香港); 倒置生物显微镜(Olympus, CKX41, 日本); CO2恒温细胞培养箱(Binder 公司, 德国).
1.2 细胞培养和染毒
SH-SY5Y 细胞使用DMEM 培养基, 在5% CO2和37◦C 的恒温恒湿条件下培养. 单层细胞达到80%以上时, 按1∶4~1∶3 的比例传代培养.
在对数生长期, 用胰蛋白酶消化后, 离心, 重新悬浮, 接种于96 孔板(每孔3×103个细胞)、24 孔板(每孔1×104个细胞)、6 孔板(每孔5×104个细胞)以及35 mm 培养皿(每孔5×104个细胞), 分别供MTT 实验、LDH 实验、细胞凋亡分析和Ca2+浓度检测实验. 接种后隔夜令细胞贴壁生长, 弃培养基. 使用D-Hanks 清洗两次, 加入含有OBC 颗粒的培养基进行染毒,1~48 h 后检测. 根据24 和48 h 的细胞存活率,筛选OBC 颗粒染毒浓度分别为0, 5, 10, 20,40 µg/mL 的样品. 每个浓度设置3~6 个平行样, 实验重复3 次.
1.3 MTT 实验
染毒结束后弃去上清液, 使用D-Hanks 溶液清洗2 次, 每孔加入0.1 mL 用培养液稀释10 倍的MTT 溶液, 37◦C 继续培养4 h. 弃上清液, 每孔加入100 µL DMSO, 室温下振荡10 min, 之后使用酶标仪检测OD490值. 细胞存活率的计算公式如下:
(1)进口学习效应:进口中间产品内化了进口来源企业的研发努力与知识,同时经过进口的方式外溢到下游生产企业,减弱了企业研发新产品的成本;由于新产品里具备高层次水平的质量和技术成分,提升了企业对新产品的收益估值,再次刺激了企业研发行为。虽然无法全部替换掉差异化产品以及产品类型中内化的技术以及信息,但随着进口中间产品多样性的提高,进口学习效应也会逐渐增强。

式中, 实验组为OBC 颗粒染毒组, 溶剂对照组为正常培养基培养细胞, 空白对照组为培养基组(未加入细胞).
1.4 LDH 活性检测
染毒结束后, 吸取上层培养液至1.5 mL 的EP 管中, 离心5 min(1 200 r/min). 弃下层颗粒, 取100 µL 上清至EP 管中, 按照LDH 试剂盒的说明书依次加入相关试剂. 吸取最后一步所得溶液, 加至96 孔平底培养板中(每孔加200 µL). 用iMark-680 型酶联免疫检测仪测定吸光度(D), 波长为440 nm. 记录数据, 并根据标准曲线计算所得LDH 浓度.
1.5 流式细胞术检测
染毒结束后, 弃上层培养液, 用无EDTA 的胰蛋白酶消化, 重新悬浮细胞收集于1.5 mL 离心管中. 3 000 r/min 离心3 min, 弃上清. 使用预冷的PBS 重悬细胞, 3 000 r/min 离心3 min, 弃上清. 加入100 µL 的Binding Buffer 和2.5 µL 的Annexin V-FITC, 混匀后于室温避光孵育15 min, 进行Annexin V-FITC 标记. 使用Binding Buffer 洗涤, 并重新悬浮细胞. 再加入100 µL 的Binding Buffer 和5 µL 的PI, 室温避光孵育5 min, 进行PI 标记. 补加Binding Buffer 至500 µL, 在1 h 内用流式细胞仪检测.
1.6 Ca2+浓度测定
染毒结束后, 弃上层培养液. 用D-Hanks 溶液洗涤细胞3 次, 加入已被D-Hanks 稀释的Fluo 3-AM(终浓度为5µmol/L),37◦C 孵育45 min. 弃去Fluo 3-AM 工作液,用D-Hanks 溶液洗涤3 次, 以充分去除残留的Fluo 3-AM. 加入D-Hanks 溶液覆盖细胞, 37◦C 孵育20 min,以确保AM 在细胞内的完全去酯化, Fluo 3-AM 在细胞内转变成Fluo 3. 使用荧光显微镜观察细胞,激发波长为494 nm,发射波长为516 nm. 每个平行样选取5~10 张照片,使用Ipwin32 图像分析软件分析荧光强度, 取其平均值. Ca2+水平用光密度值来表示, 并将所得结果与对照组做归一化处理. 值得注意的是, 加入Fluo 3-AM 后所有操作都需要避光进行, 以免探针降解.
1.7 数据处理
数据以“算术平均值±标准差(X±SD)”的方式表示, 采用Microsoft Office Excel 2007 软件进行分析和检验, 各指标组间差异采用t 检验法进行统计, 显著性水平以*p <0.05,**p <0.01 为判断标准.
2 结果与分析
2.1 细胞存活率
图1 为OBC 颗粒染毒24 和48 h 后,SH-SY5Y 细胞的存活率.使用不同浓度(0~40µg/mL)的OBC 颗粒进行染毒后, SH-SY5Y 细胞的存活率有不同程度的下降, 并呈现出统计差异的剂量-效应关系(**p <0.01). OBC 颗粒染毒24 和48 h 后, 对SH-SY5Y 细胞的半致死浓度(LC50)分别为202.2 和133.3 µg/mL(通过线性回归模型计算). 随着染毒时间从24 h 增加到48 h, LC50值有所下降, 说明OBC 颗粒对SH-SY5Y 的细胞毒性随着染毒时间的增加而增强.

图1 OBC 颗粒浓度对SH-SY5Y 细胞存活率的影响Fig.1 Cell viability of SH-SY5Y cells after treated with different concerntrations of OBC particles
2.2 LDH 活性
图2 为OBC 颗粒染毒24 h 后, SH-SY5Y 细胞培养液中LDH 的浓度水平. 可见, OBC 颗粒染毒24 h 后, 胞外LDH 的浓度显著升高, 亦呈现剂量-效应关系(**p <0.01), 说明OBC 颗粒暴露导致明显的SH-SY5Y 细胞损伤.
2.3 细胞凋亡
使用不同浓度(0, 5, 10, 20 和40 µg/mL)的OBC 颗粒. 染毒24 h 后, 经流式细胞仪分析, 细胞凋亡率如图3 所示. 可见, OBC 颗粒可导致SH-SY5Y 细胞发生细胞凋亡, 且随着染毒剂量的增加, 凋亡率不断上升, 呈显著的剂量-效应关系(**p <0.01). 在最高染毒剂量40 µg/mL 组, 细胞凋亡率达到7.0%(**p <0.01).
2.4 Ca2+浓度
图4 为OBC 颗粒对SH-SY5Y 细胞内Ca2+水平的影响. 可见, 细胞内Ca2+浓度随染毒时间的增加呈现先升高再降低的趋势. 在染毒1~4 h 内, Ca2+浓度升高最显著; 染毒6 h 后,Ca2+浓度逐渐回归到正常水平. 染毒1 和4 h, 随着OBC 剂量的升高, 呈现剂量-效应关系(**p <0.01).
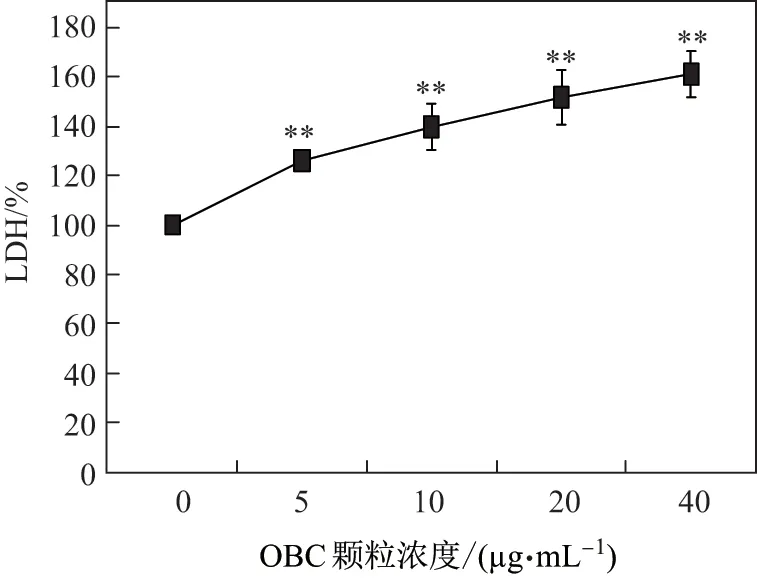
图2 OBC 颗粒浓度对SH-SY5Y 细胞LDH 水平的影响Fig.2 LDH release of SH-SY5Y cells after treated with different concerntrations of OBC particles
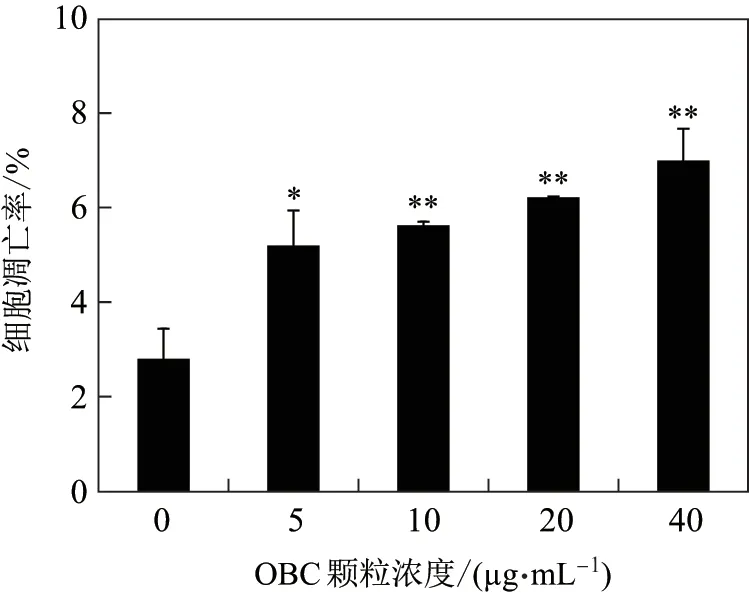
图3 OBC 颗粒浓度对SH-SY5Y 细胞凋亡率的影响Fig.3 Apoptosis in SH-SY5Y cells induced by different concerntrations of OBC particles

图4 OBC 染毒时间对SH-SY5Y 细胞内Ca2+水平的影响Fig.4 Ca2+ levels in SH-SY5Y cells induced by OBC exposure time
3 讨 论
MTT 方法, 又称为MTT 比色法, 可用于检测细胞的增殖活性. 在体外培养细胞体系中,MTT 方法是评价外源物总体毒性的常规方法[18]. LDH 存在于机体所有组织细胞的胞质内,当细胞受到外源性刺激, 导致细胞膜损伤、细胞通透性增强后, LDH 可从细胞质中泄出至细胞外的培养基中. 通过检测培养液中LDH 的浓度水平, 可以指示细胞受损伤的程度. 因此, 培养基中LDH 浓度亦可用于表征外源性物质的毒性大小[18]. 实验结果表明: 经OBC 颗粒染毒24 和48 h 后, SH-SY5Y 细胞的增殖能力被显著抑制, 呈现剂量和时间-效应关系; 染毒24 h 后,SH-SY5Y 细胞膜显著受损, 亦呈现剂量-效应关系.
An等[15]研究了OBC 颗粒对人肺上皮细胞A549 的毒性作用. 结果发现, OBC 颗粒在染毒24 h 后, 可以导致细胞DNA 损伤和细胞死亡. Li等[17]的研究也发现, OBC 颗粒可以造成A549 细胞和16HBE 细胞显著的毒性效应, 诱导细胞发生氧化应激, 造成细胞死亡. 以上研究中OBC 颗粒暴露24 h 导致细胞死亡的半致死浓度在100~200 µg/mL 之间, 与本研究结果基本一致.
检测细胞凋亡的方法众多. 本研究采用流式细胞术检测凋亡, 可以对发生凋亡的细胞进行准确计数, 是一种常用的检测方法. 研究结果显示, OBC 颗粒可诱导SH-SY5Y 细胞发生细胞凋亡, 且随着染毒剂量的增加, 凋亡率不断上升. 在最高剂量40 µg/mL 时, 凋亡率达到7.0%, 显著高于对照细胞, 具有统计学意义(**p <0.01). 有文献报道, OBC 颗粒可诱导人肺上皮A549 细胞发生细胞凋亡和DNA 损伤[15], 与本研究结果一致.
Ca2+是机体内主要的细胞信使之一, 参与调控许多细胞的生理活动, 包括细胞分裂和细胞凋亡等. 有研究表明, Ca2+可能参与了大气颗粒物诱导的细胞凋亡和炎症反应. Brown等[19]发现, 大气颗粒物既可增加细胞内Ca2+浓度又可促进活性氧的产生.Sakamoto等[20]发现, PM10可增加人支气管上皮细胞内Ca2+浓度, 并且与炎症因子IL-1β 和IL-8 的释放有一定关联. 本研究发现, BC 颗粒可导致神经细胞SH-SY5Y 中Ca2+浓度的增加, 染毒4 h, Ca2+浓度达到最高峰. 之后随着染毒时间增加, Ca2+浓度逐渐趋于正常细胞. 动物和细胞实验发现, BC 颗粒可以通过激活连接蛋白通道, 诱导谷氨酸盐和ATP 的释放, 进而活化小鼠大脑内星形胶质细胞, 诱发退行性神经系统疾病[13-14]. 本研究提示, 信号分子Ca2+可能在BC 颗粒诱导神经细胞凋亡及神经系统疾病的过程中起重要的调控作用, 值得进一步深入探讨.
大气颗粒物对神经系统的毒性作用, 已经在一些动物和细胞体系中得到证实. BC 颗粒是大气颗粒物重要的组成部分. 本研究结果提示, OBC 颗粒可以诱导体外神经细胞Ca2+释放,导致细胞凋亡, 进而在颗粒物导致神经系统疾病过程中起重要作用. 随着经济和工业的迅速发展, 化石燃料的消耗增长, 大气中BC 颗粒的排放会不断增加. 有调研资料表明, 一些城市地区的大气中BC 颗粒的浓度处于较高水平[21]. 因此, 要更加关注城市大气中BC 颗粒的浓度水平与其相应的健康影响.
4 结 论
(1) OBC 颗粒可显著抑制SH-SY5Y 细胞的增殖, 造成细胞膜的损伤.
(2) OBC 颗粒可诱导SH-SY5Y 细胞发生凋亡, 呈现剂量-效应关系, 并能显著增加细胞内Ca2+的浓度.
(3) OBC 颗粒体外暴露可导致神经细胞损伤, 胞内Ca2+浓度增加, 最后导致细胞凋亡.
