粪菌移植联合乳果糖对老年慢性功能性便秘的治疗效果
2019-09-19杜三军高会斌李多吴娜
杜三军 高会斌 李多 吴娜
河北北方学院附属第一医院消化内科(河北张家口075000)
慢性功能性便秘属于常见肠道功能性疾病的一种,以老年人为好发人群,原因在于老年人群胃肠道蠕动功能、运动技能以及肠道肌张力水平均明显衰退,加之活动量降低,导致排便反射功能异常,同时直肠的敏感性降低,且胃肠动力水平严重不足,从而引起老年慢性功能性便秘[1]。老年慢性功能性便秘以粪便干结、排便次数减少等为主,可伴有排便不尽感、肝门坠胀感等为主要表现,当前临床以药物治疗为主,乳果糖即为其中常见药品之一,虽可在一定程度上缓解患者症状,但部分患者长时间用药可能会有药物依赖性产生,停药后难以实现自主排便[2]。研究[3-4]表明,慢性功能性便秘患者肠道中菌群组成、数量均存在异常,因此在治疗时还需将重点放在肠道菌群调节方面,粪菌移植治疗可达到该效果。本院近年来通过粪菌移植联合乳果糖的方案对老年慢性功能性便秘患者进行治疗,为进一步探讨其效果,将收治的86 例慢性功能性便秘患者分作两组,分别予乳果糖和粪菌移植联合乳果糖治疗,现报道研究如下。
1 资料与方法
1.1 病例资料此次共纳入病例86 例,均为患功能性便秘并于2017年9月至2018年9月在本院接受治疗的老年患者,按电脑数字表法随机分为两组:对照组43 例,男23 例(53.49%),女20 例(46.51%);年龄63~78 岁,平均(70.52 ± 3.67)岁;病程1~3年,平均(1.51±0.23)年。实验组43 例,性别男24 例(55.81%),女19 例(44.19%);年龄62~78 岁,平均(69.21 ± 3.58)岁;病程0.5~3年,平均(1.35 ± 0.24)年。本院医学伦理会已对此次研究进行批准,两组基本资料差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准纳入标准:(1)符合《功能性便秘的罗马Ⅲ标准》[5]中慢性功能性便秘诊断标准者;(2)年龄≥60 岁者;(3)无大肠器质性病变者;(4)近1 个月未接受过相关治疗者;(5)已配合对知情同意书进行签署者。
排除标准:(1)合并严重原发性器官、系统疾病者;(2)合并贫血、全身感染者;(3)接受过腹部手术、肛周手术者;(4)存在炎症性肠病、消化系统肿瘤者;(5)认知、精神障碍者;甲状腺功能异常者;(6)粪菌移植不耐受者。
1.3 治疗方法对照组予以乳果糖口服液(Abbott Biologicals B.V.,H20171057)治疗,剂量为15 mL,口服,2 次/d,持续4 周。
实验组予以粪菌移植联合乳果糖治疗,粪菌移植方法如下:(1)供体选择。供体者需符合以下条件:①23~27 岁的健康青年;②体质量指数为18.5~23.9 kg/m2;③无艾滋病毒、肝炎病毒感染,未与此类病毒携带者接触过;④近3 个月无纹身、无非法药物使用史;⑤近3 个月未使用过抗生素、免疫抑制剂;⑥无慢性腹泻、便秘、炎症性肠病、肠道肿瘤;⑦血清学、粪便检查无异常。(2)菌悬液制备。清晨,采集供者尾便200 g,于无菌密闭容器置入,送粪菌分离室。以250 mL 生理盐水(山东齐都药业有限公司,H20113297)对50 g 粪便进行溶解,以无菌玻璃杯搅拌至浆稠状态。先后以2、1、0.5、0.25 mm 直径的不锈钢无菌分子筛对悬液进行过滤,过滤好的菌液行离心处理,6 000 g 离心15 min,沉淀重悬,置入生理盐水,保存于-80℃冰箱中。(3)移植前检查与干预。粪菌移植前3 d,患者均停止使用促排便类药物,常规予以肠镜、肠电图检查,并采集外周血液标本、留取5 g 尾便,常规行血常规检测。指导患者对粪菌移植知情同意书进行签署,治疗前1 h,经肌肉注射予以10 mg 甲氧氯普胺(成都倍特药业有限公司,H32021539)。(4)移植过程。取出菌液,置入37℃水浴锅,进行1~2 h 解冻,患者姿势调整为左侧卧位,使其头部高于脚部,将胃镜置入至十二指肠降段,插入无菌注射管(直径2 mm),通过注射器(50 mL)将150 mL粪菌分次注入。完成后送患者至病房,予以体位、活动、排便、饮食等指导。3 周治疗1 次,共治疗3 次。乳果糖治疗药物、剂量、方法与对照组一致。
1.4 观察指标(1)肠道菌群水平。治疗前及疗程结束后次日,分别对患者1 g 新鲜粪便样本进行收集,通过稀释、滴种、培养、分离等处理后,测定并计算每克粪便中氧菌群酵母菌、双歧杆菌、厌氧菌群乳杆菌、肠杆菌数量。(2)血清血管活性肠肽(vasoactine intrestinal peptide,VIP)、乙酰胆碱(acetylcholine,ACH)、c-kit 原癌基因(c-kit protooncogene protein,C-KIT)蛋白水平。分别于治疗前及疗程结束后次日对两组患者空腹静脉血液标本进行采集,VIP、ACH、C-KIT 蛋白均以酶联免疫法测定。(3)肠电图。治疗前及疗程结束后次日,分别以胃肠电图检查仪(购于合肥奥源科技发展有限公司,EGEG-5D 型)对两组胃肠动力的餐前与餐后平均幅值、餐前与餐后平均频率进行测定,检查前指导患者维持空腹状态>6 h,静息10 min 后,对结肠部位皮肤组织常规消毒,妥善连接电极片,予以固定,开启餐前肠电图按钮,对波形进行记录,10 min 后给予患者食用50 g 面包,10 min 后再次记录波形,记录10 min。(4)症状改善情况。治疗前及疗程结束后次日,分别予以患者Wexner 便秘评分、Bristol 粪便性状评分(Bristol stool form scale,BSFS)[6]、便秘患者生活质量评价表(Patient-Assessment of Constipation Quality Of Life,PAC -QOL)[7]评分,Wexner 便秘评分共8 个项目,总分为32 分,得分越高,便秘程度越严重;BSFS 评分总分为7 分,得分越高,粪便形状越软;PAC-QOL 评分共28 个条目,总分112 分,得分越低,生活质量越高。(5)安全性。记录两组患者治疗后腹胀、腹痛以及皮疹等不良症状发生情况。
1.5 统计学分析本研究数据处理软件为SPSS 20.0,计量资料以()表示,t检验,[n(%)]表示计数资料,χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 肠道菌群水平治疗前,两组粪便中氧菌群酵母菌、双歧杆菌、厌氧菌群乳杆菌、肠杆菌数量差异无统计学意义(P>0.05);治疗后,两组氧菌群酵母菌、肠杆菌数量均下降,且实验组较低,两组双歧杆菌、厌氧菌群乳杆菌数量均增多,且实验组较多,差异有统计学意义(P<0.05),见表1。
表1 两组治疗前后肠道菌群水平比较Tab.1 Comparison of intestinal flora levels between the two groups before and after treatment ±s,logN·g-1

表1 两组治疗前后肠道菌群水平比较Tab.1 Comparison of intestinal flora levels between the two groups before and after treatment ±s,logN·g-1
注:t、P 为对照组与实验组组间比较,t1、P1为对照组治疗前后组内比较,t2、P2为实验组治疗前后组内比较;与治疗前比较,#P<0.05,与对照组比较,*P<0.05
组别对照组实验组t 值P 值t1值P1值t2值P2值例数43 43氧菌群酵母菌治疗前7.12±0.34 7.11±0.36 0.133 0.591 14.788<0.001 23.506<0.001治疗后5.34±0.14#4.21±0.20#*19.227<0.001双歧杆菌治疗前7.15±0.46 7.16±0.44-0.104 0.681 16.790<0.001 27.010<0.001治疗后8.31±0.25#9.38±0.21#*20.457<0.001厌氧菌群乳杆菌治疗前5.21±0.12 5.22±0.11-0.114 0.492 18.022<0.001 20.389<0.001治疗后6.28±0.15#7.17±0.22#*17.870<0.001肠杆菌治疗前9.92±0.19 9.91±0.17 0.518 0.289 13.635<0.001 18.276<0.001治疗后8.89±0.22#8.02±0.31#*15.448<0.001
2.2 VIP 与ACH 及C-KIT治疗前,两组VIP、ACH、C-KIT 差异无统计学意义(P>0.05);治疗后,两组VIP 均下降,且实验组较对照组低,两组ACH、C-KIT 水平均提升,且实验组较对照组高,差异有统计学意义(P<0.05),见表2。
2.3 胃肠电图检查结果治疗前,两组胃肠动力的餐前与餐后平均幅值、餐前与餐后平均频率差异无统计学意义(P>0.05);治疗后,两组胃肠动力的餐前与餐后平均幅值、餐前与餐后平均频率均提升,组间对比,实验组较高,差异有统计学意义(P<0.05),见表3、图1。
表2 两组治疗前后VIP、ACH、C-KIT 水平比较Tab.2 Comparison of VIP,ACH and C-KIT levels between the two groups before and after treatment ±s
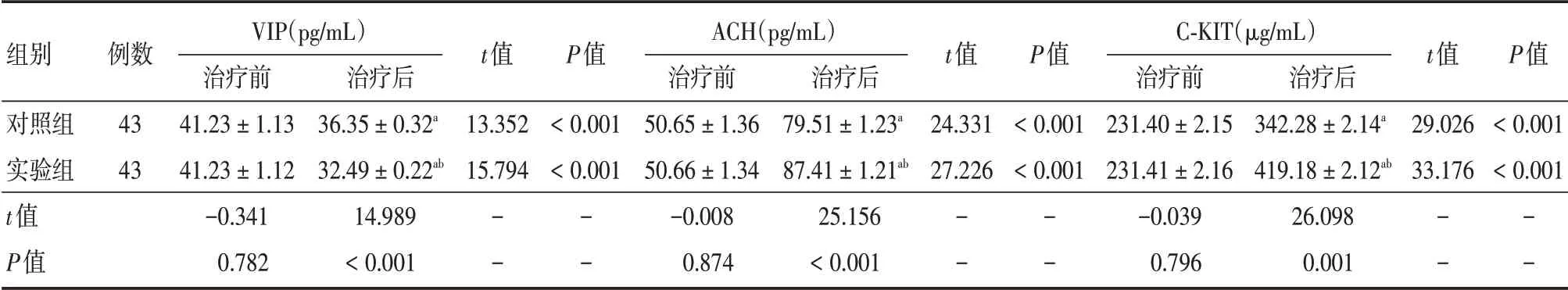
表2 两组治疗前后VIP、ACH、C-KIT 水平比较Tab.2 Comparison of VIP,ACH and C-KIT levels between the two groups before and after treatment ±s
注:与治疗前比较,aP<0.05,与对照组比较,bP<0.05
组别对照组实验组t值P值例数43 43 VIP(pg/mL)治疗前41.23±1.13 41.23±1.12-0.341 0.782治疗后36.35±0.32a 32.49±0.22ab 14.989<0.001 t值13.352 15.794--P值<0.001<0.001--ACH(pg/mL)治疗前50.65±1.36 50.66±1.34-0.008 0.874治疗后79.51±1.23a 87.41±1.21ab 25.156<0.001 t值24.331 27.226--P值<0.001<0.001--C-KIT(μg/mL)治疗前231.40±2.15 231.41±2.16-0.039 0.796治疗后342.28±2.14a 419.18±2.12ab 26.098 0.001 t值29.026 33.176--P值<0.001<0.001--
2.4 症状改善情况治疗前,两组Wexner 便秘评分、BSFS 评分、PAC-QOL 评分差异无统计学意义(P>0.05);治疗后,两组BSFS 评分均提升,且实验组较对照组高,两组Wexner 便秘评分、PACQOL 评分均降低,且实验组较对照组低,差异有统计学意义(P<0.05),见表4、图2。
2.5 安全性两组患者治疗期间均无严重性不良反应发生,生命体征处于平稳状态,对照组有3 例患者腹部出现轻微疼痛感,未作特殊处理,症状已于24 h 内消失,实验组有1 例患者腹部出现胀气感,嘱咐其保持休息时间,且留院观察2 d,腹胀感已自行缓解。
表3 两组治疗前后胃肠电图检查情况比较Tab.3 Comparison of gastrointestinal electrogram before and after treatment between the two groups ±s

表3 两组治疗前后胃肠电图检查情况比较Tab.3 Comparison of gastrointestinal electrogram before and after treatment between the two groups ±s
注:t、P 为组间对比,t1、P1为对照组组内治疗前后对比,t2、P2为实验组组内治疗前后对比;与治疗前比较,①P<0.05,与对照组比较。②P<0.05
组别对照组研究组t 值P 值t1值P1值t2值P2值例数43 43餐前平均幅值(UV)治疗前133.58±1.23 133.56±1.20 0.050 0.431 18.526<0.001 24.697<0.001治疗后158.12±2.32①175.31±2.18①②28.324<0.001餐后平均幅值(UV)治疗前185.97±2.35 185.98±1.33-0.131 0.372 26.813<0.001 35.556<0.001治疗后192.26±2.34①204.32±2.17①②22.009<0.001餐前平均频率(cpm)治疗前8.22±1.02 8.23±1.01-0.044 0.428 15.370<0.001 21.981<0.001治疗后8.61±0.21①9.32±0.36①②16.207<0.001餐后平均频率(cpm)治疗前8.56±0.24 8.57±0.23 0.190 0.271 13.056<0.001 17.701<0.001治疗后8.85±0.12①9.12±0.11①②14.378<0.001

图1 两组治疗前后肠电图检查情况Fig.1 Comparison of gastrointestinal electrogram before and after treatment between the two groups
表4 两组治疗前后胃肠电图检查情况比较Tab.4 Comparison of gastrointestinal electrogram before and after treatment between the two groups ±s

表4 两组治疗前后胃肠电图检查情况比较Tab.4 Comparison of gastrointestinal electrogram before and after treatment between the two groups ±s
注:与治疗前比较,&P<0.05,与对照组比较,@P<0.05
组别对照组实验组t 值P 值例数43 43 Wexner 便秘评分治疗前13.86±1.31 13.85±1.32-0.341 0.782治疗后7.29±1.17&5.16±0.73&@18.989<0.001 t 值15.352 19.794--P 值<0.001<0.001--BSFS 评分治疗前2.42±0.34 2.43±0.32-0.035 0.747治疗后3.93±0.19&4.81±0.12&@20.447<0.001 t 值17.791 21.875--P 值<0.001<0.001--PAC-QOL 评分治疗前55.87±2.15 55.86±2.14 0.028 0.493治疗后31.75±1.28&18.64±1.31&@23.205<0.001 t 值26.669 31.746--P 值<0.001<0.001--
3 讨论
慢性功能性便秘是常见于老年人的一种疾病,临床症状主要为排便困难,不仅可导致肠黑便病、痔疮等持续性功能性肠道疾病发生,还可导致心脑血管疾病发生的风险增大。现阶段,慢性功能性便秘的发病机制尚不明确,但临床研究多认为与饮食结构、环境、精神状态、肠道菌群失调等因素有关[8-9]。对此,临床上多通过药物对慢性功能性便秘患者进行治疗,治疗药物主要为促胃肠蠕动药、生物反馈剂、微生态制剂、泻剂等,虽可达到一定促进排便的效果,但部分患者会有药物依赖性产生,长期服药还会对肠道黏膜造成损伤,致使患者痛苦增加。

图2 两组治疗前后相关评分比较Fig.2 Score comparison between two groups before and after treatment
大量临床研究[10-11]表明,慢性功能性便秘的发生与肠道菌群失调有紧密联系性,人类肠道中存在1 000~1 500 种菌群,共同维持稳定的肠道微生态环境,此环境被打破后,患者胃肠道功能失调,因此易发便秘。基于此,临床上逐渐将乳果糖、粪菌移植等方法应用于功能性便秘治疗中,可通过改善胃肠道微生态环境达到缓解患者便秘症状的效果。乳果糖是人工合成的一种双糖,口服后,不会被小肠吸收,达到结肠后,在肠道细菌的作用下,可转化为醋酸、乳酸,提升肠道渗透压,使粪便中含水量增多,软化粪便,进而达到促进排便的效果。路惊[12]等将乳果糖应用于便秘型肠易激综合征治疗中,结果显示,治疗后患者排便次数显著增加,Bristol 评分均提升。粪菌移植指的是对功能菌群进行处理后,移植于患者肠道中,使肠道菌群得以重建,可有效改善肠道功能。刘巧云[13]等通过粪菌移植对顽固性功能性便秘进行治疗,结果显示,治愈率为37.1%,改善率为77.1%,且治疗后患者PAC-QOL 评分明显下降。
本次研究将乳果糖联合粪菌移植的方法应用于老年慢性功能性便秘患者治疗中,结果显示:(1)可改善患者肠道菌群。治疗后实验组氧菌群酵母菌、肠杆菌较对照组低,而双歧杆菌及厌氧菌群乳杆菌水平较对照组高,差异有统计学意义,提示乳果糖联合粪菌移植治疗老年慢性功能性便秘有助于降低患者氧菌群酵母菌、肠杆菌水平,并提升其双歧杆菌及厌氧菌群乳杆菌水平,改善肠道菌群环境。(2)可改善胃肠道神经递质。治疗后实验组VIP 比对照组低,同时ACH、C-KIT 水平比对照组高,差异有统计学意义,提示乳果糖联合粪菌移植治疗可使老年慢性功能性便秘患者VIP 水平降低,并提升其ACH、C-KIT 水平。(3)可改善胃肠道动力。治疗后实验组胃肠动力的餐前与餐后平均幅值、餐前与餐后平均频率均较对照组高,差异有统计学意义,提示乳果糖联合粪菌移植治疗可使老年慢性功能性便秘患者胃肠动力学指标改善。(4)可有效改善患者症状。治疗后实验组BSFS 评分比对照组高,Wexner 便秘及PAC-QOL 评分比对照组低,差异有统计学意义,提示乳果糖联合粪菌移植治疗可使老年慢性功能性便秘患者便秘程度、粪便性状以及生活质量改善。MEJI[14]等研究表明,相较于健康人员,功能性便秘患者肠道中菌群在数量、组成方面均存在异常,多表现为双歧杆菌属、乳杆菌属数量下降,肠杆菌、拟杆菌等数量增多。而通过乳果糖对慢性功能性便秘患者进行治疗,此药物属于益生元的一种,其分解的产物可为乳酸杆菌、双歧杆菌等益生菌提供生长底物,使有益菌增殖,并对有害菌进行抑制。同时,此药物可达到降低肠腔中pH 值的效果,促进肠蠕动,使结肠运转时间缩短,促进排便[15-16]。粪菌移植通过对健康人员的胃肠道细菌进行处理后移植至患者肠道,可使多种益生菌共同对肠道产生作用,对肠道菌群进行调解,使肠道中细菌分解产物促进肠道蠕动的作用增强,进而达到促进改善便秘症状的效果[17-18]。不仅如此,粪菌移植后,肠道中的有益菌增多,可使抑制性肠道神经递质的VIP水平下降,并提升ACH、C-KIT 等兴奋性肠道神经递质水平,促进胃肠道平滑肌运动,减少便秘。乳果糖与粪菌移植联合治疗老年慢性功能性便秘时,两种方法共同产生协同作用,对肠道微生态环境进行调节,使肠道中有益菌增多、有害菌减少,促进肠道蠕动,有助于进一步改善患者便秘程度、粪便性状以及生活质量改善。
综上所述,粪菌移植联合乳果糖治疗老年慢性功能性便秘有助于改善患者肠道菌群及神经递质,并且提升胃肠道动力。但此次研究缺乏大样本数据分析,且未进行长期随访、动物实验等,尚需展开进一步研究,扩大样本量的同时进行长时间随访,观察患者长期疗效,并展开动物实验,以客观探讨乳果糖联合粪菌移植治疗老年慢性功能性便秘的临床价值。
