寻常性银屑病患者白细胞介素表达水平及与银屑病面积和严重度指数相关性研究
2019-09-19夏米娜刘彦群翟晓翔
夏米娜,刘彦群,翟晓翔
寻常性银屑病是临床上较为常见的慢性炎症性皮肤病,鳞屑性红斑是主要的临床表现,复发率比较高,对患者生活、工作影响甚大,其病情的发生和发展受环境、遗传等多种因素影响[1,2]。近年来,大量研究显示,多种细胞因子与银屑病的发生发展存在一定的联系,与患者银屑病皮损面积和严重度指数(PASI)评分有相关性[2,3]。相关研究指出,IL-36与银屑病发病有着密切联系,IL-36α和IL-36γ在银屑病患者皮损中显著高表达。IL-36Ra是IL-36的天然受体拮抗剂,IL-36Ra发生基因突变导致其与IL-36的结合能力下降,促使机体皮肤组织病理反应增强,引起银屑病发生。IL-38对免疫细胞的生物学作用与IL-36Ra相似,与银屑病的发生密切相关。本文旨在对比寻常性银屑病患者血清IL-36、IL-36Ra、IL-38表达水平与正常人的差异,分析其与患者PASI评分之间的关系,现报告如下。
1 资料与方法
1.1 一般资料
1.1.1 临床资料 选择2016年1月—2017年6月徐州市中医院皮肤科接诊治疗的寻常性银屑病患者78例,其中男45例,女33例;年龄24~62岁,平均年龄(47.7±14.9)岁。所选取的患者均符合中华医学会寻常性银屑病的诊断标准[3]:临床表现为表面附着厚层银白色鳞屑,轻刮鱗屑后基底见淡红色发光半透明薄膜,刮除薄膜出现点状出血,即为蜡滴现象、薄膜现象、点状出血现象。早期组织病理学检查表现为表皮角化过度伴有角化不全,后期表现为角化过度,以淋巴细胞和组织细胞浸润为主。排除近期使用糖皮质激素或免疫抑制剂、有严重急慢性系统疾病、免疫性疾病及精神障碍的患者,所选择的患者均符合寻常性银屑病临床诊断标准。选择我院同期体检的健康志愿者78例作为对照组,其中男41例,女37例;年龄22~61岁,平均年龄(46.8±15.2)岁;两组在性别、年龄、一般资料相比差异无统计学意义(P>0.05),具有可比性。本研究所选患者及志愿者均事先知情,签署知情确认书,并获得了本院伦理委员会的批准。
1.1.2 主要试剂 酶联免疫吸附试验(ELISA)试剂盒(上海生物工程公司);免疫组化染色试剂盒(武汉博士德生物工程有限公司)。
1.2 方法
1.2.1 病情评定 患者入院后,采用PASI评分对患者病情进行分级,按照头颈部、上肢、躯干、下肢4个部分对全身进行分区,面积评分:检查计算每部分病变面积百分比,按照0~6进行评分。严重程度评分:对每一部分红斑、浸润、鳞屑3项临床特征分别进行评分,每项临床特征按照0~4评分,严重度评分为各项临床特征评分相加。PASI(头部)=0.1×面积评分×严重度评分,PASI(上肢)=0.2×面积评分×严重度评分,PASI(躯干)=0.3×面积评分×严重程评分,PASI(下肢)=0.4×面积评分×严重度评分,PASI总分为4分部评分相加。根据PASI总分进行病情分级,轻度:PASI≤15,中度:15<PASI<30,重度:PASI≥30。
1.2.2 ELISA检测IL-36、IL-36Ra及IL-38水平 采集银屑病患者和对照者清晨空腹静脉血5 ml,2 000 r/min离心处理10 min,采集上层血清,-80℃低温储存备用。采用ELISA测定IL-36、IL-36Ra及IL-38水平,具体操作如下:采用竞争性抑制法ELISA试剂盒,使用纯化抗体包被微孔板,使抗体充分吸附于微孔壁,制作固相载体,实验中加入待测样本和酶联亲和物,酶联亲和物含有酶标记抗原,采取温育反应使其充分结合在微孔壁上,通过与抗体竞争从而形成标记的抗原复合物,洗去未结合部分,加入底物反应后变色,读取标准品孔的吸光度值,绘制标准曲线后反算出待测样本的指标浓度数值。
1.2.3 免疫组化染色 采集78例患者皮损组织,从典型皮损位置处切取,切取范围可扩大至皮损边缘正常皮肤。采集的皮肤组织置于10%甲醛磷酸缓冲液中进行固定,对固定后的皮肤组织进行脱水,透明后石蜡包埋,制成蜡块后备用。每例患者至少制作5组切片,分别检测各项指标染色结果。采用免疫组化染色试剂盒进行染色操作,具体步骤严格按照试剂盒说明进行,根据光学显微镜拍照结果判断阳性率。胞核或胞质内含有棕色颗粒的细胞被视为阳性细胞,细胞因子IL-36、IL-36Ra、IL-38主要分布于胞质。阴性对照为无明显染色颗粒或组织颜色与背景色相一致。在显微镜下观察表皮全层阳性细胞的染色深度和分布情况,高倍镜视野(×200)下取5个视野,采用Image pro plus 6.0软件分析图像。
1.3 统计学方法
采用SPSS19.0统计学软件进行数据处理,计量资料采用均数±标准差描述,两组间比较采用成组t检验,应用非参数spearman相关性检验因子表达水平与相应的PASI评分的相关性,组间计量资料比较采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 不同病情分级患者一般资料比较
轻度与中重度患者男女比例、平均年龄相比差异无统计学意义(P>0.05),详见表1。
表1 不同病情分级患者一般资料比较 (±s)
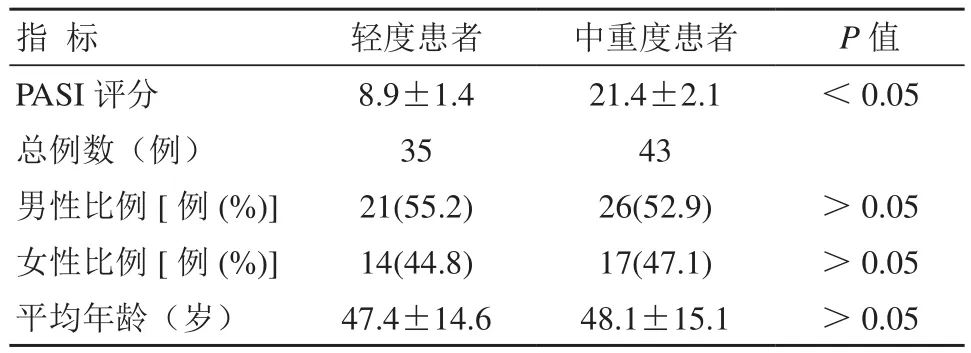
表1 不同病情分级患者一般资料比较 (±s)
指 标 轻度患者 中重度患者 P值PASI评分 8.9±1.4 21.4±2.1 <0.05总例数(例) 35 43男性比例[例(%)]21(55.2) 26(52.9) >0.05女性比例[例(%)]14(44.8) 17(47.1) >0.05平均年龄(岁) 47.4±14.6 48.1±15.1 >0.05
2.2 IL-36、IL-36Ra及IL-38在不同病情分级患者中的免疫组化染色结果
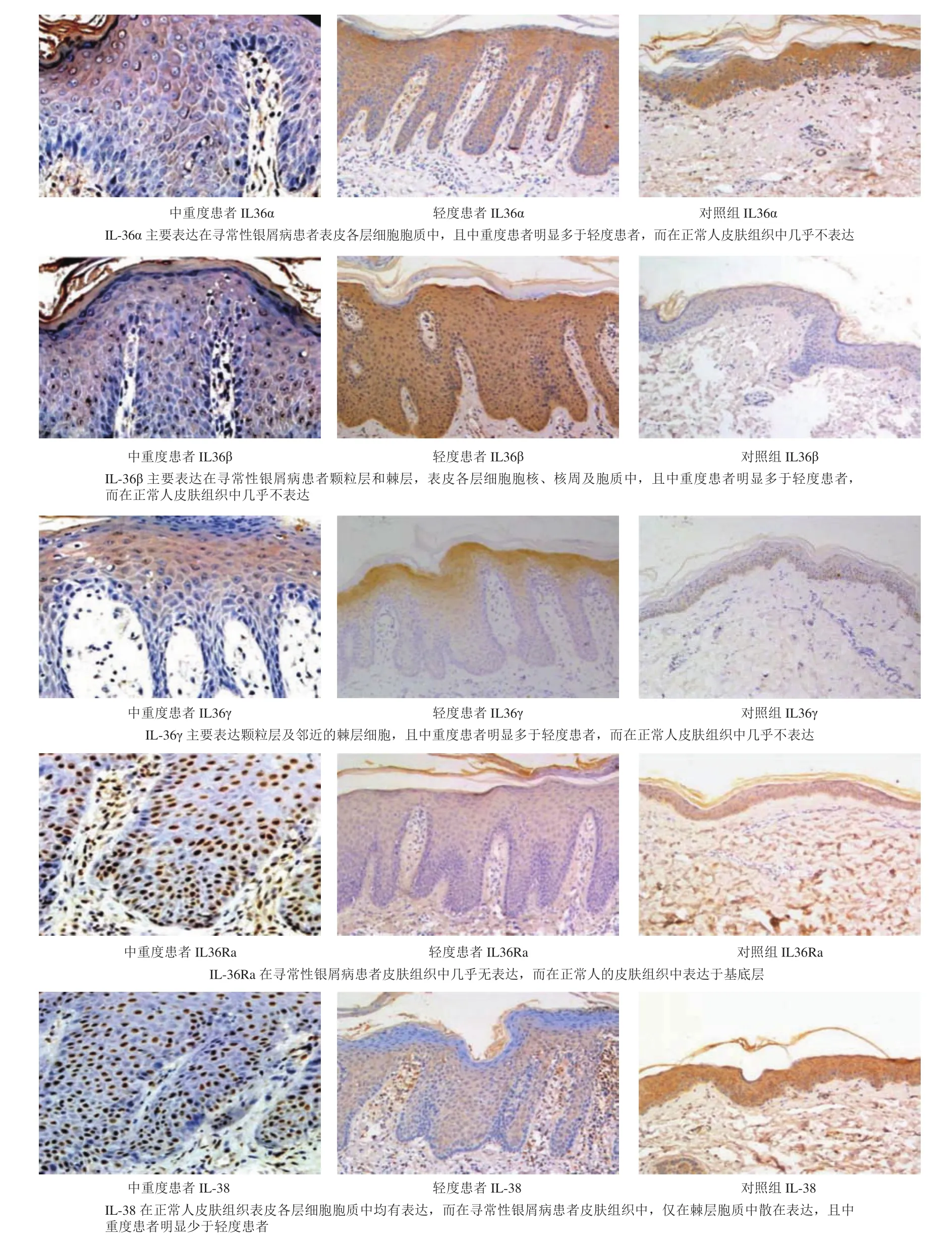
图1 IL-36、IL-36Ra及IL-38在不同病情分级银屑病患者中的免疫组化组织病理(DAB染色×200)
通过对不同病情分级患者及正常人皮肤组织的免疫组化染色发现,各因子在不同病情分级患者及正常人皮肤组织中均有表达。不同病情分级寻常性银屑病患者IL-36α主要表达在表皮各层细胞胞质中,且中重度患者明显多于轻度患者;IL-36β主要表达在颗粒层和棘层细胞,但是在不同病情分级寻常性银屑病患者表皮各层细胞胞核、核周及胞质中,也均有不同程度的表达,且中重度患者明显多于轻度患者;IL-36γ主要表达颗粒层及邻近的棘层细胞,而在正常人皮肤组织中表达显著少于寻常性银屑病患者;IL-36Ra与上述相反,其在不同病情分级的寻常性银屑病患者皮肤组织中几乎无表达,而在正常人的皮肤组织中表达于基底层;IL-38在正常人皮肤组织表皮各层细胞胞质中均有表达,而在寻常性银屑病患者皮肤组织中,仅在棘层细胞胞质中散在表达(图1)。
2.3 IL-36、IL-36Ra及IL-38表达水平比较
轻度及中重度寻常性银屑病患者IL-36α、IL-36β、IL-36γ表达水平高于对照组,IL-36Ra和IL-38表达水平低于对照组,差异具有统计学意义(P< 0.05);中重度患者 IL-36α、IL-36β、IL-36γ表达水平高于轻度患者,IL-36Ra和IL-38表达水平低于轻度患者,差异具有统计学意义(P<0.05),详见表2。
表2 IL-36、IL-36Ra及IL-38表达水平比较 (±s,ng/L)
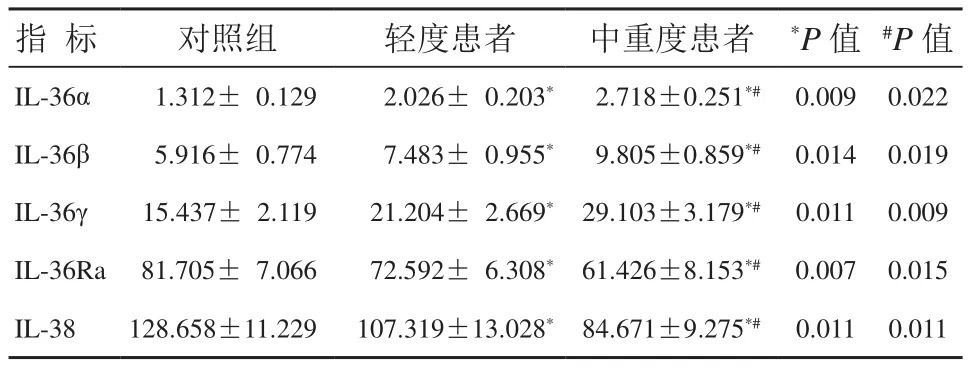
表2 IL-36、IL-36Ra及IL-38表达水平比较 (±s,ng/L)
注:与对照组相比,*P<0.05;与轻度患者相比,#P<0.05
指 标 对照组 轻度患者 中重度患者 *P值 #P值IL-36α 1.312± 0.129 2.026± 0.203* 2.718±0.251*# 0.009 0.022 IL-36β 5.916± 0.774 7.483± 0.955* 9.805±0.859*# 0.014 0.019 IL-36γ 15.437± 2.119 21.204± 2.669* 29.103±3.179*# 0.011 0.009 IL-36Ra 81.705± 7.066 72.592± 6.308* 61.426±8.153*# 0.007 0.015 IL-38 128.658±11.229 107.319±13.028* 84.671±9.275*# 0.011 0.011
2.4 IL-36、IL-36Ra及IL-38表达水平与PASI评分相关性
IL-36α、IL-36β、IL-36γ表达水平与 PASI评分呈正相关性,P<0.01;IL-36Ra和IL-38表达水平与PASI评分呈负相关性,P<0.05,详见表3。
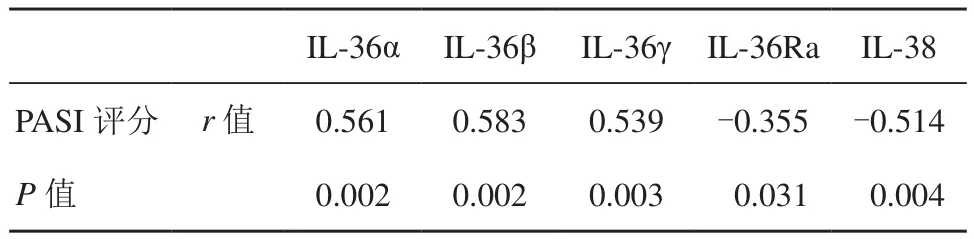
表3 IL-36、IL-36Ra及IL-38表达水平与PASI评分相关性
3 讨论
近年来,我国银屑病的发病人数逐年上升,多为寻常性银屑病。该病治疗难度大,病情易复发,具有“隐性发病”的特征。另外病情的发生发展受环境、机体免疫功能及遗传等多种因素影响,发病后对患者的工作、生活造成较大的负面影响,所以需要加强疾病防治[4]。
IL由白细胞产生并作用于白细胞之间,在机体的信息传递、免疫调节、细胞活化、增殖分化及炎症反应中有着重要的作用,与细胞生长因子协同作用,调节机体免疫和造血功能[5-8]。目前发现了至少38种IL,按照IL-1~IL-38编号。相关研究指出,IL-17、IL-21、IL-37等多种细胞因子在银屑病皮损中均有显著地表达,对于银屑病的病情分析有着重要的价值和意义[9-11]。IL-36是IL-1的家族成员之一,可由活化后的B淋巴细胞、角质形成细胞等多种细胞产生,包括 IL-36γ、IL-36α、IL-36β 3种次分类,其中 IL-36a只有T淋巴细胞可以产生,是一些具有生物活性的分子。IL-36与特异性受体IL-36R结合后才能促进炎症的发展,IL-36Ra是IL-36的天然受体拮抗剂。IL-36、IL-36R、IL-36Ra主要表达于皮肤、气管等上皮组织中,IL-36γ多表达于子宫中,IL-36α多表达于胸腺中,IL-36β多表达于关节软骨细胞、滑膜组织及骨骼肌角质细胞中等[12]。有研究指出,IL-36分子在皮肤中的表达更为显著,与银屑病的发生发展有着紧密的联系,银屑病患者皮损中IL-36及IL-36R高表达,与健康人或患者未受损皮肤相比显著偏高。IL-38原名IL-1F10,是IL-36的5个受体拮抗体之一,在人体免疫组织中的表达较为广泛,在扁桃体B淋巴细胞和皮肤中表达更为显著,在心脏等无免疫功能的组织中表达不明显[13,14]。相关研究证明,IL-38与IL-36Ra具有相似的生物学作用,均是通过抑制IL-36与IL-36R相结合从而产生抗炎作用。
本文研究中,不同病情分级银屑病患者性别、年龄无明显差异(P>0.05),说明寻常性银屑病病情严重程度与患者年龄、性别不存在明显关联。银屑病患者血清IL-36、IL-36Ra及IL-38水平显著高于对照组(P<0.05),中重度患者指标水平显著高于轻度患者(P<0.05),由此表明银屑病病情越严重,外周血血清IL-36α、IL-36β、IL-36γ表达水平越高,IL-36Ra和IL-38表达水平越低,IL-36、IL-36Ra及IL-38或可作为银屑病患者重要的外周血标志物。IL-36α(P=0.002)、IL-36β(P=0.002)、IL-36γ(P=0.003)水平与PASI评分呈正相关,IL-36Ra、IL-38水平与PASI评分呈负相关,表明IL-36、IL-36Ra及IL-38表达水平与PASI存在显著的线性相关性。
相关研究指出,IL-36主要分布在皮肤、支气管上皮和脑组织中,通过与受体复合体合作作用于上皮细胞、免疫细胞等。IL-36通过诱导促炎性细胞因子、抗菌肽、趋化因子等促进炎症反应以抵御外界病原微生物,同时由于促炎性细胞因子及趋化因子等释放,诱发银屑病等自身免疫性疾病或免疫相关的炎症性疾病,其表达水平的高低与银屑病的发生、发展及病情程度存在紧密联系[15]。杨晓娥[16]在其研究中指出,不同病情严重程度的寻常性银屑病患者血清IL-36γ 、IL-36β、IL-36α和IL-36Ra水平存在显著差异,中重度患者 IL-36γ 、IL-36β、IL-36α 水平明显高于轻度患者,IL-36Ra水平明显低于轻度患者,说明IL-36和IL-36Ra水平与银屑病的病情严重程度密切相关,本文结论与其一致。
综上所述,寻常性银屑病患者血清IL-36、IL-36Ra及IL-38表达水平与银屑病皮损面积和严重程度指数存在紧密的联系,具有一定的相关性,可以为银屑病临床诊断、治疗及病情分析提供参考。
